今日頭條
杭州浩博乙肝ASO療法上Ⅰ期臨床�����。浩博醫(yī)藥反義寡核苷酸藥物AHB-137在新西蘭健康志愿者中開(kāi)展的Ⅰ期臨床完成第一隊(duì)列受試者給藥����。該項(xiàng)試驗(yàn)旨在評(píng)估AHB-137在健康志愿者中的安全性、耐受性��、藥代動(dòng)力學(xué)以及在慢性乙肝患者中的初始療效��。AHB-137可靶向所有HBV RNA將其降解�����,在臨床前研究中已顯示出對(duì)乙肝表面抗原的降低能力����,并具有良好的安全性����。
國(guó)內(nèi)藥訊
1.康寧杰瑞「地舒單抗」生物類(lèi)似藥報(bào)產(chǎn)�����。康寧杰瑞地舒單抗注射液的上市申請(qǐng)獲CDE受理����。地舒單抗是一款I(lǐng)gG2單抗��,原研產(chǎn)品由安進(jìn)開(kāi)發(fā)上市��,分別為:Xgeva(安加維��,70mg/ml)和Prolia(普羅力��,60mg/ml)����,其中Prolia用于治療骨質(zhì)疏松,Xgeva用于治療癌癥相關(guān)骨病����。目前,國(guó)內(nèi)開(kāi)發(fā)地舒單抗生物類(lèi)似藥的企業(yè)有13家�����。其中博安生物的博優(yōu)倍已于去年11月獲批上市,是全球首個(gè)上市的Prolia生物類(lèi)似藥�����。
2.齊魯新冠藥物啟動(dòng)III期臨床����。齊魯制藥開(kāi)發(fā)擬用于治療新冠感染的QLS1128緩釋片在clinicaltrials.gov網(wǎng)站上登記一項(xiàng)III期臨床,評(píng)估用于治療輕中度新冠病毒感染患者有效性和安全性����。該項(xiàng)試驗(yàn)計(jì)劃納入1220例輕中度新冠病毒感染患者,預(yù)計(jì)將于今年6月30日完成�����。目前����,國(guó)內(nèi)已有三款新冠藥物獲批上市,分別是先聲藥業(yè)的3CL抑制劑先諾特韋�����、真實(shí)生物的RdRp抑制劑阿茲夫定以及君實(shí)生物的RdRp抑制劑VV116����。
3.上海雅科GPRC5D靶向CAR-T見(jiàn)刊JCO。上海雅科生物開(kāi)發(fā)的GPRC5D CAR-T細(xì)胞療法治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤(R/R MM)的II期臨床結(jié)果發(fā)表在期刊《Journal of Clinical Oncology》上����。在中位隨訪5.2個(gè)月時(shí)(范圍:3.2-8.9)時(shí),總緩解率(ORR)為91%��,包括11例(33%)嚴(yán)格完全緩解�����,10例(30%)完全緩解��,4例(12%)非常好的部分緩解和5例(15%)部分緩解����。在既往接受過(guò)BCMA CAR-T細(xì)胞治療的9例患者中,ORR達(dá)到100%�����。
4.藥明巨諾CD19靶向CAR-T上LBCL臨床�����。藥明巨諾CD19靶向CAR-T瑞基奧侖賽注射液(倍諾達(dá)®)在研究者發(fā)起的、用于一線治療高風(fēng)險(xiǎn)大B細(xì)胞淋巴瘤(LBCL)的臨床試驗(yàn)(IIT)完成首例患者的回輸治療��。倍諾達(dá)®是中國(guó)首個(gè)獲批的CAR-T產(chǎn)品����,已被批準(zhǔn)用于r/r LBCL和難治性濾泡性淋巴瘤(r/r FL)兩項(xiàng)適應(yīng)癥。在關(guān)鍵性研究(RELIANCE)中��,倍諾達(dá)®在至少接受過(guò)二線治療的r/r LBCL患者中顯示出良好的安全性和積極的療效�����。
5.山東博安CEA/CD3雙抗報(bào)IND��。博安生物自研1類(lèi)生物制品注射用BA1202的臨床試驗(yàn)申請(qǐng)獲CDE受理����,擬開(kāi)發(fā)用于治療結(jié)直腸癌、胰腺導(dǎo)管腺癌等CEA陽(yáng)性腫瘤����。BA1202是一款CEA/CD3雙抗,已在臨床前研究中顯示出對(duì)腫瘤細(xì)胞具有較強(qiáng)的細(xì)胞毒性�����,可顯著減少細(xì)胞因子的釋放,具有更好的治療潛力��。目前��,全球尚無(wú)CEA/CD3雙抗獲批上市��;羅氏同類(lèi)藥物RO6958688是全球唯一進(jìn)入臨床開(kāi)發(fā)的的CEA/CD3雙抗����。
6.浙江康佰裕CAR-T產(chǎn)品報(bào)IND�����。浙江康佰裕生物1類(lèi)生物制品"CBG002 CAR-T細(xì)胞注射液"的臨床試驗(yàn)申請(qǐng)獲CDE受理�����?���?蛋墼I飳?zhuān)注于新型抗腫瘤免疫治療產(chǎn)品開(kāi)發(fā),旗下?lián)碛袛?shù)項(xiàng)CAR-T細(xì)胞相關(guān)專(zhuān)利�����,涵蓋血液瘤及實(shí)體瘤領(lǐng)域。2021年����,該公司在中國(guó)臨床實(shí)驗(yàn)注冊(cè)中心登記一項(xiàng)臨床試驗(yàn),評(píng)估ILT3嵌合抗原受體基因修飾的自體T細(xì)胞治療復(fù)發(fā)/難治性急性髓系白血?���。∕4/M5)的安全性和有效性。
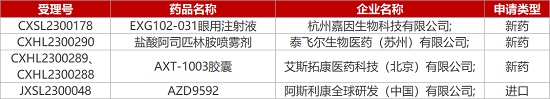
7.阿斯利康EGFR/c-Met-ADC在華報(bào)IND ��。阿斯利康1類(lèi)生物制品AZD9592的臨床試驗(yàn)申請(qǐng)獲CDE受理��。AZD9592是一款EGFR/c-Met 抗體偶聯(lián)藥物(ADC)��,采用新型拓?fù)洚悩?gòu)酶1載荷�����,主要解決奧希替尼耐藥�����。在國(guó)內(nèi)�����,百奧賽圖布局的一款EGFR/MET雙抗ADC(YH013),已在臨床前研究中顯示出比母本單抗和單價(jià)抗體更好的結(jié)合NCI-H1975(EGFR+ MET+)腫瘤細(xì)胞系的潛力�����,并具有積極的體內(nèi)抗腫瘤活性��。
國(guó)際藥訊
1.軟骨發(fā)育不全創(chuàng)新療法在美報(bào)sNDA����。BioMarin公司C型利鈉肽類(lèi)似物Voxzogo(vosoritide)注射液的補(bǔ)充新藥申請(qǐng)(sNDA)獲FDA受理��,用以治療5歲以下軟骨發(fā)育不全(achondroplasia)兒童��,預(yù)計(jì)今年10月21日前完成審查����。Voxzogo通過(guò)阻斷FGFR3的活性直接靶向軟骨發(fā)育不全的潛在病理生理學(xué),從而促進(jìn)軟骨內(nèi)骨形成�����,恢復(fù)患兒的生長(zhǎng)速率��。此前,F(xiàn)DA已批準(zhǔn)Voxzogo用于治療兒童軟骨發(fā)育不全導(dǎo)致的生長(zhǎng)板未閉合��。
2.度普利尤單抗報(bào)自發(fā)性尋麻疹sBLA��。再生元與賽諾菲合作開(kāi)發(fā)的IL-4/IL-13抑制劑度普利尤單抗(Dupixent)的補(bǔ)充生物制品許可申請(qǐng)(sBLA)獲FDA受理�����,用于治療H1抗組胺治療無(wú)法充分控制的慢性自發(fā)性蕁麻疹(CSU)12歲及以上患者��,PDUFA日期為今年10月22日����。在Ⅲ期試驗(yàn)(LIBERTY-CUPID研究A和B)中,與單獨(dú)使用抗組胺藥相比����,度普利尤單抗聯(lián)合標(biāo)準(zhǔn)治療使患者發(fā)生瘙癢和蕁麻疹的幾率降低近一倍,癥狀持續(xù)改善長(zhǎng)達(dá)24周�����。
3.默沙東/Moderna癌癥疫苗申請(qǐng)加速批準(zhǔn)����。Moderna公司與默沙東聯(lián)合開(kāi)發(fā)的個(gè)體化mRNA癌癥疫苗mRNA-4157/V940將向FDA遞交加速批準(zhǔn)上市申請(qǐng)����,聯(lián)合PD-1單抗Keytruda輔助治療完全切除后的高危黑色素瘤患者�����。在IIb期研究KEYNOTE-942中�����,聯(lián)合輔助治療較Keytruda顯著改善患者的無(wú)復(fù)發(fā)生存期����,使復(fù)發(fā)或死亡的風(fēng)險(xiǎn)降低44%(HR=0.56 [95% CI��,0.31-1.08]�����;單側(cè)p值=0.0266)�����。今年2月��,F(xiàn)DA已授予其突破性療法認(rèn)定。
4.禮來(lái)抗Aβ療法一項(xiàng)臨床實(shí)驗(yàn)失敗�����。3月8日����,禮來(lái)宣布抗β淀粉樣蛋白(Aβ)療法Solanezumab在美國(guó)國(guó)家衰老研究所等機(jī)構(gòu)支持的一項(xiàng)二級(jí)預(yù)防隨機(jī)臨床試驗(yàn)未能達(dá)到主要終點(diǎn)和次要終點(diǎn)。該研究于2013年啟動(dòng)����,共入組1,100多名大腦中有淀粉樣蛋白沉積但還沒(méi)有出現(xiàn)阿爾茨海默病臨床癥狀的老年人(65-85歲)。結(jié)果顯示:Solanezumab僅與可溶性淀粉樣蛋白結(jié)合�����,不能顯著去除沉積的淀粉樣斑塊�����。
5.CNS藥物公司完成1.12億美元B輪融資�����。專(zhuān)注于中樞神經(jīng)系統(tǒng)(CNS)疾病的生物醫(yī)藥公司Noema宣布完成高達(dá)1.03億瑞士法郎(約1.12億美元)的B輪融資�����。此輪融資將用于推進(jìn)Noema已處于中期臨床階段的四個(gè)候選藥物的開(kāi)發(fā)。其先導(dǎo)化合物basimglurant(NOE-101)是一種谷氨酸受體5(mGluR5)抑制劑�����,擬用于治療三叉神經(jīng)痛相關(guān)的重度疼痛和結(jié)節(jié)性硬化癥所致癲癇發(fā)作��;gemlopodect(NOE-105)是一款針對(duì)Tourette綜合征和童年發(fā)作的言語(yǔ)流暢性障礙的PDE10a抑制劑��。
6.2022年艾伯維CEO收入2630萬(wàn)美元�����。艾伯維日前在一份證券交易委員會(huì)備案中披露�����,其CEO Gonzale去年收入達(dá)2630萬(wàn)美元����,與2021年相比增長(zhǎng)10%�����。其中底薪未變,股票期權(quán)獎(jiǎng)勵(lì)增加約320萬(wàn)美元�����。根據(jù)財(cái)報(bào)����,艾伯維2022全年總收入580.54億美元,同比增長(zhǎng)3.3%����。自免領(lǐng)域收入為289.24億美元,同比增長(zhǎng)14.4%����;血液腫瘤業(yè)務(wù)收入65.77億美元(-9%),神經(jīng)科學(xué)產(chǎn)品收入65.28億美元(+10.1%)��,美學(xué)業(yè)務(wù)收入53.33億美元(+1.9%)��。
醫(yī)藥熱點(diǎn)
1.首個(gè)國(guó)產(chǎn)帶狀皰疹疫苗定價(jià)1369元/支��。福建省公共資源交易網(wǎng)發(fā)布公開(kāi)信息稱����,百克生物的帶狀皰疹減毒活疫苗成交價(jià)格為1369元/支�����。這是首個(gè)國(guó)產(chǎn)帶狀皰疹減毒活疫苗�����,今年1月31日獲國(guó)家藥監(jiān)局批準(zhǔn)上市����。據(jù)估計(jì)����,2030年中國(guó)帶狀皰疹疫苗市場(chǎng)規(guī)模將達(dá)到560億元;百克帶狀皰疹疫苗將與葛蘭素史克重組帶狀皰疹疫苗Shingrix進(jìn)一步爭(zhēng)奪國(guó)內(nèi)市場(chǎng)����。
2.阜外醫(yī)院完成全球首例機(jī)器人血管介入手術(shù)。近日�����,中國(guó)醫(yī)學(xué)科學(xué)院阜外醫(yī)院竇克非教授和顏紅兵教授����,帶領(lǐng)中國(guó)醫(yī)學(xué)科學(xué)院阜外醫(yī)院深圳醫(yī)院冠心病中心團(tuán)隊(duì)完成了全球首例全程機(jī)器人輔助冠狀動(dòng)脈造影。這也是全球首款可同時(shí)開(kāi)展造影及介入治療的手術(shù)機(jī)器人完成的首例手術(shù)��。與傳統(tǒng)血管介入手術(shù)相比��,血管介入機(jī)器人優(yōu)勢(shì)明顯��,可實(shí)現(xiàn)室外操作�����,避免射線輻射��,且手術(shù)更穩(wěn)定����。
3.國(guó)家醫(yī)保局回應(yīng)盲人醫(yī)療按摩能否納入醫(yī)保。有人大代表提出關(guān)于盲人醫(yī)療按摩納入醫(yī)保定點(diǎn)����,逐步實(shí)現(xiàn)醫(yī)保報(bào)銷(xiāo)的建議。國(guó)家醫(yī)保局日前作出回復(fù)表示����,目前全國(guó)有12000余名盲人醫(yī)療按摩人員,開(kāi)辦了1000余家盲人醫(yī)療按摩所,其中納入醫(yī)保定點(diǎn)的有近300家��。目前����,將盲人醫(yī)療按摩所全部納入醫(yī)保定點(diǎn)存在一定困難,主要是因?yàn)槊と酸t(yī)療按摩人員身份屬性未明確����,盲人醫(yī)療按摩所未納入醫(yī)療機(jī)構(gòu)目錄。
評(píng)審動(dòng)態(tài)
1. CDE新藥受理情況(03月09日)
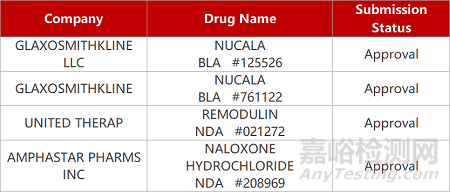
2. FDA新藥獲批情況(北美03月08日)