權(quán)威醫(yī)學(xué)期刊《英國醫(yī)學(xué)雜志》在2021年12月的專輯中分析總結(jié)了中國公共衛(wèi)生政策、非藥物干預(yù)措施在疫情防控中的作用�,其中及早確診病例并進(jìn)行隔離治療是中國非藥物干預(yù)措施的關(guān)鍵一環(huán),而發(fā)現(xiàn)病例需要體外診斷試劑產(chǎn)品�。隨著新冠疫情發(fā)展態(tài)勢的改變,各國公共衛(wèi)生政策�、新冠體外診斷試劑產(chǎn)品的審批和應(yīng)用也在演進(jìn)。本文通過對比幾個國家或組織的新冠體外診斷試劑審批流程�、審評要求,梳理審評的產(chǎn)品數(shù)據(jù)差異,分析體外診斷試劑監(jiān)管與公共衛(wèi)生應(yīng)急處置的關(guān)系�,總結(jié)我國抗擊新冠疫情的經(jīng)驗,為應(yīng)急監(jiān)管體系的持續(xù)完善提供參考�。
一、新冠體外診斷試劑應(yīng)急審批流程及審批要求對比
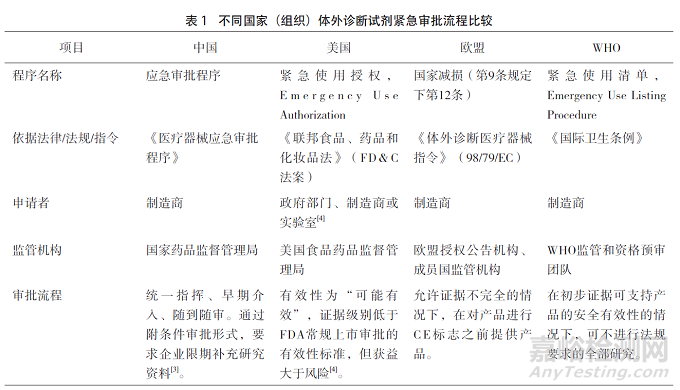
體外診斷試劑緊急審批流程對比����。面對新冠疫情這一突發(fā)公共衛(wèi)生事件,各國(組織)均啟動對新冠體外診斷試劑的緊急審批程序��。參考2020年6月國家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評中心發(fā)布的比較中美醫(yī)療器械應(yīng)急監(jiān)管的文章����,本文提煉并補(bǔ)充歐盟和WHO相應(yīng)部分內(nèi)容,如表1�。
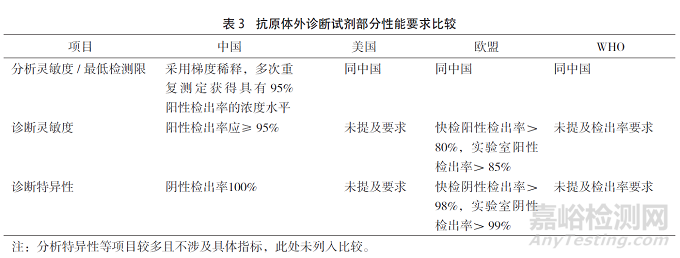
新冠體外診斷試劑審評要求對比。新冠體外診斷試劑按技術(shù)原理可以分為核酸��、抗體�、抗原三大類型。鑒于已有文章比對中國����、美國及WHO截至2020年4月在新冠核酸檢測試劑審評上的差異,且2022年3月11日我國國務(wù)院應(yīng)對新冠疫情聯(lián)防聯(lián)控機(jī)制綜合組決定在核酸檢測基礎(chǔ)上增加抗原檢測作為補(bǔ)充����,因此本文選擇截至2022年3月24日對抗原體外診斷試劑的質(zhì)量管理、部分性能指標(biāo)�、臨床試驗要求三大方面進(jìn)行簡要比對,見表2����、表3、表4��。


二����、差異原因分析
從已獲批不同原理體外診斷試劑數(shù)量統(tǒng)計來看,美國��、WHO�、中國主要以核酸診斷試劑產(chǎn)品為主,歐盟則主要選擇抗原檢測試劑產(chǎn)品����。不同類型產(chǎn)品取向與各國的檢測產(chǎn)業(yè)背景、應(yīng)用場景對應(yīng)的數(shù)量需求不同有關(guān)�。大規(guī)模核酸檢測需要多環(huán)節(jié)配合,包括采樣��、運(yùn)輸、實驗室建立和運(yùn)行等步驟����。是否使用核酸診斷試劑需要結(jié)合當(dāng)?shù)貙嶒炇医ㄔO(shè)能力、搭建檢測體系成本并根據(jù)檢測需求綜合考量����。中國和美國人口較多、檢測需求大��,并且有能力在短時間內(nèi)改造或新建符合資質(zhì)的生物實驗室用于核酸檢測��。中國作為世界上最大的體外診斷試劑制造和出口國��,使用核酸體外診斷試劑成本較低����,由政府大規(guī)模集中采購的方式也使政府有一定程度議價權(quán),進(jìn)一步降低了試劑盒的使用成本��。歐盟由于成員國較多國情復(fù)雜��,許多小國人口較少�,搭建核酸檢測實驗室體系的人均成本較高,選擇抗原診斷試劑盒作為主要的體外診斷方式符合實際情況�。WHO作為國際組織����,有能力搭建完整的檢測體系并組織一定規(guī)模的集中核酸檢測��,在審批時也通過了大量核酸診斷試劑盒��。
對比各國審評要求�,我國對于抗原體外試劑從質(zhì)量管理要求�、性能要求和臨床試驗要求各方面都較詳細(xì)且嚴(yán)格。一方面�,審評要求的差異與各國本身監(jiān)管理念、監(jiān)管傳統(tǒng)和行業(yè)發(fā)展水平有關(guān)��。而新冠體外試劑由于產(chǎn)品特殊性�,審評要求也需要和公共衛(wèi)生政策達(dá)成一致。以診斷靈敏度與特異性為例����,只有中國與歐盟提及相關(guān)要求且中國對檢出率要求較高。原因在于中國采用的公共衛(wèi)生措施相比于其他國家更嚴(yán)格��,檢測病例是防控措施的第一環(huán)��,對于后續(xù)步驟有指導(dǎo)作用����,使用體外檢測試劑出現(xiàn)假陽性/假陰性導(dǎo)致后續(xù)的隔離等環(huán)節(jié)會造成更高的社會成本��。主權(quán)國家在疫情期間采取的公共衛(wèi)生措施需要依賴新冠體外檢測報告作為個體出入國際��、地區(qū)間輔助憑證�,因此其檢測準(zhǔn)確度必須在較高水平����。
三、討論與建議
科學(xué)防疫精準(zhǔn)監(jiān)督推動防疫措施落到實處�。國情和非藥物干預(yù)措施決定了相關(guān)醫(yī)療器械的應(yīng)用場景,從而確立了“應(yīng)急”的“急”在不同醫(yī)療器械上的程度����,也對監(jiān)管要求中性能指標(biāo)、應(yīng)用場景提出了具體需求��。中國對體外診斷試劑的監(jiān)管匹配了政府主導(dǎo)“快速遏制”的非藥物干預(yù)措施�,并且隨著新變種特點、疫情情況進(jìn)行演進(jìn)��。中國公共衛(wèi)生措施中最主要的區(qū)別在于是否主動檢測病例��,這是所有措施中最核心的步驟����,也是之后隔離治療����、密切接觸者追蹤隔離的前提�,通過追蹤已有病例行程將不同地區(qū)通過風(fēng)險程度進(jìn)行劃分并進(jìn)行大規(guī)模集中的核酸體外診斷;隨著新變種成為主要流行毒株��,中國增加了抗原檢測作為輔助手段����,并更新了主動核酸檢測的組織方式�。主動檢測病例和后續(xù)對于密切接觸者的管控隔離會對社會運(yùn)作和經(jīng)濟(jì)產(chǎn)生負(fù)面影響,診斷出現(xiàn)假陽性或假陰性導(dǎo)致的機(jī)會成本大大增加��,診斷產(chǎn)品的準(zhǔn)確性和質(zhì)量控制十分重要�,因此我國主要采用核酸檢測且相關(guān)質(zhì)量標(biāo)準(zhǔn)較高。
建章立制健全重大公共衛(wèi)生事件應(yīng)對機(jī)制�。以新冠這一重大衛(wèi)生公共事件為契機(jī),我國監(jiān)管部門總結(jié)經(jīng)驗����,完善相關(guān)法律法規(guī),填補(bǔ)創(chuàng)新和緊急情況下體外診斷試劑適用的相關(guān)條例��,使體外診斷試劑申請審批在緊急情況下有法可依。中國在疫情期間頒布了《體外診斷試劑注冊與備案管理辦法》����,概括來說整個體外診斷試劑的申請流程中強(qiáng)化了質(zhì)量管理的理念,細(xì)化了申請流程��。對于醫(yī)療器械大類更新了《醫(yī)療器械監(jiān)督管理條例》����,強(qiáng)調(diào)了創(chuàng)新醫(yī)療器械的重要性;放開檢測報告��;新增“罕見疾病�、嚴(yán)重危及生命且尚無有效治療手段的疾病”和“特別重大突發(fā)公共衛(wèi)生事件或者其他嚴(yán)重威脅公眾健康的緊急事件”審批條件;國內(nèi)尚無同品種產(chǎn)品上市的體外診斷試劑可自行研制使用�;在特定情況下,可進(jìn)口少量第二類����、第三類醫(yī)療器械等。
完善科學(xué)監(jiān)管體系保障公眾知情權(quán)�。應(yīng)急情況下時間資源稀缺、產(chǎn)品又需要創(chuàng)新和技術(shù)�,如何繼續(xù)提高監(jiān)管科學(xué)性方面我國也可以向發(fā)達(dá)國家和地區(qū)學(xué)習(xí),引入多個相關(guān)方,拓展應(yīng)急資源來源和利用效率�。比如美國、歐盟和WHO均公開每一項已審批通過的試劑的詳細(xì)審批信息和各技術(shù)指標(biāo)�、臨床試驗結(jié)果,這樣有助于社會監(jiān)督監(jiān)管流程并學(xué)習(xí)了解產(chǎn)品信息����。我國也有專家提及,作為疫情防控工作的一個環(huán)節(jié)����,公布相關(guān)審評信息,以緩解公眾恐慌情緒����、消除疑惑�。