摘 要 Abstract
現(xiàn)代生物技術(shù)的快速發(fā)展使生物醫(yī)藥行業(yè)發(fā)生了革命性的變化�。疫苗的開發(fā)雖已取得了諸多成果,但仍有很多疾病不能預(yù)防��,新興技術(shù)加快了疫苗的研發(fā)速度�����,有望成為開發(fā)針對這些疾病疫苗的有效手段���。隨著全基因組測序的迭代更新和生物信息學(xué)的興起�����,反向疫苗學(xué)技術(shù)應(yīng)運而生。該技術(shù)以基因組序列為目標,預(yù)測疫苗的所有候選抗原��。本文主要對反向疫苗學(xué)技術(shù)的背景以及反向疫苗學(xué)技術(shù)“1.0時代”和“2.0 時代”技術(shù)路線進行概述�。
The rapid development of modern biotechnology has revolutionized the biomedical industry. Although many achievements have been made in the development of vaccines, there are still many diseases that cannot be prevented.Emerging technologies have accelerated the development of vaccines, thus promising to be an effective means of developing vaccines against these diseases. With the iterative update of whole genome sequencing and the rise of bioinformatics, reverse vaccinology technologies have emerged. This technique targets genomic sequences to predict all candidate antigens for vaccines. This article mainly summarizes the background of reverse vaccinology technology and the technical route of “1.0 era” and “2.0 era” of reverse vaccinology technology.
1、 前言
反向疫苗學(xué)(Reverse Vaccinology)是從病原體基因組序列出發(fā)����,應(yīng)用生物信息學(xué)技術(shù)、蛋白質(zhì)組學(xué)技術(shù)����、生物芯片技術(shù)等工具,預(yù)測病原體的毒力因子��、外膜抗原�、侵襲及毒力相關(guān)抗原;應(yīng)用抗原表位預(yù)測工具篩選出能夠引起免疫應(yīng)答的抗原表位分子����,對上述抗原基因進行高通量克隆、表達�、純化出重組蛋白���,然后再對純化后的抗原進行體內(nèi)��、體外評價����,篩選出保護性抗原進行疫苗研究,這種以基因組為基礎(chǔ)�,篩選蛋白質(zhì)抗原的疫苗研發(fā)策略稱為反向疫苗學(xué)技術(shù)[1-3]。
1.1 背景
疫苗是控制及消滅病原體的一種有效手段����。傳統(tǒng)疫苗包括滅活疫苗、減毒活疫苗�、類毒素疫苗和亞單位疫苗。20 世紀應(yīng)用傳統(tǒng)技術(shù)研制的疫苗相繼問世����,對許多重要疾病的有效防治起到了關(guān)鍵性作用,如脊髓灰質(zhì)炎�����、傷寒���、麻疹���、腮腺炎���、乙型腦炎等疾病。但是對于研究難度較高的復(fù)雜病原體���,很難通過傳統(tǒng)的方法制備高效安全的疫苗�����,如某些病原體無法在體外培養(yǎng)且易變異��、抗原體外表達量小不足以分離純化或免疫原性微弱等���,即便利用傳統(tǒng)方法可以制備,仍面臨提純工藝復(fù)雜���、成本高等困境��,以致目前仍有不少嚴重的感染性疾病尚無疫苗可用[4]��。
基因組攜帶著生物的遺傳信息�,通過測序技術(shù)可以確定基因組內(nèi)的堿基排列順序�, 而測序技術(shù)的迅猛發(fā)展也使得通過病原體全基因組信息來找尋新的抗原變?yōu)楝F(xiàn)實。1953 年����, 沃森(Watson)和克里克(Crick)提出DNA 雙螺旋結(jié)構(gòu),為測序技術(shù)的出現(xiàn)奠定了基礎(chǔ)�。1977 年,桑格(Sanger)發(fā)明雙脫氧測序法����,這是第一代測序技術(shù)。1995年���, 溫特(Venter) 等人完成了流感嗜血桿菌(haemophilus influenzae)的全基因組測序[5]����,2000 年他們對B 群腦膜炎奈瑟菌(Neisseria meningitidis group B)MC58 株的全部基因組進行了注釋���,從中發(fā)現(xiàn)了大量新的表面抗原[6-7]��。這種從病原體全基因組信息出發(fā)進行疫苗研究的新策略被稱之為“反向疫苗學(xué)”���,如圖1 所示。它能幫助研究人員克服常規(guī)疫苗方法的限制�,這在多種病原體疫苗研發(fā)中得以體現(xiàn),其中B 群腦膜炎奈瑟菌疫苗即為首個利用反向疫苗學(xué)技術(shù)研究的成功案例[8]。
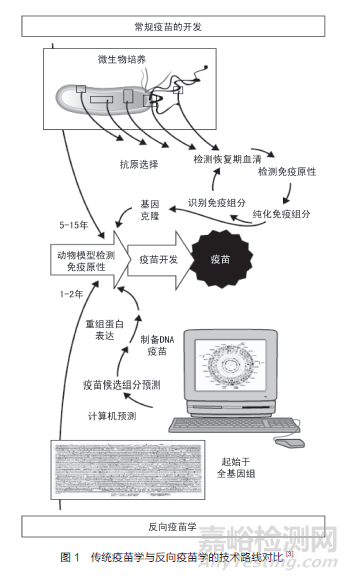
在復(fù)雜病原體的疫苗研發(fā)過程中����,仍有一些技術(shù)難點無法攻克。2002 年�����,伯頓(Burton)等人提出了一種通過抗體信息設(shè)計新抗原的方法���,即分離患者體內(nèi)的特異性B 細胞��,體外建立抗體組庫��,篩選有效的中和抗體���,通過抗原抗體復(fù)合物的結(jié)構(gòu)解析,找到關(guān)鍵性抗原表位���,最終設(shè)計出具有高保護效果的疫苗[9]�。2008年���,拉波利(Rappuoli)等人提出了一種基于結(jié)構(gòu)信息優(yōu)化抗原設(shè)計的新思路����,通過對抗原結(jié)構(gòu)進行分析�����,設(shè)計出穩(wěn)定性好�、產(chǎn)量高及免疫原性優(yōu)的抗原[10]。呼吸道合胞體病毒(respiratorysyncytial virus����,RSV) 的F 蛋白抗原設(shè)計就是比較經(jīng)典的例子。F 蛋白有兩種構(gòu)象——融合前構(gòu)象(Pre-F)和融合后構(gòu)象(Post-F)��。雖然Pre-F 的穩(wěn)定性不如Post-F,但是其能夠誘導(dǎo)更高水平的中和抗體���。麥克萊倫(McLellan)等人通過改造F 蛋白跨膜區(qū)獲得一個穩(wěn)定的三聚體Pre-F 蛋白���,該蛋白能夠誘導(dǎo)更高水平的中和抗體[11],為宿主提供更全面的保護�����。得益于蛋白質(zhì)組學(xué)和結(jié)構(gòu)生物學(xué)的發(fā)展����,反向疫苗學(xué)技術(shù)從“1.0 時代”跨入“2.0時代”[12-13]。
1.2 優(yōu)勢與局限性
傳統(tǒng)疫苗學(xué)是建立在充分認識病原體生物學(xué)性狀��、致病性以及免疫原性等特性的基礎(chǔ)上�����,并且需要在體外進行大規(guī)模培養(yǎng)��。對于一些具有嚴重傳染性和致病性的病原體來說�����,體外培養(yǎng)具有極大的安全隱患,這些因素使得傳統(tǒng)疫苗學(xué)方法存在較大的局限性���。而反向疫苗學(xué)技術(shù)從病原體的基因組序列入手���,與傳統(tǒng)的疫苗研制思路截然不同,具有以下優(yōu)勢:①反向疫苗學(xué)技術(shù)從分析基因組序列開始�����,就不需要在體外進行病原體的培養(yǎng)����,避免了病原體的擴散��;②反向疫苗學(xué)技術(shù)對病原體的所有蛋白質(zhì)都進行了分析預(yù)測��,增加了篩選范圍����,能篩選到部分被忽略的候選抗原;③反向疫苗學(xué)技術(shù)可直接對病原體的疫苗靶點進行預(yù)測�,極大地縮減了早期研發(fā)的時間和成本。
當然,目前反向疫苗學(xué)技術(shù)還存在一定的局限性�����。例如���,抗原預(yù)測種類比較單一��,大多數(shù)是蛋白質(zhì)分子���。而在傳統(tǒng)疫苗學(xué)的研究中發(fā)現(xiàn),有許多非蛋白質(zhì)分子��,如多糖���、脂類等也具有良好的免疫原性�,同時還能起到類似佐劑的效果�����。而這部分分子尚無法通過反向疫苗學(xué)技術(shù)進行篩選����。其次,基因組學(xué)和生物信息學(xué)中所使用的算法準確度仍存在一定的局限性,需要進一步優(yōu)化���,以提高有效抗原預(yù)測的準確性�����。另外����,反向疫苗學(xué)技術(shù)應(yīng)用通用表達系統(tǒng)表達的候選疫苗分子與病原體體內(nèi)天然蛋白分子的構(gòu)象和修飾存在一定差別�,因此,它們的免疫原性和保護力存在差異��,可能會影響研究人員的判斷和抗原篩選的準確度��。
2��、 候選抗原的篩選與預(yù)測
在傳統(tǒng)疫苗學(xué)的研究和開發(fā)過程中發(fā)現(xiàn)��,病原體表面的分子和病原體分泌的蛋白質(zhì)能夠直接與宿主免疫細胞表面的受體和抗體結(jié)合�����,引起機體強烈�����、持久的免疫反應(yīng)�,提供全面的保護作用,是理想的疫苗靶標�。此外,病原體中存在許多幫助病原體逃逸宿主免疫系統(tǒng)識別和清除的分子�����,它們也能成為潛在的疫苗候選者�。對病原體全基因組信息的解析是反向疫苗學(xué)技術(shù)“1.0 時代”的關(guān)鍵技術(shù)。隨著蛋白質(zhì)組學(xué)�����、結(jié)構(gòu)生物學(xué)和免疫組學(xué)的快速發(fā)展�,根據(jù)目標抗體的信息設(shè)計特異性較高的抗原成為可能���,大大提高了疫苗研發(fā)效率[14]���,開啟了反向疫苗學(xué)技術(shù)“2.0 時代”。
2.1 利用基因組進行抗原篩選
微生物基因組序列的全面解析,為反向疫苗學(xué)技術(shù)的發(fā)展奠定了基礎(chǔ)�����。從基因組信息入手,先通過生物信息學(xué)分析算法找到病原體中能夠編碼成為潛在抗原的基因���;再利用原核表達系統(tǒng)表達基因組分析找到的所有開放閱讀框(Open Reading Frames,ORFs)����,最終純化得到病原體實際表達的功能性蛋白��;將純化蛋白免疫動物后�,應(yīng)用多種免疫學(xué)檢測技術(shù)評價其免疫原性和抗原性來進一步篩選。一般通過感染模型的攻毒實驗評價候選抗原的保護能力��,最終確定有效的保護性抗原�;在完成臨床前研究后,進一步將候選保護性抗原推進到臨床試驗研究。以上即反向疫苗學(xué)技術(shù)“1.0 時代”常用的技術(shù)路線����,該方法已成功應(yīng)用于B 群腦膜炎奈瑟菌疫苗研發(fā)中,已在多個國家和地區(qū)獲得使用許可�。
在反向疫苗學(xué)技術(shù)“1.0 時代”的研究中��,最關(guān)鍵的環(huán)節(jié)是利用基因組學(xué)數(shù)據(jù)篩選和評估潛在抗原分子���。隨著新技術(shù)的不斷涌現(xiàn),生物信息學(xué)算法的迭代更新����,研究人員可以從基因組數(shù)據(jù)中發(fā)掘更多的信息�����,包括抗原的表達和修飾信息��、抗原的保守性分析以及病原體在流行病發(fā)展過程中的變異等。同時����,隨著蛋白質(zhì)組學(xué)、免疫組學(xué)和結(jié)構(gòu)生物學(xué)的發(fā)展����,使得研究人員可以利用人源單克隆抗體信息鑒定保護性抗原和表位,并將抗原- 細胞表面受體���、抗原- 中和抗體復(fù)合物的結(jié)構(gòu)學(xué)表征用于指導(dǎo)抗原設(shè)計[13]。這樣能夠最大化利用基因組學(xué)數(shù)據(jù)���,從多個維度篩選�、評價和優(yōu)化潛在抗原分子���。至此,反向疫苗學(xué)技術(shù)進入“2.0 時代”,即進入多組學(xué)技術(shù)聯(lián)用篩選抗原的時代����。
2.2 基于生物信息學(xué)的基因組分析及抗原篩選
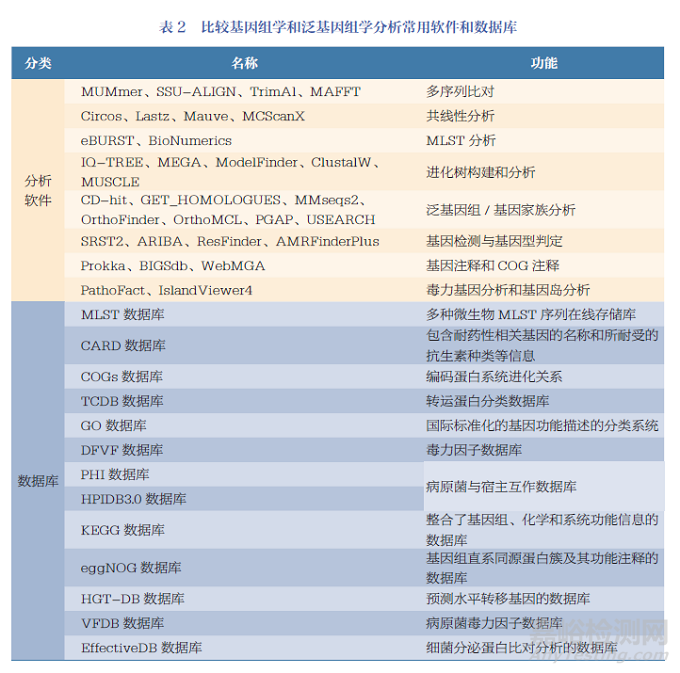
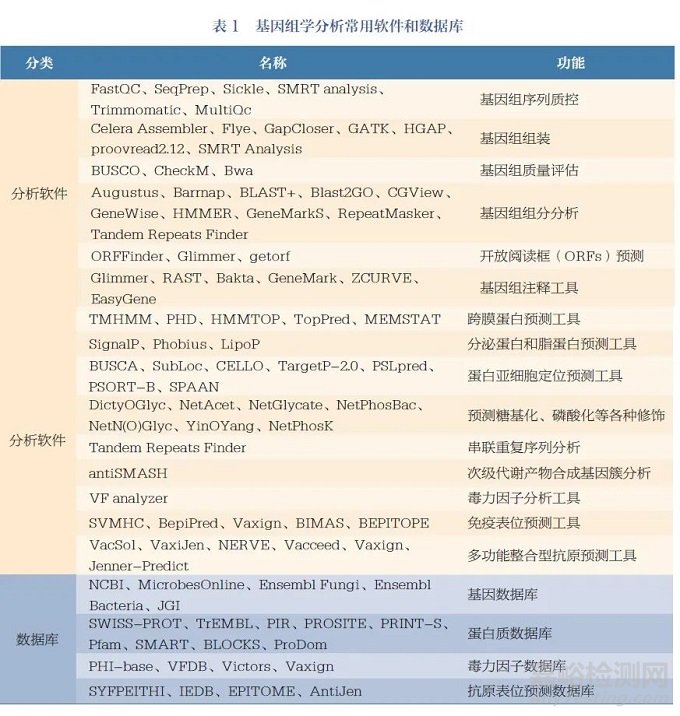
基因組分析的第一步是對目標病原體的基因組編碼信息進行篩選和分析[1]。利用數(shù)據(jù)庫和多種計算機程序篩選基因組序列,對DNA 片段和重疊信息進行整合����, 進行基因組組分分析, 包括計算病原體基因組的編碼容量�����、預(yù)測基因島和非編碼RNA等����。第二步,預(yù)測所有的ORFs����。通過BLASTX、BLASTN 和TBLASTX 等同源對比算法搜索數(shù)據(jù)庫,鑒定出可以編碼蛋白的DNA 片段[15-16]。將編碼胞質(zhì)功能或已知抗原的序列提出�����,對剩余編碼區(qū)域進行下一步分析。第三步是通過同源性搜索和比對算法對編碼蛋白進行亞細胞定位和功能注釋�����。利用蛋白質(zhì)數(shù)據(jù)庫進行同源性檢索——通過篩選目標蛋白所特有的典型特征元件��、基序和指紋��,如跨膜區(qū)結(jié)構(gòu)域���、信號肽�、脂蛋白特征����、外膜錨定元件和宿主細胞結(jié)合結(jié)構(gòu)域�,以及是否與已知的表面相關(guān)蛋白高度同源����,篩選出病原體表面蛋白和毒素蛋白等[1]。常用的同源性搜索數(shù)據(jù)庫包括BLAST、FASTA�、MOTIFS 等[17]�����,其他基因組學(xué)分析常用軟件和數(shù)據(jù)庫見表1。
病原體為適應(yīng)不同環(huán)境常會發(fā)生水平基因轉(zhuǎn)移�����、相位變異和基因變異來逃逸宿主免疫系統(tǒng)的防御[18]�����。例如,在對同一病毒不同毒株的測序結(jié)果進行比對后���,發(fā)現(xiàn)不同毒株的全基因組存在不同程度的差異[19]��。因此�����,對于單一病原體的分析和篩選并不能很好地滿足流行病學(xué)的發(fā)展需要���。2005 年,泰特林(Tettelin)等人提出了微生物泛基因組(Pangenome)概念——泛基因組即某一物種全部基因的總稱�,而核心基因組(core genome)則是指在所有菌株中都存在的基因[20]�����。通過比較基因組學(xué)和泛基因組學(xué),能夠更加深入全面地認識種屬間和種屬內(nèi)的抗原變化和分布情況[21],迅速鑒定出不同血清型和基因型中潛在的抗原分子[22]���,從而確定種屬內(nèi)保守性高的肽段和蛋白作為通用疫苗的候選分子[23]����。此外,種間基因組學(xué)分析還能夠指導(dǎo)研究人員篩選出與其他物種高度同源的基因,以避免不良的交叉反應(yīng)��,并剔除可能會引起宿主自身免疫病的候選分子[21]���。
比較基因組學(xué)和泛基因組學(xué)分析的基本流程:高通量測序獲得不同分離株的全基因組測序結(jié)果后,計算GC 含量�����,通過算法軟件和數(shù)據(jù)庫進行多角度分析[19, 24-33],其中包括MLST 分析、共線性分析�����、進化樹構(gòu)建和分析、毒力基因分析等,見表2���。最終篩選出安全性高、高度保守且具有交叉保護能力的疫苗候選分子��。
2.3 基于蛋白質(zhì)組學(xué)和結(jié)構(gòu)生物學(xué)的疫苗抗原預(yù)測和篩選
為適應(yīng)動態(tài)多變的外界環(huán)境���、逃逸宿主免疫系統(tǒng)的攻擊�����,病原體的蛋白質(zhì)表達譜在時空上會出現(xiàn)差異��,也會發(fā)生多種翻譯后修飾。這些復(fù)雜過程通常難以通過基因組數(shù)據(jù)分析進行準確地預(yù)測�����。而蛋白質(zhì)組學(xué)分析能夠彌補單一基因組學(xué)分析的誤差��,準確地研究病原體基因表達產(chǎn)物的組分和定位[34]。蛋白質(zhì)組學(xué)在反向疫苗學(xué)技術(shù)中的應(yīng)用主要包括病原體蛋白質(zhì)組分分析��、蛋白質(zhì)定量分析�����、蛋白質(zhì)修飾分析���、抗原抗體相互作用和結(jié)構(gòu)分析等方面。
在進行病原體蛋白質(zhì)組分分析時����,常通過雙向凝膠電泳技術(shù)和質(zhì)譜技術(shù)分離鑒定蛋白質(zhì)組分。再配合蛋白質(zhì)免疫印跡�����、酶解、多維色譜分離�、蛋白質(zhì)芯片等技術(shù),可以從多維度分離和鑒定目標蛋白質(zhì)群��。而質(zhì)譜技術(shù)的飛躍發(fā)展開啟了大規(guī)模自動化的蛋白質(zhì)鑒定時代����, 先通過基質(zhì)輔助激光解吸電離飛行時間質(zhì)譜(MALDI-TOF-MS)、電噴霧電離質(zhì)譜(ESI-MS)�、表面增強激光解吸電離飛行時間質(zhì)譜(SELDI-TOF-MS) 和傅里葉變換質(zhì)譜法(FTMS)等技術(shù)鑒定多肽序列�����,再利用計算機算法在數(shù)據(jù)庫中搜索相對應(yīng)的氨基酸序列�����,最終鑒定目標蛋白[35]。以上方法已成熟運用于多種病原體疫苗的研發(fā)過程中�����,如用蛋白酶消化“刮掉”病原體表面的蛋白,再通過質(zhì)譜方法鑒定這些蛋白組分��,以篩選潛在的靶標蛋白[36]。
除了鑒定病原體的蛋白質(zhì)組分,研究人員還開發(fā)出多種高通量測定蛋白質(zhì)含量的方法�,用以更準確地確定在致病等關(guān)鍵過程中起到重要作用的蛋白質(zhì)。常用的蛋白質(zhì)定量方法包括基于熒光染色技術(shù)的電泳定量法(F-2DDIGE)和質(zhì)譜定量法�。質(zhì)譜定量法可以通過化學(xué)或代謝標簽的標記[ 如同重元素標記的相對與絕對定量技術(shù)(iTRAQ)、多肽體外等重同位素標記的相對與絕對定量技術(shù)(TMT)�����、同位素代碼標記技術(shù)(ICAT)和細胞培養(yǎng)條件下穩(wěn)定同位素標記技術(shù)(SILAC)等方法] 定量比較不同樣品中的蛋白質(zhì)含量[37]�,也可以不進行標記,直接比較樣品間的肽光譜計數(shù)或強度。定量蛋白組學(xué)可以通過SWATH 和msxDIA 快速定量分析數(shù)千種蛋白質(zhì)�����,也可以通過選擇性/ 多重反應(yīng)監(jiān)測(SRM/MRM)和平行反應(yīng)監(jiān)測(PRM)對復(fù)雜生物樣品中的蛋白進行高度特異和靈敏的靶向定量分析[38]����。
病原體蛋白質(zhì)一般會發(fā)生多種修飾��,包括磷酸化、糖基化和硫化等����,這些修飾對于抗原抗體識別和免疫反應(yīng)激活等過程是至關(guān)重要的。通過蛋白質(zhì)組學(xué)對病原體蛋白的修飾情況進行研究�����,能為注釋和研究蛋白質(zhì)活性、定位和穩(wěn)定性提供必要信息�,而這些修飾信息無法通過基因組序列或mRNA 表達數(shù)據(jù)獲得和預(yù)測���。具體操作:酶解處理后的樣品可以通過不同的吸附凝集柱(如金屬螯合色譜柱)或特異性抗體進行富集��,然后通過基質(zhì)輔助激光解吸電離質(zhì)譜(MALDI-MS)分析,計算譜峰偏移的距離�,最終確定修飾的種類和數(shù)量[34]����。
病原體的蛋白質(zhì)組學(xué)分析還包括分析病原體蛋白和宿主受體之間的相互作用��,通過熒光等特異性標記技術(shù)和蛋白質(zhì)芯片技術(shù),高通量捕獲與宿主受體相互作用的病原體蛋白質(zhì)和肽段����,再聯(lián)用基質(zhì)輔助激光解吸(MALDI)技術(shù)讀取和分析捕獲的蛋白質(zhì)數(shù)據(jù)。此外���,還可以通過酵母雙雜交技術(shù)[39] 和噬菌體展示技術(shù)[40] 等分析候選蛋白和靶標受體蛋白的結(jié)合力大小���,優(yōu)化疫苗候選蛋白的設(shè)計�����。
蛋白結(jié)構(gòu)組學(xué)和計算生物學(xué)的發(fā)展�,輔助免疫組學(xué)建立豐富的抗原表位肽庫,成為反向疫苗學(xué)技術(shù)“2.0 時代”中最為突出的技術(shù)革新��。通過蛋白質(zhì)交聯(lián)���、小角散射和氫- 氘交換等技術(shù)輔助蛋白結(jié)構(gòu)解析���,利用X 射線、冷凍電鏡和核磁共振等技術(shù)解析病原體蛋白結(jié)構(gòu)和其與宿主受體相結(jié)合的復(fù)合物結(jié)構(gòu)�,幫助研究人員全面深入地了解免疫靶點[41]����。通過構(gòu)象變化和蛋白質(zhì)結(jié)構(gòu)數(shù)據(jù)庫分析疫苗的候選蛋白�����,結(jié)合蛋白質(zhì)化學(xué)��、分子模型����、人工智能和計算生物學(xué)���,設(shè)計和優(yōu)化疫苗候選蛋白, 最終得到免疫原性高��、安全性高且保護效果好的蛋白分子����。
2.4 基于免疫組學(xué)的抗原表位預(yù)測
分子免疫學(xué)和免疫信息學(xué)的快速發(fā)展,為研究人員提供了大量的病原體免疫表位方面的信息��,推進反向疫苗學(xué)技術(shù)進入“2.0 時代”��??乖砦坏念A(yù)測在反向疫苗學(xué)技術(shù)“2.0 時代”是至關(guān)重要的,通過對病原體可能的免疫表位進行理論上的預(yù)測篩查��,有助于縮小疫苗候選分子的范圍��,減少后續(xù)體內(nèi)外試驗所消耗的時間�����、人力以及物力��。
抗原表位又稱為抗原決定簇,是抗原物質(zhì)分子表面或其他部位�,具有一定組成和結(jié)構(gòu)的特殊化學(xué)基團,能夠與相應(yīng)抗體或致敏淋巴細胞發(fā)生特異性結(jié)合��。通過抗原表位預(yù)測工具設(shè)計出的理想疫苗應(yīng)該能夠刺激宿主產(chǎn)生B 細胞和T 細胞介導(dǎo)的免疫應(yīng)答反應(yīng)[42]�����?����?乖砦活A(yù)測方法主要包括兩種:一種是基于蛋白質(zhì)序列中氨基酸的理化特性(如親/ 疏水性�����、柔性��、表面可及性)�����,另一種是基于人工智能算法進行預(yù)測���。目前,研究人員一般會結(jié)合這兩種預(yù)測方法進行抗原表位的預(yù)測、評估和篩選����,最終找到具有高抗原特性和最佳理化特性的抗原表位, 再進入高通量蛋白表達和免疫檢測環(huán)節(jié)���。
2.4.1 B 細胞表位預(yù)測
雖然抗原- 抗體相互作用的研究有一百多年發(fā)展史����,且早在20 世紀80 年代����,B 細胞表位預(yù)測就受到了研究人員的重視�,但基于生物信息學(xué)進行B 細胞表位預(yù)測的發(fā)展并不是很順利。隨著許多抗原- 抗體復(fù)合物和MHC-抗原肽-TCR 等復(fù)合物結(jié)構(gòu)的解析�,以及大量抗原肽表位資料的積累和計算機輔助設(shè)計的發(fā)展,基于人工智能算法的B 細胞表位預(yù)測得到了快速發(fā)展[43]����。
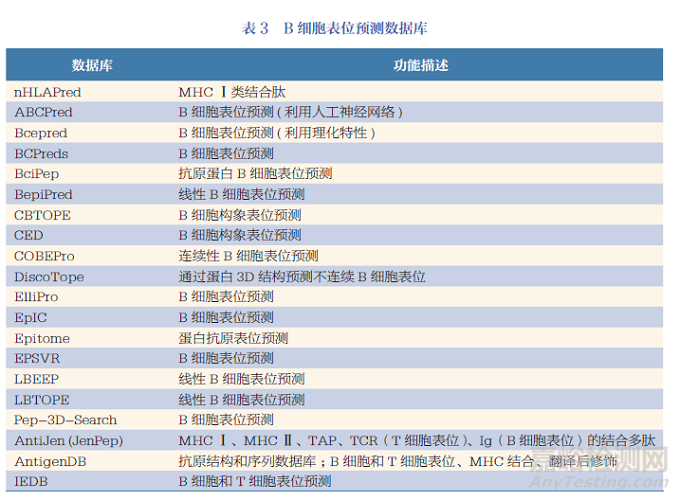
目前, 預(yù)測B 細胞表位的數(shù)據(jù)庫較多��,見表3����。這些數(shù)據(jù)庫中所包含的B 細胞表位序列各不相同��,各自的功能也具有一定的差異�。例如���,2017 年的一篇文獻中指出BciPep 數(shù)據(jù)庫包含555 個線性B 細胞表位序列,CED 數(shù)據(jù)庫包含293 個不連續(xù)表位( 構(gòu)象表位)����,Epitome 數(shù)據(jù)庫是包含了所有已知抗原- 抗體復(fù)合物結(jié)構(gòu)的數(shù)據(jù)[44]�����。因此,在進行B 細胞表位預(yù)測時�, 僅依靠某一數(shù)據(jù)庫進行預(yù)測可能是不充分的�,需要結(jié)合不同的數(shù)據(jù)庫��,根據(jù)各個數(shù)據(jù)庫得到的預(yù)測結(jié)果的分值����,以確定最佳B 細胞表位候選分子��。例如��,阿米爾雷扎(Amirreza) 等利用IEDB��、LBTOPE��、ElliPro 和CBTOPE四種表位預(yù)測工具尋找新型冠狀病毒候選抗原B 細胞表位,根據(jù)預(yù)測結(jié)果構(gòu)建出了包含8 個表位的多表位抗原肽�����,并預(yù)測了其在用于血清學(xué)診斷產(chǎn)品開發(fā)等方面的巨大潛能[45]��。
2.4.2 T 細胞表位預(yù)測
隨著對細胞免疫應(yīng)答機制的深入研究�,許多研究人員將注意力集中于T 細胞表位預(yù)測上,希望能夠開發(fā)出誘導(dǎo)產(chǎn)生細胞免疫應(yīng)答的疫苗候選分子���。分子免疫學(xué)和計算生物學(xué)的發(fā)展也提升了T 細胞表位預(yù)測的準確度���。T 細胞免疫應(yīng)答反應(yīng)是由抗原呈遞細胞表面的短肽(即抗原表位)刺激產(chǎn)生。這些表位的產(chǎn)生是通過抗原呈遞細胞對抗原蛋白進行酶解加工產(chǎn)生抗原多肽�,然后多肽結(jié)合到組織相容性復(fù)合體(major histocompatibility complex��,MHC)分子的肽結(jié)合槽上�,被轉(zhuǎn)運到細胞表面進行展示��,這些多肽與T 細胞受體結(jié)合���,從而刺激T 細胞免疫應(yīng)答反應(yīng)[46]��。
MHC 分子最主要的功能是參與抗原呈遞���,即通過其肽結(jié)合槽與抗原肽結(jié)合,將其呈現(xiàn)于細胞表面供T 細胞識別�。MHC Ⅰ類分子介導(dǎo)的是內(nèi)源性抗原的呈遞過程, 其將內(nèi)源性抗原片段呈遞給細胞毒性T 淋巴細胞(cytotoxic T lymphocyte�����,CTL)����。而MHC Ⅱ 類分子則呈遞外源性抗原��,其呈遞外源性抗原多肽分子至Th 細胞(helper T cells)�。此外��,MHC Ⅰ 類分子幾乎在所有細胞上都表達��,這使得CTL 有機會檢查機體內(nèi)絕大多數(shù)細胞����,以監(jiān)視病原體��。而MHC Ⅱ類分子則主要表達在B細胞�����、單核巨噬細胞���、樹突狀細胞等抗原呈遞細胞上����,主要負責將危險警示于Th 細胞�,協(xié)調(diào)免疫細胞間的相互作用,調(diào)控體液免疫和細胞免疫應(yīng)答�����。
MHC Ⅰ類分子肽結(jié)合槽的兩端呈閉合狀態(tài)�����, 一般能夠容納8~10 個氨基酸殘基組成的肽段。而MHC Ⅱ類分子肽結(jié)合槽的兩端開放���,多肽分子可以伸出溝外����,這使其可容納更長的肽配體分子��, 一般可容納13~18 個氨基酸組成的肽段�。目前的預(yù)測工具對于MHC Ⅰ類分子結(jié)合肽的預(yù)測精確度接近95%,但是對于MHC Ⅱ類分子結(jié)合肽的預(yù)測精確度卻相對較低�。這是因為MHC Ⅱ類分子結(jié)合肽不像MHC Ⅰ類分子結(jié)合肽一樣存在明確的基序,其錨點氨基酸的限制性也不如MHC Ⅰ類分子強�,且由于MHC Ⅱ類分子可以利用的肽配體數(shù)據(jù)相對較少,使得對Th 細胞表位預(yù)測較之CTL 表位預(yù)測相對困難[47]��。
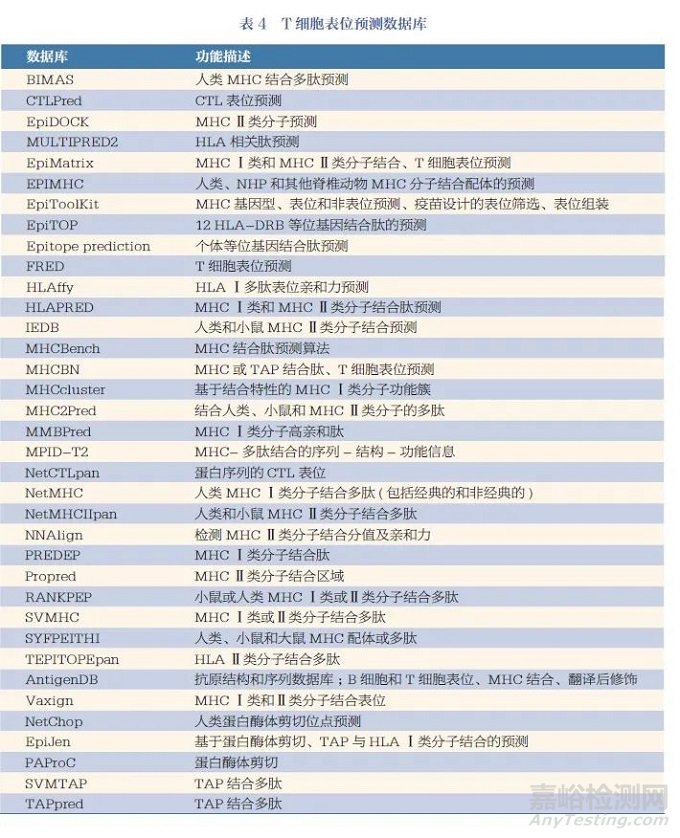
MHC Ⅰ類分子結(jié)合肽的預(yù)測方法包括兩種:一種是基于抗原肽與MHC Ⅰ類分子結(jié)合特性的預(yù)測方法�����,另一種是針對抗原加工處理過程的預(yù)測方法�。前者以MHC Ⅰ類分子晶體結(jié)構(gòu)的解析為基礎(chǔ)����,后者以針對蛋白酶體裂解基序和抗原加工相關(guān)轉(zhuǎn)運蛋白(transporter associated withantigen processing�����,TAP) 結(jié)合肽為基礎(chǔ)�����。而MHC Ⅱ類分子的預(yù)測方法主要基于理化特性�����、抗原肽與MHC Ⅱ類分子結(jié)合特性�����。目前�����, 常用的T 細胞抗原表位預(yù)測數(shù)據(jù)庫見表4��。其中��,NetChop�����、EpiJen 和PAProC常用于蛋白酶體裂解基序的預(yù)測����,SVMTAP 和TAPpred 常用于TAP 結(jié)合多肽的預(yù)測。
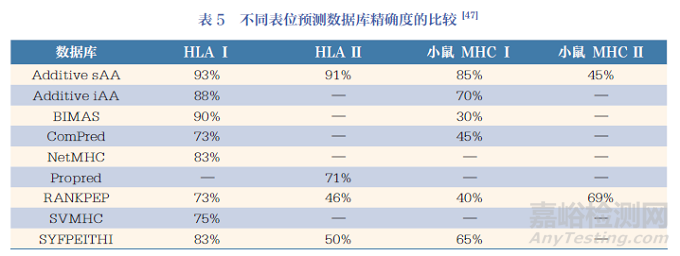
T 細胞表位預(yù)測時通常會選擇多種數(shù)據(jù)庫聯(lián)合使用�����,以便更精準有效地預(yù)測出合適的T 細胞表位候選分子�。馬修(Matthew)等人對幾個表位預(yù)測數(shù)據(jù)庫進行比較, 結(jié)果顯示這些數(shù)據(jù)庫對Class Ⅰ HLA 的預(yù)測精確度高于Class Ⅱ HLA���,對人的HLA 預(yù)測精確度高于小鼠的MHC�����,見表5�。
另一項研究結(jié)果也發(fā)現(xiàn)�,在對99 個已知表位用不同預(yù)測數(shù)據(jù)庫進行檢測時,EpiJen 能夠鑒定出其中的61 個表位��、SMM 鑒定出57 個、NetCTL 鑒定出49 個�、WAPP 鑒定出33 個��,且這幾種預(yù)測方法得到的陽性預(yù)測值[ 陽性/(陽性+ 假陽性)] 都比較低���,均低于25%[47]�。
綜上所述�,在進行抗原表位預(yù)測時,無論是B 細胞表位還是T 細胞表位�,均需要多種預(yù)測工具相結(jié)合,從理論上預(yù)測出可能包含B 細胞或T 細胞表位的候選分子�。雖然任何預(yù)測軟件均不能達到100% 準確性,或許存在預(yù)測分值較高但并不能真正刺激免疫應(yīng)答反應(yīng)的候選分子��,但這些預(yù)測方法能大大降低尋找抗原表位的盲目性�����,降低試驗成本[48]����。
2.5 高通量篩選關(guān)鍵毒力因子
毒力因子是病原體產(chǎn)生的、導(dǎo)致宿主發(fā)病的一類分子�,也是現(xiàn)用疫苗的主要成分之一�。表面定位的毒力因子(如黏附蛋白)通過介導(dǎo)病原體的吸附�,是開始感染宿主的過程。病原體產(chǎn)生的毒力因子一般具有很強的免疫原性��,可能成為出色的靶點�。通過多組學(xué)數(shù)據(jù)篩選和生物信息學(xué)計算預(yù)測得到的毒力蛋白,通常需要借助合適的動物和細胞模型進行驗證����。近年來,隨著反向疫苗學(xué)技術(shù)的發(fā)展和成熟�,研究人員主要通過兩種思路來高通量篩選病原體的毒力基因:一種是構(gòu)建基因突變株庫篩選毒力基因,其中代表性方法為轉(zhuǎn)座子隨機突變技術(shù)和特征標簽突變(STM)技術(shù)��;另一種是通過毒力基因表達調(diào)控特點來進行體內(nèi)誘導(dǎo)性篩選��,代表性方法是差異熒光誘導(dǎo)技術(shù)(DFI)和體內(nèi)誘導(dǎo)抗原技術(shù)(IVIAT)等���。
通過轉(zhuǎn)座子隨機突變技術(shù)和STM 技術(shù)[49] 構(gòu)建基因突變株庫�����,根據(jù)突變株的毒力變化���,高通量篩選與生物膜形成���、黏附和致病相關(guān)的基因[50]。其中��,STM 技術(shù)是一種更為常用的毒力基因篩選方法�。該技術(shù)通過構(gòu)建的突變株帶有獨特DNA 標簽��,感染動物模型后�,相應(yīng)感染位點或動物組織中分離不出的某個突變株就是減毒突變株。通過STM 技術(shù)反向篩選到的毒力基因可以研發(fā)成為減毒活疫苗和亞單位疫苗等���。目前�����,已通過該方法找到多種病原細菌的毒力基因�,如鼠傷寒沙門菌��、B 群腦膜炎奈瑟菌和豬布魯氏桿菌等[51]�。
DFI 和IVIAT 等體內(nèi)誘導(dǎo)性篩選方法是根據(jù)毒力基因特有的表達調(diào)控模式進行篩選,找到病原體在宿主體內(nèi)表達而在體外不表達的功能基因����,以此確定與病原體生存和致病關(guān)系密切的毒力因子��。體內(nèi)誘導(dǎo)性篩選思路主要包括三種:①通過體內(nèi)表達技術(shù)(IVET)和DFI 等方法篩選具有體內(nèi)誘導(dǎo)活性的啟動子��;②利用基因芯片比較體內(nèi)外環(huán)境中基因轉(zhuǎn)錄水平的差異���;③利用IVIAT等比較體內(nèi)外環(huán)境中基因表達水平的差異。其中�, IVET 的基本技術(shù)路線是將致病菌隨機的DNA片段與無啟動子的報告基因融合,構(gòu)建融合基因文庫��,由質(zhì)粒轉(zhuǎn)入致病菌中進行整合����,然后感染細胞或動物模型,激活體內(nèi)誘導(dǎo)基因的表達��。從感染細胞或動物體內(nèi)分離致病菌���,在平板上進行藍白斑篩選找到在體外不表達的片段����,最后進行測序和檢索����,確定體內(nèi)誘導(dǎo)表達的啟動子[52]���。DFI是一種簡化的體內(nèi)表達技術(shù)[53-54],通過熒光標記和流式細胞儀篩選代替營養(yǎng)缺陷�����、抗生素或重組酶等篩選策略�����,通過改變熒光閾值調(diào)節(jié)篩選敏感度����,以實現(xiàn)大規(guī)模半自動的高效篩選�。IVET 和DFI方法曾被成功地用于福氏志賀菌、肺炎克雷伯菌和金黃色葡萄球菌等病原菌毒力因子的篩選����。由于上述方法不適用于只對人致病且缺乏動物模型的病原菌,只能通過基因芯片技術(shù)和IVIAT 來進行研究�,基因芯片技術(shù)通過比較病原體在宿主體內(nèi)外的轉(zhuǎn)錄水平差異,以確定關(guān)鍵致病基因�����;IVIAT方法則通過體外培養(yǎng)的病原體吸附免疫血清,剔除患者血清中針對病原菌體外表達抗原的抗體��,然后再用處理后的血清作為探針篩選病原體的基因組表達文庫��,獲得體內(nèi)誘導(dǎo)性表達基因[55]����。這個方法在結(jié)核分枝桿菌和霍亂弧菌等的毒力因子篩選研究中取得了較大的進展。
2.6 其他多種新技術(shù)輔助篩選抗原
近年來��,生物芯片技術(shù)得到迅猛發(fā)展��,并應(yīng)用到疫苗研制和藥物開發(fā)過程中����。生物芯片包括基因芯片和蛋白質(zhì)芯片,將寡核苷酸��、肽和抗體等生物高分子固定在凝膠和硅等固相介質(zhì)上形成分子點陣�����,當待測樣本中的生物分子與探針分子雜交或發(fā)生相互作用后�����,利用激光掃描共聚焦熒光顯微鏡或其他儀器檢測和分析雜交信號[56]?;蛐酒脚_具有高通量、高靈敏度和全自動化等優(yōu)勢��,可應(yīng)用于病毒基因分型檢測���、點突變檢測和核苷酸多態(tài)性研究中�,助力多種病原菌的基因調(diào)控和毒力因子檢測研究[57]�����。蛋白質(zhì)芯片可以快速鑒定病原體在感染宿主過程中表達的蛋白[58]�。生物芯片能夠解決多種組學(xué)技術(shù)產(chǎn)生的繁冗數(shù)據(jù)�����,快速檢測候選分子介導(dǎo)的宿主內(nèi)細胞學(xué)事件和微生物致病進程��,鑒定出效果優(yōu)異的疫苗候選者[21]����。在應(yīng)對具有高度變異能力的病原體流行病學(xué)挑戰(zhàn)中,生物芯片技術(shù)也凸顯出了獨特而重要的優(yōu)勢����。
得益于芯片技術(shù)和測序技術(shù)的發(fā)展�,轉(zhuǎn)錄組學(xué)能夠通過RNA水平研究病原體和免疫細胞的基因表達情況�。轉(zhuǎn)錄組測序技術(shù)(RNA-Seq)通量高、靈敏度高��、分辨率高�,且無需設(shè)計特異性探針,直接對任意對象和未知基因進行轉(zhuǎn)錄組分析�,徹底轉(zhuǎn)變了傳統(tǒng)轉(zhuǎn)錄組學(xué)的研究思路[59-60]。轉(zhuǎn)錄組學(xué)和單細胞測序技術(shù)的飛速發(fā)展����,使得單細胞轉(zhuǎn)錄組、空間轉(zhuǎn)錄組和單細胞免疫組庫分析技術(shù)不斷成熟�����,并廣泛應(yīng)用于疾病診斷和疫苗開發(fā)過程中��。轉(zhuǎn)錄組學(xué)聯(lián)合代謝組學(xué)和蛋白質(zhì)組學(xué)技術(shù)��,能夠全方位�、多層次、立體化地描述病原體感染宿主后發(fā)生的復(fù)雜生物學(xué)進程,大大加快新型疫苗的開發(fā)�。
近年來,合成生物學(xué)脫穎而出���,為新型疫苗的設(shè)計和生產(chǎn)開辟了新的策略����,成為反向疫苗學(xué)技術(shù)研究中必不可少的重要工具�。合成生物學(xué)能夠應(yīng)用于疫苗設(shè)計、開發(fā)和生產(chǎn)等各環(huán)節(jié)中���,通過建立多種無細胞表達體系��、定向改造工程生物和細胞模型來提高研發(fā)效率����,同時降低生產(chǎn)成本����。例如���,研發(fā)人員通過合成生物學(xué)建立多種不具傳染性的通用類病毒樣顆粒(VLP)平臺��,結(jié)合結(jié)構(gòu)設(shè)計和計算機建模等平臺�,合成、改造并優(yōu)化候選疫苗分子的活性���,提高候選蛋白的穩(wěn)定性�,開發(fā)出多種病毒結(jié)構(gòu)蛋白和噬菌體作為靶向多種病原體的疫苗平臺���,為工程化疫苗的開發(fā)建立平臺[61-64]�。
疫苗開發(fā)過程中的重大進展往往是由發(fā)現(xiàn)新的候選抗原和優(yōu)化免疫靶標的結(jié)構(gòu)來驅(qū)動的�����,但具體過程非常復(fù)雜����,需要聯(lián)用多種技術(shù)手段共同推進?��;诙嘟M學(xué)的生物信息分析和免疫篩選結(jié)果確定候選分子����,結(jié)合計算機建模���、結(jié)構(gòu)生物學(xué)和系統(tǒng)免疫學(xué)分析的結(jié)果����,并將得到的信息應(yīng)用于表位預(yù)測和靶標設(shè)計中,最終才能得到理想的疫苗候選分子�。
3、 候選抗原有效性的分析與驗證
3.1 候選抗原的高通量表達
基因組學(xué)分析后得到的部分候選基因并沒有轉(zhuǎn)錄活性���。為此�����, 研發(fā)人員優(yōu)化出一種篩選具有轉(zhuǎn)錄活性的多聚酶鏈反應(yīng)(transcriptionally activepolymerase chain reaction�,TAP)����,通過連續(xù)PCR 技術(shù)擴增出目的基因,并在目的基因兩側(cè)添加啟動子和終止子等表達調(diào)控元件��。獲得的TAP 片段能夠模擬pcDNA3.1 表達質(zhì)粒的活性����,再通過轉(zhuǎn)染在體內(nèi)或體外系統(tǒng)中表達目的基因[65]。TAP 組分也可以用作DNA 疫苗免疫小鼠��,篩選評價目的基因產(chǎn)物��,還能夠通過同源重組轉(zhuǎn)入質(zhì)粒進行體外功能探索�。
通過多組學(xué)分析和多技術(shù)聯(lián)用篩選得到的功能性基因,需要進行高通量的克隆表達��,以鑒定候選分子的免疫原性���。PCR 和體外自動化表達系統(tǒng)的發(fā)展為快速鑒定候選分子提供了方法�����。從目標基因序列設(shè)計入手���,通過PCR擴增將目標基因克隆到大腸桿菌的表達載體上,融合多組氨酸標簽或GST 等商業(yè)化標簽��,在原核細胞系統(tǒng)中進行高通量表達���。通過簡單的親和柱色譜或離子親和色譜���,可快速純化蛋白。對于表達在包涵體中的目標蛋白���,可以通過變復(fù)性溶解和親和色譜聯(lián)用等方法�,最終獲得有活性的目標蛋白。目前��,基因克隆和體外表達蛋白等各個階段已經(jīng)可以借助多種自動化儀器進入“一鍵式”高效表達階段���,極大提高了利用反向疫苗學(xué)技術(shù)開發(fā)新型疫苗的速度和效率�。
利用原核細胞體外表達蛋白的方法雖然被廣泛應(yīng)用�,但是該方法每一步都耗時耗力�,存在一定的局限性��。近年來�,無細胞蛋白表達系統(tǒng)的興起���,給高通量表達蛋白的發(fā)展注入了“催化劑”��。無細胞蛋白表達系統(tǒng)極大簡化了操作步驟和下游實驗流程[66]�����,突破傳統(tǒng)細胞內(nèi)表達的極限����,能夠?qū)崿F(xiàn)多模板和多系統(tǒng)的同時表達,還能夠克服毒性蛋白����、包涵體蛋白的表達難題, 完成多種標記修飾�。此外, 無細胞蛋白表達系統(tǒng)還可以直接表達類病毒樣顆粒(VLP)�,應(yīng)用于病毒疫苗的開發(fā)[67]。
3.2 候選抗原的免疫原性檢測
免疫原性是指能夠刺激機體免疫系統(tǒng)產(chǎn)生免疫應(yīng)答的特性��,其能作用于B 淋巴細胞和T 淋巴細胞的抗原識別受體��,促使細胞快速增殖����、分化�,從而產(chǎn)生免疫效應(yīng)物質(zhì)�,如特異性抗體和致敏淋巴細胞��。免疫原性檢測是疫苗研發(fā)過程中作為評價疫苗有效性的一個重要參考指標���,主要包括B 細胞免疫應(yīng)答檢測和T 細胞免疫應(yīng)答檢測。
3.2.1 B 細胞免疫應(yīng)答檢測
B 細胞是誘導(dǎo)體液免疫的細胞�,主要通過分泌抗體產(chǎn)生體液免疫應(yīng)答。它是由骨髓內(nèi)多功能干細胞分化而來�,需要在骨髓內(nèi)發(fā)育及成熟,成為初始的成熟B細胞��,之后隨體液循環(huán)遷移到外周淋巴組織�。若無相應(yīng)抗原刺激����,B 細胞會在幾周后凋亡����;若遇到相應(yīng)抗原刺激,B 細胞將會活化�����、增殖進而分化成漿細胞產(chǎn)生抗體�,而少數(shù)B 細胞會成為記憶細胞�。B 細胞的活化根據(jù)抗原類型的不同可分為胸腺依賴性抗原和胸腺非依賴性抗原��,顧名思義即需要Th 細胞直接接觸B 細胞才能使其活化和不需要Th 細胞接觸就能直接活化B 細胞��。對于胸腺依賴性抗原,B 細胞在活化后,需要進入生發(fā)中心進一步增殖和分化����。首先�,活化的B 細胞遷移到濾泡中心進行周期性大量增殖和體細胞高頻突變,形成細胞密集的生發(fā)中心暗區(qū)�,體細胞高頻突變發(fā)生在B 細胞識別抗原后的分裂增殖過程中����,突變主要在B 細胞膜表面免疫球蛋白可變區(qū)的互補決定區(qū)�����,而這個互補決定區(qū)是決定抗體與抗原結(jié)合親和力的關(guān)鍵。而后B 細胞遷移到生發(fā)中心明區(qū)�,在濾泡Th 細胞和濾泡樹突狀細胞(follicular dendritic cell,F(xiàn)DC)的協(xié)助下進行親和力成熟(即能夠結(jié)合特異性抗原的具有高親和力免疫球蛋白受體的B 細胞被選擇存活)���、抗體類別轉(zhuǎn)化(即在細胞因子作用下,抗體可變區(qū)不變��,恒定區(qū)發(fā)生改變�����,從而改變抗體類型�,而不改變結(jié)合抗原的特異性)����、分化成漿細胞和記憶B 細胞。漿細胞能夠合成和分泌抗體��,記憶B 細胞能夠在相同抗原二次刺激后�,迅速分化成漿細胞��,從而產(chǎn)生大量抗體進行體液免疫[68]�。
B 細胞免疫應(yīng)答檢測包括B細胞在生發(fā)中心成熟分化的過程��,以及分泌抗體與抗原結(jié)合的反應(yīng)檢測�。常用技術(shù)包括生發(fā)中心染色�、活體組織成像技術(shù)�、酶聯(lián)免疫斑點試驗(enzyme-linked immunospot assay,ELISPOT)�、瓊脂糖擴散法、酶聯(lián)免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)�����、免疫印跡等���。
生發(fā)中心染色首先需要準備淋巴組織并進行特殊的處理(如液氮冷凍處理)����,之后通過激光顯微切割技術(shù)制備切片,再用抗體對樣品進行染色,常用的抗體包括CD21 和Ki67(CD21 為B淋巴細胞表面輔助受體����,在B 細胞分化��、增殖及抗原生成等方面起著重要作用;Ki67 是反應(yīng)細胞增殖能力的一個重要指標)���,最后用熒光顯微鏡進行結(jié)果觀察���?���;铙w全組織成像技術(shù)主要采用生物發(fā)光與熒光兩種技術(shù)��,生物發(fā)光是用熒光素酶報告基因標記細胞或DNA�����,利用其產(chǎn)生的蛋白酶與相應(yīng)底物發(fā)生生化反應(yīng)產(chǎn)生生物體內(nèi)的探針光信號�����;而熒光成像則是采用熒光報告基團或熒光染料進行標記����,利用熒光蛋白或染料產(chǎn)生的熒光形成體內(nèi)的熒光光源。該技術(shù)應(yīng)用非常靈敏的光學(xué)檢測儀器能夠直接監(jiān)測活體生物體內(nèi)的細胞活動和基因表達,跟蹤目標的移動和變化��,如通過對淋巴結(jié)或B 細胞標記可以追蹤生發(fā)中心內(nèi)淋巴結(jié)或B 細胞的遷移情況。ELISPOT 即將細胞置于包被有特異性抗體板子中,在有刺激的條件下,細胞分泌的細胞因子或免疫球蛋白會被包被抗體捕獲���,移除細胞后�����,被捕獲的細胞因子或免疫球蛋白可進一步使用生物素標記的第二抗體進行標識����,形成“抗體- 抗原- 抗體”復(fù)合物�,其后再與酶標記親和素作用���,并加入底物使其呈色�,形成斑點即說明細胞產(chǎn)生了細胞因子或免疫球蛋白。該技術(shù)是檢測分泌細胞的一種重要手段����。
抗原抗體反應(yīng)是抗原與相應(yīng)抗體在體內(nèi)外發(fā)生的特異性結(jié)合反應(yīng)��。檢測抗原抗體反應(yīng)的經(jīng)典方法是瓊脂糖擴散法��,其原理是可溶性抗原與相應(yīng)抗體在半固體瓊脂凝膠內(nèi)擴散�,二者相遇�����,在比例合適處形成白色沉淀線���,一條沉淀線即代表一種抗原與抗體的沉淀物,因而此法還可以用于鑒別多種抗原或抗體成分��。另一種常用的方法是免疫酶技術(shù)��,就是將抗原抗體反應(yīng)特異性與酶的高效催化作用有機地結(jié)合起來��。其是把具有催化活性的酶類和抗體(抗原)結(jié)合起來成為酶標記物�,將這種酶標記物與待測的抗原(抗體)結(jié)合��,通過酶的活性降解底物呈現(xiàn)出顏色從而對抗原(抗體)進行定性或定量分析�。目前, 應(yīng)用最多的免疫酶技術(shù)是ELISA���,其是使抗原或抗體吸附于固相載體�,使隨后進行的抗原抗體反應(yīng)均在載體表面進行�,從而簡化了分離步驟,提高了靈敏度���,既可檢測抗原�,也可檢測抗體�。實驗方法包括間接法����、夾心法及競爭法�����。常用的酶包括辣根過氧化物酶(HRP)和堿性磷酸酶(AP),相應(yīng)的底物分別是鄰苯二胺(OPD)和對硝基苯磷酸鹽(pNPP)��,前者呈色反應(yīng)為棕黃色,后者為藍色,可用于目測定性�,也可用于酶標儀測定光密度(OD)值以反映抗原或抗體的含量����。還有一種方法是免疫血清的特異性免疫印跡檢測���,即將抗原蛋白或細菌提取物進行蛋白質(zhì)凝膠電泳及轉(zhuǎn)膜,之后免疫血清作為第一抗體孵育���,HRP 標記的抗體作為第二抗體孵育��,最后用發(fā)光成像儀進行顯影即可觀察到抗原抗體是否特異性結(jié)合���。
3.2.2 T 細胞免疫應(yīng)答檢測
T 細胞免疫應(yīng)答通常檢測CTL 活性�、T 細胞增殖和細胞因子����。CTL 活性檢測最初使用的是鉻釋放測定法����,該方法由于使用放射性的51Cr 不利于安全操作及廢物處理�,且需特殊測定儀器��,因此研究人員一直試圖尋找其他的替代方法��。目前,CTL 活性檢測方法主要包括熒光測定法�、報告基因轉(zhuǎn)染法和比色測定法�。
熒光測定法又可分為熒光掃描測定法��、流式細胞分析法和樹突狀細胞清除法[69]�����。其中��, 熒光掃描測定法包括alamarBlue一步熒光測定法和Calcein-AM 熒光掃描測定法[70-71]��。流式細胞分析法包括PE-mAb/FITC-annexin V 熒光標記法、DIOC18 (3)/ 碘化丙啶(PI) 熒光標記法、PKH-26/CFSE 熒光標記法[72-74]��。這些方法靈敏度高、重復(fù)性好�,適用于大批量樣品的測定�。報告基因轉(zhuǎn)染法則需要構(gòu)建報告基因穩(wěn)定轉(zhuǎn)染細胞系��,該方法靈敏度高���,不同報告基因轉(zhuǎn)染的細胞系可同時測定CTL 殺傷活性且結(jié)果互不干擾。但該方法也有不足之處�,如制備細胞系耗時費力��,且報告基因在一些靶細胞中有時會出現(xiàn)難以轉(zhuǎn)染或表達的情況[75]�����。除了上述方法��,還有比色測定法����,如MTT 法或MTS 法和乳酸脫氫酶(LDH)釋放法[76-77]�����。另外也有一些其他的CTL 活性測定方法,如“ 雞尾酒” 混合刺激法���、ELISPOT 等[78-80]���。
T 細胞增殖檢測的方法主要包括氚標淋巴細胞增殖測定法(3H-TdR 摻入法)���、MTT 法、MTS 法和XTT 比色法���。由于氚標記法需要使用放射性同位素��,且購買和使用都有相關(guān)要求,也需要專業(yè)的操作人員���。因此����,目前使用較為普遍的是MTT、MTS和XTT 這三種方法。MTT 法又稱MTT 比色法�,其檢測原理為活細胞線粒體中的琥珀酸脫氫酶能使外源性MTT 還原為水不溶性的藍紫色結(jié)晶甲瓚并沉積在細胞中,而死細胞無此功能��,且結(jié)晶形成的量與細胞數(shù)成正比[81]��。MTS和XTT 原理與MTT 一樣���,且已經(jīng)有商品化的MTS 細胞增殖試劑盒,這使得T 細胞增殖檢測更方便。
細胞因子檢測方法主要包括實時定量PCR(real time PCR,RT-PCR) 技術(shù)、ELISPOT 和流式分析法��。RT-PCR 主要用于檢測細胞因子的mRNA 水平���,此方法需要相應(yīng)的引物和熒光報告分子��,且檢測的是細胞因子基因而非細胞因子本身�����,該方法具有操作簡單����、特異性強、靈敏度高等特點[82]�。ELISPOT 和流式分析法是基于免疫學(xué)檢測的兩種方法����,原理是細胞因子與相應(yīng)的特異性抗體結(jié)合�,通過熒光或酶等標記技術(shù)將信號放大,從而定性或定量檢測細胞因子水平����,這兩種方法具有操作簡單快捷��、特異性高���、重復(fù)性好等特點[83-84]。
3.3 候選抗原的免疫效果評價
確定抗原有效保護力最直接的方法是進行動物試驗��。因為有些具有免疫原性的抗原可能不具有保護作用�,或者雖然具有保護作用但會出現(xiàn)一些不良反應(yīng)。因此�,疫苗效果評價是決定疫苗成功與否的最后關(guān)鍵步驟。免疫效果評價的方法主要包括動物流行病學(xué)方法����、血清學(xué)方法和動物攻毒保護試驗����。
動物流行病學(xué)方法即對免疫動物和非免疫動物的生長表現(xiàn)�、生化指標�、病死率等臨床指標進行調(diào)查統(tǒng)計,通過統(tǒng)計學(xué)分析比較��,評價疫苗的免疫保護效果��。生長表現(xiàn)包括體重變化����、體溫變化等��。生化指標包括注射部位是否出現(xiàn)充血、腫脹�、硬結(jié)等現(xiàn)象����,血常規(guī)�����、尿常規(guī)���、心電圖等指標是否異常����。
血清學(xué)方法包括中和抗體滴度檢測以及抗體中和試驗�?��?贵w滴度是用來衡量某種抗體識別特定抗原表位所需要的最低濃度(即最大稀釋度),一般表示為能產(chǎn)生陽性結(jié)果的最大稀釋度�����,常用ELISA 檢測抗體滴度��。通過比較免疫前后抗體滴度升高的幅度及持續(xù)時間來評價疫苗的免疫保護效果����。抗體中和試驗是將病毒或毒素與中和抗體進行混合孵育��,使二者發(fā)生反應(yīng)�����,再將二者的混合物接種到敏感的細胞中���,測定殘存的病毒或毒素感染力的一種方法�??贵w中和試驗具有較高的特異性,利用同一病毒(病原菌)的不同型毒株(菌株)或不同型標準血清����,即可測得相應(yīng)血清或毒株(菌株)的型,因此該方法常被研究人員用于鑒定病毒(或病原菌)的種或型��。
動物攻毒保護試驗即在免疫一段時間后�,用病原菌或病毒感染動物模型,攻毒后通過觀察動物的臨床表現(xiàn)����、檢測攻毒后中和抗體的變化、病原菌或病毒載量的差異以及組織病理學(xué)檢測等指標從而評價疫苗的保護效果。動物的臨床表現(xiàn)包括觀察是否出現(xiàn)明顯臨床癥狀����、是否出現(xiàn)體重急劇變化���、是否出現(xiàn)發(fā)病或死亡的情況等�����。攻毒后的抗體水平檢測和上述血清學(xué)方法相同。病原菌或病毒載量的檢測一般采用RTPCR法����,即提取待檢測樣品(血液或組織等)中的RNA,用特異性的引物和探針對RNA 樣品進行RT-PCR 擴增�,最后通過比較免疫組和非免疫組中的病原菌或病毒載量之間的差異評價疫苗的保護效果���。組織病理學(xué)檢測主要采用組織病理切片方法����。該方法是將部分有病變的組織或臟器經(jīng)過各種化學(xué)品和包埋劑的處理��,使之固定硬化�,在切片機上切成薄片�,最后染以各種顏色�,在顯微鏡下觀察病理變化。常用的染色方法是蘇木素- 伊紅(hematoxylin-eosin)染色法�,簡稱HE 染色法。蘇木素是一種堿性染料���,可使組織中的嗜堿性物質(zhì)染成藍色,如細胞核中的染色質(zhì)等���。伊紅是一種酸性染料�,可使組織中的嗜酸性物質(zhì)染成紅色����,是胞質(zhì)、膠原纖維�、肌纖維、嗜酸性顆粒等常用的染料����。HE 染色法對任何固定液固定的組織和應(yīng)用各種包埋法的切片均可使用。常規(guī)蘇木素染色中的對比染色是用伊紅�,近年來在英國�、美國的一些實驗室則采用熒光桃紅(phloxine),此外也有用桔黃G(orange G)�、比布里希猩紅(biebrich scarlet)、波爾多紅(bordeaux red)等作為對比染色�。
4���、 結(jié)語
反向疫苗學(xué)技術(shù)的飛速發(fā)展為復(fù)雜的病原體開發(fā)新型有效的疫苗����、攻克流行性疾病開辟了新思路���。反向疫苗學(xué)技術(shù)具有大規(guī)模���、高通量、自動化等特點�,充分利用基因組學(xué)、蛋白質(zhì)組學(xué)���、免疫組學(xué)以及生物信息學(xué)等手段篩選潛在的疫苗候選分子����,并鑒定出具有保護性的抗原,在防治新型突發(fā)傳染病方面具有一定的優(yōu)勢��。對于部分病原體�,利用傳統(tǒng)疫苗方法研究依舊存在瓶頸的�����,建議可以積極嘗試利用反向疫苗學(xué)技術(shù)進行新型疫苗的研發(fā)����。