質(zhì)量源于設計在制劑的設計過程中發(fā)揮到關鍵性的作用��,使得最終的制劑產(chǎn)品安全有效��,質(zhì)量可控���。本文以國內(nèi) 28 篇文獻為依據(jù)��,對質(zhì)量源于設計在制劑設計中的應用進行了概述和總結��,闡述了質(zhì)量源于設計(quality by design, QbD)的概念并探討了其在藥物制劑設計過程中發(fā)揮的作用����;對 QbD 的總體研究思路以及其在固體制劑����、液體制劑設計中的應用進行了概述并闡述了 QbD 理念在中藥緩控釋制劑的研發(fā)思路;最后總結了 QbD 理念在制劑設計中的應用前景并進行了討論���。質(zhì)量源于設計理念在制劑設計中的應用是一種科學有效的新方法�,具有很高的研究價值��,具有著極其重要的作用���。
質(zhì)量源于設計(QbD)是于 2006 年由美國食品藥品監(jiān)督管理局(FDA)首次提出的一種先進的科學理念——用于藥品的研發(fā)生產(chǎn)���,隨后��,便被人用藥品注冊技術要求國際協(xié)調(diào)會(ICH)納入了新藥開發(fā)和質(zhì)量風險管理規(guī)范當中����。目前�,質(zhì)量源于設計這個先進理念正逐漸被人類認知并應用于各種制劑的研發(fā)生產(chǎn)制備當中,其正處于蓬勃發(fā)展的關鍵時期�����,而這一理念的應用�����,為人類藥品研發(fā)生產(chǎn)制備帶來的結果是的最終產(chǎn)品的高效生產(chǎn)率����、高質(zhì)量���、低風險和低召回����。根據(jù)ICH的質(zhì)量指導文件中已明確提出的 QbD 原則[1]表明,建議醫(yī)藥行業(yè)應當從傳統(tǒng)的“質(zhì)量源于檢測”的觀念轉變?yōu)?ldquo;質(zhì)量源于設計”的觀念[2-3]�����,進而從根本上進一步地改變醫(yī)藥行業(yè)的制劑研發(fā)制備生產(chǎn)的理念���。
何謂“質(zhì)量源于檢測”���,顧名思義,我們可以該理念理解為:藥品的最終質(zhì)量是否過關�,只依賴于最終產(chǎn)品的檢驗環(huán)節(jié);而“質(zhì)量源于設計”則徹底打破了這種傳統(tǒng)的理念�,該理念強調(diào)的是從目標產(chǎn)品的設計源頭開始,在設計及生產(chǎn)制備中就逐步進行“檢驗”���,讓制劑的整個研發(fā)生產(chǎn)過程伴隨著檢驗�����。質(zhì)量源于設計這種先進的理念在制劑的設計過程中�����,具有著得天獨厚的優(yōu)勢�����,為高質(zhì)量藥品的生產(chǎn)奠定了基礎���。
1�、QbD 的概念及其在藥物制劑設計過程中發(fā)揮的作用
1.1QbD 的概念
根據(jù) ICH Q8(R2)指南����,其將質(zhì)量源于設計(Quality by Design, QbD)這個理念定義成為“一套系統(tǒng)的研發(fā)方法,即從預定的目標開始�����,基于科學的風險質(zhì)量管理技術����,重視對影響藥品性質(zhì)的質(zhì)量屬性,重視對制備工藝過程的理解以及對生產(chǎn)過程的控制”����。
實施 QbD 理念強調(diào)充分理解原料藥物的性質(zhì)和工藝參數(shù)對藥品質(zhì)量的影響��,同時還強調(diào)對工藝參數(shù)的控制,將藥物的處方設計研發(fā)���、工藝參數(shù)的優(yōu)化�、過程質(zhì)量的控制及質(zhì)量的監(jiān)督管理相結合����,以加深對藥品及其生產(chǎn)過程的理解[4-7],只有對藥品研發(fā)制備生產(chǎn)過程有著更加深入層次的理解���,才可以提高藥品的質(zhì)量���。
按照 QbD 的概念,我們可以將其理解為“一個藥品從開始研發(fā)就要考慮到藥品的最終質(zhì)量”����,即在處方的設計及選擇、制備工藝路線的確定及優(yōu)化����、工藝參數(shù)的選擇及優(yōu)化、物料配比的控制等各個相關方面都要進行深入的研究���,積累詳盡的理論和數(shù)據(jù)���,在深入透徹理解的基礎上��,確定藥品的最優(yōu)配方配比和藥品生產(chǎn)的最佳工藝路線��,從而滿足工藝參數(shù)的需求和最終產(chǎn)品的質(zhì)量需求�。
1.2QbD 理念在藥品生產(chǎn)研發(fā)過程中發(fā)揮的作用
一個藥品的生產(chǎn)研發(fā)過程是需要經(jīng)過極其繁瑣復雜的各種步驟�,但無論研發(fā)生產(chǎn)方式如何,最終都殊途同歸�,目的都是要保證藥物的安全有效且質(zhì)量可控?�;?QbD 的這種理念����,不但可以更加保證藥品的安全有效性與質(zhì)量可控性,同時還可以大大提高藥品的生產(chǎn)效率����,減少物料損耗。在未將 QbD 運用到藥品生產(chǎn)研發(fā)中之前���,藥品的合格與否只依賴于藥品的最終檢驗���,而當QbD 的理念被發(fā)掘并投入其中之后�����,從過去的只單純依賴藥品的最終檢驗,到對生產(chǎn)過程進行合理的控制�,再到藥物的設計和研究階段的控制,使得藥品質(zhì)量監(jiān)管的位置逐漸前移���。簡單來講��,就是從源頭上逐步強化了質(zhì)量監(jiān)督管理體系�,是一種科學有效的控制方法���,更加確保了藥品質(zhì)量����,保證了藥物的安全�。在生產(chǎn)研發(fā)過程中,由于研發(fā)開始前積累了詳盡的數(shù)據(jù)�,并通過各種方法手段確定了最優(yōu)的配方配比以及生產(chǎn)工藝路線,便大大降低了研發(fā)生產(chǎn)中的難度����,提高了藥品質(zhì)量�,降低了藥品的召回率�����,同時���,也大大提高了生產(chǎn)效率���。
2、QbD 理念的總體研究思路以及其在制劑設計中的應用
固體制劑是我們非常熟悉的一種制劑�,本綜述將從以下幾種不同劑型的藥物對 QbD 進行概述——散劑、顆粒劑�、片劑、膠囊劑���、液體制劑���、緩控釋固體制劑和微球制劑,由于片劑���、膠囊劑及緩控釋固體制劑的制備工藝較為復雜�����,需要考慮的因素較為繁多�����,本綜述會著重進行探討�。
2.1QbD 理念的總體研究思路
根據(jù) QbD 的理念���,一個藥品的生產(chǎn)研發(fā)過程可以分為以下三個主要的階段����。第一個階段是處方前研究階段��,即對所預選的化合物進行一些列基本性質(zhì)的研究探討�,比如物理性質(zhì)、化學性質(zhì)等等����,并且對研發(fā)風險進行一些列的評估,為后期生產(chǎn)研發(fā)提供各種依據(jù)和數(shù)據(jù)����;第二個階段是處方和工藝的設計及優(yōu)化��,使得藥品的研發(fā)生產(chǎn)達到物料消耗最少�,生產(chǎn)效率最優(yōu)�;第三個階段是將最終設計空間轉化為實際生產(chǎn)[8]即投入到車間生產(chǎn)。
基于 QbD 理念而實施的研發(fā)生產(chǎn)步驟��,可以大致分為以下幾步:第一���,需要確定目標產(chǎn)品�����,也就是最終想要獲得的產(chǎn)品���;第二,針對于該目標產(chǎn)品�,需要確定其質(zhì)量概況(產(chǎn)品質(zhì)量特征需求,QTPP)���;第三���,確定該藥品的關鍵質(zhì)量屬性(CQAs),并對其進行一系列風險評估���;第四���,定義該藥品的設計空間(DS)——與關鍵質(zhì)量屬性相關聯(lián)的關鍵物料屬性(CMAs)和關鍵工藝參數(shù)(CPPs)的建立及優(yōu)化���,并對其進行風險評估;第五����,定義工藝流程的設計空間�;第六,設計并實施控制策略——控制工藝流程�����;第七����,進行工藝驗證;通過驗證之后投入到實際生產(chǎn)中并且可以通過過程分析技術(PAT)��,對制備工藝進行持續(xù)的改進���。
2.2QbD 理念在固體制劑設計中的應用
2.2.1 散劑
散劑相對于其他劑型而言�����,其制備工藝極其簡單�。雖然只需要藥物粉末與輔料直接混合,但是需要考慮到的因素仍然有許多��。例如粒度����,水分,藥物與輔料之間是否發(fā)生相互作用等等�����,若只進行產(chǎn)品的最終檢驗���,且結果是不合格的情況下���,會造成物料的浪費,增加了生產(chǎn)消耗���。而將QbD 的理念運用其中����,我們就可以在生產(chǎn)研發(fā)前,進行處方前研究��,針對于所預選的藥物化合物及輔料進行基本性質(zhì)的研究���,針對以產(chǎn)品特征需求和產(chǎn)品質(zhì)量特征需求來嚴格篩選生產(chǎn)工藝參數(shù)和物料配比��,增加對制備工藝的理解���,進行風險評估逐步排查各個步驟中所存在的風險因素及問題,通過試驗設計�����,對工藝進行優(yōu)化及驗證����。這些大大提高了藥品的質(zhì)量并且降低了生產(chǎn)過程中誤差的出現(xiàn)�。在將質(zhì)量源于設計理念應用于冰硼散散劑的質(zhì)量研究[9]中,通過風險評估(RA),識別出影響該制備工藝參數(shù)的關鍵工藝步驟是物料的前處理(干燥�����、洗凈���、切割等)����、粉碎、過篩���、混合分裝以及包裝貯存��,而影響關鍵質(zhì)量屬性(含量均勻度���、裝量差異、包裝密封性等)的關鍵工藝參數(shù)包括過篩篩網(wǎng)的目數(shù)��、混合時間�、包裝熱合溫度;通過試驗設計(DoE)����,對關鍵質(zhì)量屬性、關鍵物料屬性和關鍵工藝參數(shù)進行函數(shù)關系的確定���,確定合適的設計空間和控制空間���,對工藝及處方物料進行優(yōu)化�����,確保了該散劑的有效性�����、穩(wěn)定性和安全性��。
2.2.2 顆粒劑
我們可以將顆粒劑理解為����,在散劑的基礎上�����,向其中加入一定量的粘合劑�,制成干燥顆粒后所得的制劑。并且其制備過程相對于其他劑型而言也較為簡單�����,但是在處方中由于粘合劑的加入�,相當于物料的多樣性有所增加�����,且由于其制備工藝的多樣性,在制備�、前、中后需要考慮的因素會有所增加��,所以�,顆粒劑的質(zhì)量檢查項目也有所增加,結合 QbD 的理念會使得制備的難度降低��,在保證藥品高質(zhì)量的同時提高了生產(chǎn)效率�����。在基于質(zhì)量源于設計理念的紅花顆粒的制備實驗中[10]���,經(jīng)前期的處方前研究����,確定了原料藥及各種輔料的性質(zhì)���、各種物料的配比以及制備工藝的最優(yōu)方法�����,在降低了制備該顆粒劑的難度同時提高了該顆粒劑各項質(zhì)量檢查項目的合格率�。基于QbD 的理念����,并通過對顆粒劑各項工藝參數(shù)的優(yōu)化,使得所得產(chǎn)品的各項性質(zhì)在一定程度上都達到了最優(yōu)�。所以我們不難看出,這便是融入 QbD 理念的優(yōu)勢所在���,為顆粒劑的質(zhì)量檢查的高合格率提供了有效且合理的數(shù)據(jù)支持和理論依據(jù)��,再者而言就是降低了制備過程中的各種風險的發(fā)生���,使得生產(chǎn)制備過程較為順利的完成。
2.2.3 片劑
片劑是原料藥物與合適的輔料制備成的片狀固體制劑����,有多種制備工藝,由于片劑內(nèi)需要多種輔料����。如潤濕劑、崩解劑��、稀釋劑�、潤滑劑,所以每種制備工藝均需考慮諸多因素���,以保證藥物與輔料之間��,輔料與輔料之間的相互影響達到最優(yōu)甚至相互無影響而達到相輔相成��。若將一種藥物制備成緩控釋片劑�,則其制備工藝會難上加難���,并且需要考慮到骨架材料的緩控釋效果以及是否影響藥物的釋放的諸多因素��。片劑的崩解度會影響藥物的吸收速率�����,這便要求物料的配比和制備工藝參數(shù)達到最優(yōu)化�,應用 QbD 理念將會使這種復雜的���,有難度的����,要求高的制備工藝相對簡單化,研發(fā)制備之前的詳盡的數(shù)據(jù)��,為工藝參數(shù)的優(yōu)化提供了數(shù)據(jù)支持�;每個步驟的優(yōu)化都相當于每個步驟的監(jiān)管,大大提高了藥品的質(zhì)量����,同時降低了物料的消耗。以仙曲片片劑薄膜包衣工藝為例[11]�,該實驗以 QbD 理念為依據(jù),采用合理的實驗設計方法�,通過建立合理的設計空間為仙曲片薄膜包衣過程提供了預測模型,提高了包衣過程的可控性和可適用性���,保證了穩(wěn)定的產(chǎn)品質(zhì)量��。在實驗前���,基于 QbD 理念進行實驗步驟,首先明確了產(chǎn)品質(zhì)量的目標�����,通過了解仙曲片理化性質(zhì),分析薄膜包衣過程中的各種風險因素���,確立了關鍵工藝參數(shù)并對仙曲片薄膜包衣工藝進行設計與優(yōu)化,取各項指標均符合藥典標準的仙曲片素片���,選擇折光系數(shù)符合要求的包衣預混劑對其進行薄膜包衣����,通過單因素實驗進行篩選�,利用 Box-Behnken 響應面法[12-13]優(yōu)化薄膜包衣參數(shù),篩選出仙曲片薄膜包衣最優(yōu)的工藝參數(shù)并對其結果進行驗證���,為產(chǎn)品的工業(yè)化生產(chǎn)奠定了質(zhì)量基礎�。通過 QbD 理念在該實驗中的應用����,使得制備的工藝參數(shù)趨于最優(yōu)化,降低了生產(chǎn)操作中的誤差�,提高了藥品的生產(chǎn)效率,降低了包衣過程的難度���,使得整個制備工藝可以較為順利的進行�����。
2.2.4 膠囊劑
膠囊劑相對于以上所述的三種固體制劑���,由于其在原料藥物和輔料之外還包裝了空心膠囊或者軟質(zhì)囊材�����,所以膠囊劑有著更高的質(zhì)量要求和更難的制備工藝��。由于膠囊外殼和片劑包衣有著本質(zhì)上的區(qū)別(無論是制備材料還是制備工藝),所以需要考慮的相互影響因素更加繁瑣復雜�����,包括藥物與輔料之間����、輔料與輔料之間���、藥物與膠囊外殼之間和輔料與膠囊外殼之間����。根據(jù)鹽酸坦索羅辛緩釋膠囊的處方工藝研究��,其基于 QbD 的理念,應用于該藥物的開發(fā)�����。由美國 FDA 批準的Flomax(鹽酸坦索羅辛緩釋膠囊)自上市以來�,由于其療效良好而被廣泛應用。該試驗以其為參比制劑���,基于 QbD 的理念,制備了一種體外溶出行為與其相似的鹽酸坦索羅辛緩釋膠囊[14]��。該藥物在小腸中和胃部的釋放度受較多條件的限制���,所以其可以設計的空間較小���。但是將 QbD 的理念應用于其中后,結果證明:應用 QbD 理念于其中后��,不僅可以快速尋找出設計空間�,而且還可使得該藥物的質(zhì)量得到了提高,對其制備進行了有效控制��,降低了制備中的風險�����,同時提高了生產(chǎn)效率。
2.2.5 緩控釋片劑
與傳統(tǒng)的藥物劑型相比�,緩控釋制劑具有顯著的優(yōu)勢,首先最基本的一點就是可以延長藥物在體內(nèi)的半衰期�����,其次緩控釋制劑使藥物得釋放趨于一個平穩(wěn)的狀態(tài)���,避免了藥物的突釋所帶來的副作用����,可將藥物濃度較長時間維持在最小有效濃度和最小中毒濃度之間�����,降低了用藥的次數(shù)�����,顯著提高了用藥的安全性和患者的依從性[15]�����。
基于以上的優(yōu)勢,將藥物制備成緩控釋制劑已經(jīng)逐漸趨于常態(tài)化��,尤其是口服緩控釋片劑最為常見�,其中緩控釋骨架片劑是占主導地位,其以親水性凝膠骨架材料為釋放藥物的載體?��,F(xiàn)將QbD 理念融入到制備緩控釋骨架片劑之中���,將市售的茶堿緩釋片作為參比制劑,以確定 QbD 理念在制劑制備中的科學有效性���。制備緩釋片的關鍵在于它的釋藥過程,該研究首先通過文獻查閱了解茶堿的理化性質(zhì)�����,茶堿的臨床常用劑型為氨茶堿片劑��,之后進一步確定了影響關鍵物料屬性的各種因素���,確定了處方的組成及物料配比���,如粘合劑���、稀釋劑的性質(zhì)及用量,并進行了風險評估����,接著采用了 4 因素 3 水平 L18 正交表對實驗進行了設計和試驗,并且對試驗結果進行了驗證����,確定了對實驗有影響的關鍵工藝參數(shù),最后找出了設計空間��,進行了工藝參數(shù)以及處方組成的最優(yōu)化和驗證��。由最后參比制劑和研究制備的制劑�,對比了兩制劑的釋放度曲線的相似因子,表明融入 QbD 理念所制備的緩釋凝膠骨架片各項均符合要求[16]����。
2.3QbD 理念在液體制劑設計中的應用
液體制劑相對于固體制劑而言,劑量易于劃分�,藥物以分子或者小微粒分散在分散介質(zhì)中,藥物吸收速度快����,生物利用度較高���,同時可減少藥物的刺激性[15]。以下著重介紹 QbD 在注射劑設計中的應用和注射用無菌粉末設計中的應用����。
2.3.1 注射劑
注射劑作為目前臨床應用范圍較廣的劑型之一,除了具有上述優(yōu)點以外���,還具有以下特點:
①可以定位給藥和局部給藥
②無法口服的藥物可以制備成注射劑
③無法口服給藥的患者可用注射劑給藥��。
注射液是直接進入血液循環(huán)中�,所以風險系數(shù)相對于片劑更高[17]�����,就要求其需要更高且更多的質(zhì)量要求�,如要求無熱源�����,無菌�,不溶性微粒、滲透壓、Ph 應符合要求等諸多質(zhì)量要求�,所以無論是在制劑設計還是研發(fā)生產(chǎn)過程中,對每一步的所得產(chǎn)品的質(zhì)量控制應更為嚴格合理����。應用 QbD 理念進行注射劑的研發(fā)生產(chǎn)具有重大意義,主要是對引起注射劑的一切風險來源進行分析�,包括處方因素和工藝因素,并且應用 QbD 對注射劑進行有效的質(zhì)量控制����,使得最終的產(chǎn)品達到安全有效、質(zhì)量可控���。
首先應對注射劑的風險來源進行分析����,主要包括無菌保證是否合格����、熱源、不溶性微粒(生產(chǎn)過程中引入的雜質(zhì))��、注射器具和儲存器具對藥物穩(wěn)定性的影響��。根據(jù) QbD 對上述風險進行研究,包括處方����、制備工藝以及儲存,通過對外界環(huán)境中和生產(chǎn)過程總的影響因素進行科學有效的控制���,使以上風險降至最低甚至不存在�。其次通過查閱文獻或者是對原研藥的說明書進行解讀���,定義目標產(chǎn)品的質(zhì)量概況�����,由風險來源分析��,確立關鍵質(zhì)量屬性�,包括無熱源�,無菌,不溶性微粒���、滲透壓、pH 和顏色����。再次是對關鍵物料屬性進行分析���,如分配系數(shù)、溶解度���、pKa 等等��,對處方工藝進行風險評估�,最為重要的是無菌保證����,即對滅菌工藝進行風險評估,在條件允許的情況下��,選擇風險最小的滅菌工藝���,一般為過度滅殺法����。然后進行設計空間的尋找并進行試驗設計�,確立關鍵工藝參數(shù)并進行有效控制,最終得到最優(yōu)的處方和工藝參數(shù)達到產(chǎn)品的安全有效����、質(zhì)量可控[17]�。
2.3.2 注射用無菌粉末
注射用無菌粉末亦被稱為粉針劑��,根據(jù)生產(chǎn)制備的工藝路線的區(qū)別���,可將其分為注射用無菌分裝制品和注射用冷凍干燥制品[15]�。二者的質(zhì)量要求除上述相同之外�,還有裝量差異,和冷凍干燥工藝的要求應符合規(guī)定����。
2.3.2.1 注射用無菌分裝制品
注射用無菌分裝制品中的風險來源除除無菌保證是否合格、熱源�、不溶性微粒(生產(chǎn)過程中引入的雜質(zhì))、注射器具和儲存器具對藥物穩(wěn)定性的影響之外����,還包括裝量差異以及藥物的穩(wěn)定性。通過文獻查閱得知影響裝量差異的因素是待分裝制品的流動性���,因其會對產(chǎn)品的質(zhì)量產(chǎn)生影響���,所以也同樣是關鍵物料屬性(CMAs)之一。通過對關鍵物料屬性的識別�,通過各種方法進行有效的控制,若由于物料吸濕性較高而引起的流動性較差�����,應通過試驗設計尋找出適宜的環(huán)境濕度并且控制儲藏的密封性�����;若由于藥物本身的流動性差����,可通過試驗設計尋找出合適的方法如粉碎或者是噴霧干燥以改變物料粒度大小和形態(tài)[15]。尋找設計空間以確保各因素變動的可接受范圍內(nèi)�,藥物治療得到有效控制。
2.3.2.2 注射用冷凍干燥制品
注射用無菌粉末中的風險來源除無菌保證是否合格����、熱源、不溶性微粒(生產(chǎn)過程中引入的雜質(zhì))�、注射器具和儲存器具對藥物穩(wěn)定性的影響之外,還包括冷凍干燥工藝參數(shù)的影響����,即關鍵工藝參數(shù)(CPPs)之一��,冷凍干燥可能會引入的風險因素包括��,藥物含水量過高����、產(chǎn)品外形不飽滿���、噴瓶[15]����。應對該工藝進行風險評估��,通過試驗設計制定有效的控制策略�,并對該工藝進行優(yōu)化,這要求對該工藝進行深入層次的理解��,考察關鍵工藝參數(shù)的可變動范圍��,確保藥品質(zhì)量在可接受范圍內(nèi)滿足需求�。
2.4中藥緩控釋制劑
中藥可以說是一種復方制劑,與現(xiàn)階段應用極為廣泛的化學藥物相比����,它包含的成分復雜且繁多����,用途多���,作用位點不明確,不同用途的有效成分有可能存在差異�,并可能存在不明確的成分。因此若想對中藥制劑進行有效的質(zhì)量控制�����,而進行有效合理的控制就在于 QbD 理念的融入��,即在目標產(chǎn)品的設計過程中����,尋找并確定影響關鍵質(zhì)量屬性和關鍵工藝參數(shù)的因素進而將其優(yōu)化[18]。現(xiàn)以模擬制備中藥滲透泵片劑為例����,遵循 QbD 的研發(fā)理念,應在制備該制劑時�,考慮一下要點:首先明確該中藥滲透泵片的用途,由于中藥中成分復雜繁多,應明確其主要有效成分�;其次確定該有效成分的累計釋放度并繪制曲線;再次是關鍵質(zhì)量屬性(CQAs)的確定:在滲透泵片劑中�,關鍵的物料影響因素有很多,比如致孔劑的用量和類別����;滲透壓活性物的用量和類別;推動劑的用量和類別�;半透膜材料的選擇;包衣液的濃度和增塑劑的用量及類別[19]����,然后就是通過風險評估,尋找制劑生產(chǎn)的風險因素�����,進行試驗設計(DoE)來確定關鍵工藝參數(shù)(CPPs)及其設計空間(DS)���,在設計空間的可接受范圍內(nèi)���,控制關鍵影響因素并尋找到風險最低的制備工藝,來提升制備工藝的穩(wěn)定性和靈活性[20]���。中藥的緩控釋制劑屬于近些年來中藥制劑中研究的熱點與焦點����,極具應用前景,將 QbD 理念與中藥緩控釋制劑結合�,一定是極具發(fā)展前途的研發(fā)制備方法。
2.5微球制劑
微球是指將主藥溶解或者分散在天然或者合成的高分子材料中所形成的微小球狀聚合物���;微球制劑主要由主要和高分子材料兩部分組成,其中高分子材料作為載體必須是生物可降解的���。在微球制劑的研發(fā)過程中應用 QbD 理念�����,以得到最優(yōu)的微球制劑���。
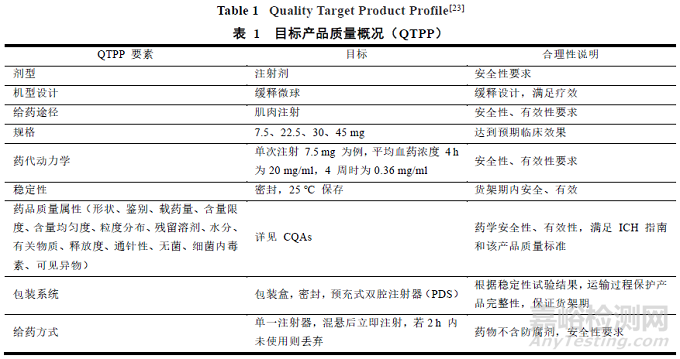
首先需要通過查閱文獻,運用 QbD 理念確定微球制劑的 QTPP�,以醋酸亮丙瑞林微球[21-22]為例進行概述。首先����,目標產(chǎn)品的質(zhì)量概況包括要素包括劑型�����、劑型設計���、給藥途徑、規(guī)格�、藥代動力學、穩(wěn)定性��、藥品質(zhì)量屬性和給藥方式����,見表 1[23]。
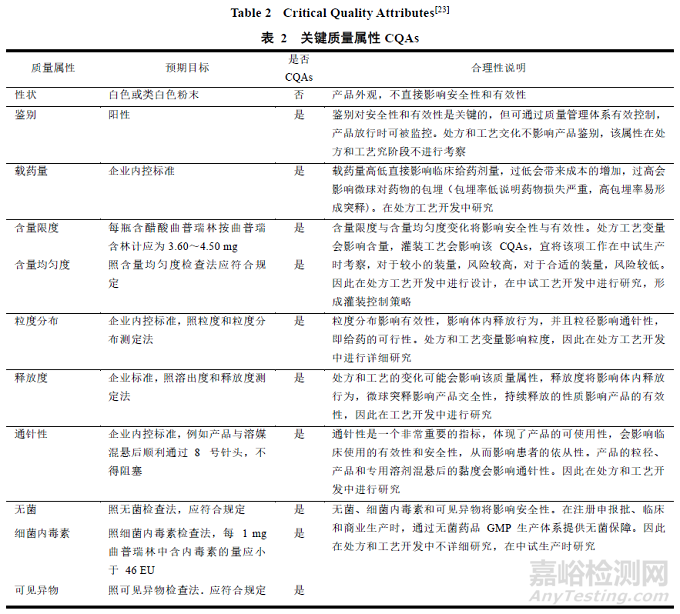
其次����,確定產(chǎn)品的 CQAs——物理、化學���、微生物�����、生物性質(zhì)或者特征�,應確保 CQAs 在界定的范圍內(nèi),從而達到預期產(chǎn)品的質(zhì)量合格[24]�。
參照國家食品藥品監(jiān)督管理總局注射用醋酸曲普瑞林進口藥品注冊標準(JX20160400),并結合上文文獻���,經(jīng)初步分析得出微球制劑的 CQAs�,包括鑒別����、載藥量、含量限度��、含量均勻度����、粒度分布���、殘留溶劑��、水分�����、有關物質(zhì)�、釋放度、通針性�����、無菌�、熱源、可見異物���。見表 2[23]��。
第三步����,進行風險評估以確定出對 CQAs 有影響的 CMAs 和 CPPs���,進一步加深對工藝的理解����。第四步確定設計空間����,合理的設計空間確保了產(chǎn)品的高質(zhì)量;通過查閱文獻�,對已掌握的知識和經(jīng)驗進行總結��,在理論上首先建立知識空間��,在該基礎上通過風險評估��、試驗設計來確定出最終的設計空間��。第五步控制工藝流程���,即得出一個符合各項質(zhì)量標準的控制空間。在控制空間內(nèi)��,對產(chǎn)品質(zhì)量和工藝流程產(chǎn)生影響的一系列因素會得到有效控制�,確保其在可控空間范圍內(nèi)。最后便是對該產(chǎn)品的不斷改進和改善過程����。
3���、QbD 在制劑設計中的應用前景
應用 QbD 理念生產(chǎn)制劑的目的就是在制劑過程中對產(chǎn)品的質(zhì)量進行科學有效的控制[25-30]�����,高質(zhì)量的藥品指的是藥品質(zhì)量穩(wěn)定�����,更是適用人群對藥品的認可度或好評度����,控制和優(yōu)化藥品的制備工藝和配料配比便是優(yōu)化藥品質(zhì)量的關鍵一環(huán),QbD 理念就是因此而誕生�。
目前,QbD 理念在固體制劑和注射劑中具有著的廣泛應用�����,雖然基于 QbD 理念的制備����,會使得在研發(fā)生產(chǎn)的前期投入較大量的人力、物力�����、精力和財力���,但是從長遠來看�����,QbD 的實施使藥物產(chǎn)品在生產(chǎn)過程中的浪費率和生產(chǎn)消耗都顯著降低���,同時提高了勞動效率�,對控制工藝保證質(zhì)量起到了決定性的作用[31-32]�����。
我認為在質(zhì)量源于設計的核心在于設計空間(DS)����,設計空間在一個藥品的整個研發(fā)制備生產(chǎn)過程中起到核心作用,我們可以將其理解為����,在傳統(tǒng)方法的基礎上,找出更寬泛的合適且合格的空間來對藥物的物料配比�����、生產(chǎn)工藝等進行修改優(yōu)化����,在設計空間中���,各因素在可接受的范圍內(nèi)變動����,均不會影響最終產(chǎn)品的質(zhì)量穩(wěn)定,這一點可以通過很普通且實際的例子來反映����,實驗室小規(guī)模制備到實際生產(chǎn),這一工藝放大的過程�,需要保證最終生產(chǎn)的產(chǎn)品質(zhì)量穩(wěn)定,這就可以理解為在設計空間內(nèi)尋找出的可接受范圍��,在這一范圍內(nèi)�,各種因素的變化及波動都不會影響到最終產(chǎn)品的質(zhì)量,這一優(yōu)勢可以為我們解決研發(fā)生產(chǎn)過程中的難題��,具有極其重要的應用價值和極其廣泛的應用范圍����。
在監(jiān)督管理方面,傳統(tǒng)的藥品制備前�、中、后的每個操作單元之間雖有一定的聯(lián)系�,但聯(lián)系的并不緊密,也沒有將各個單元之間結合。而基于 QbD 的理念�����,則是將研發(fā)�、審評、生產(chǎn)和監(jiān)管等多個單元有機地結合起來�����,從根本上為控制并提高藥品的質(zhì)量奠定了一定的科學基礎���,為藥品的監(jiān)督管理提供了新的理念和方法�����,并且由于風險評估和工藝驗證的存在���,目標產(chǎn)品的制備難度會大大降低而最終產(chǎn)品的質(zhì)量則會顯著提高。
在生產(chǎn)制備方面�,傳統(tǒng)的藥品生產(chǎn)制備中,由于不存在所謂的處方前研究���,沒有詳盡的試驗數(shù)據(jù)�,沒有確立制備工藝的最優(yōu)參數(shù),更沒有設計空間的建立�����,所以生產(chǎn)完成的藥品不合格率相比于現(xiàn)如今基于 QbD 理念而設計生產(chǎn)出的藥物低很多���,強制召回不合格藥物的事件也時有發(fā)生。并且在傳統(tǒng)的藥品生產(chǎn)制備方法中��,由于設備的改變以及磨損�、物料的變更、環(huán)境的差異以及生產(chǎn)人員的經(jīng)驗不同���,很容易造成產(chǎn)品批次間質(zhì)量的不穩(wěn)定甚至不合格�。
基于以上所述����,QbD 理念能顯著提高藥品的質(zhì)量穩(wěn)定性和生產(chǎn)研發(fā)效率,并且縮短藥物的審批時間�,降低產(chǎn)品的制備成本,減少產(chǎn)品不合格�����、召回的概率,更重要的是降低了藥品生產(chǎn)研發(fā)過程中物料的浪費和生產(chǎn)消耗��。這一先進的理念為人類提供了無法言喻的便捷并帶來了極其出色的效果����,但其潛在的應用性一定還遠不如此,我相信�,在不久的將來,QbD 理念將不僅僅應用于固體制劑��、注射劑等常用劑型�,甚至在納米級制劑,靶向性制劑中��,都會出現(xiàn)基于 QbD 理念而設計出的各種制劑�����,在不久的未來�,QbD 理念的應用只會更加地深入、更加的廣泛���、更加的靈活�,為各種新劑型的成功研發(fā)制備提供有力保證�����。
4、討論
QbD 理念在制劑設計中的應用已經(jīng)得到了較為廣泛的認可�,它是一個將監(jiān)管體系、風險控制和優(yōu)化深化集于一體的藥品研發(fā)方法�����,最重要的是����,它將藥品質(zhì)量的控制遷移至藥品的設計階段���,從源頭實施質(zhì)量管理�����,對藥品的高質(zhì)量生產(chǎn)具有決定性作用���。并且,在檢驗藥品是否合格時����,可以通過雙重判定標準來提高藥品的質(zhì)量��,即要求最終藥品既要滿足藥品質(zhì)量的合格標準����,又要使藥品的各因素均在設計空間的界定范圍內(nèi)����,從而獲得最優(yōu)的產(chǎn)品。
參考文獻
[1]ICH.Pharmaceutical Development[EB/OL]. http://www.ich.org/products/guidelines/quality/article/quality -guidelines.html.
[2] U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), et al. Guidance for industry: PAT–A framework for innovative pharmaceutical development,manufacturing and quality assurance [EB/OL]. http://www.fda.gov/downloads/Drugs/Guidances/ucm070305.pdf .
[3] HINZ DC. Process analytical technologies in the pharmaceutical industry: the FDA's PA T initiative[J]. Anal Bioanal Chem, 2006,84(5): 1036-1042.
[4] SINGH J. International conference on harmonization of technical requirements for registration of pharmaceuticals for human use[J]. J Pharmacol Pharm, 2015,6(3): 185-187.
[5] 龔行楚, 陳滕, 瞿海斌. 基于質(zhì)量源于設計理念的中成藥二次開發(fā)研究進展[J]. 中國中藥雜志, 2017,42(6):1031-1036.
[6] MEHTAP S, SEVGI T. Development and in-vitro evaluation of pH-independent release matrix tablet of weakly acidicdrug valsartan using quality by design (QbD) tools[J]. Drug Dev Ind Pharm, 2018,12(44): 1905-1917.
[7] 連傳運, 徐冰, 王秋平, 等. 中藥質(zhì)量源于設計應用:工藝控制策略[J]. 世界中醫(yī)藥, 2018,13(3): 561-565.
[8] ICH. Pharmaceutical development Q8(R2)[EB/OL]. Geneva: ICH, (2009-08-01)[2018-08-01]. http:// www. ich. org /fileadmin/Public WebSite/ICH_Products/Guidelines/Quality/Q8_R1/Step4/Q8_R2_Guideline.pdf.
[9] 王曉偉, 王艷偉, 劉亞楠, 等. 基于質(zhì)量源于設計理念的上市冰硼散質(zhì)量評價研究[J]. 中南藥學, 2019,17(11):1898-1902.
[10] 王永潔, 陳檉, 鄧莉莉, 等. 基于質(zhì)量源于設計理念的紅花顆粒制備工藝及物理指紋圖譜研究[J]. 中草藥,2019,50(17): 132-139.
[11] 韓天燕. 基于質(zhì)量源于設計理念的仙曲片薄膜包衣工藝研究[J]. 中草藥, 2018,49(11): 2564-2570.
[12] 萬丹, 張水寒, 肖娟, 等. Box-Behnken 設計-效應面法優(yōu)選酒黃連炮制工藝[J]. 藥物評價研究, 2014,37(4):341-345.
[13] 江敏瑜, 閆丹, 陳嬌, 等. 三七跌打軟膏的制備及體外透皮特性研究[J]. 中草藥, 2017,48(22): 4639-4647.
[14] 黃蕓, 謝俊, 楊俊, 等. 基于QbD 理念的鹽酸坦索羅辛緩釋膠囊的處方工藝研究[J]. 藥學與臨床研究,2018,26(1): 9-13.
[15] 方亮. 藥劑學:第8 版[M]. 北京:人民衛(wèi)生出版社, 2016.
[16] 姜希偉, 費云揚, 連桂玉, 等. 基于QbD 理念的茶堿凝膠骨架緩釋片處方工藝設計與優(yōu)化[J]. 中國藥房,2019,30(18): 2502-2507.
[17] 蔣煜, 楊建紅, 王亞敏. “質(zhì)量源于設計”在仿制注射劑處方工藝研究中的應用[J]. 中國新藥雜志, 2014,23(8): 921-924,954.
[18] 陽長明, 王建新. 論中藥復方制劑質(zhì)量源于設計[J]. 中國醫(yī)藥工業(yè)雜志, 2016,47(9): 1211-1215.
[19] 鄭金鳳, 杜佩佩, 閆紅波, 等. 丹參多組分滲透泵片的制備及體外釋放度的考察[J]. 北京中醫(yī)藥大學學報,2012,35(6): 394-398.
[20] 王逸飛, 朱振宇, 吳志生, 等. QbD 理念的中藥緩控釋制劑的設計與研發(fā)研究[J]. 中國中藥雜志, 2019,44(20):4317-4321.
[21] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 019732[EB/OL]. [2020 -04-12] https://www.accessdata. fda.gov/drugsatfda_docs/label/2019/020517s042, 019732s044lbl.pdf.
[22] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 019732[EB/OL]. [2020-04-12] https://www.accessdata.fda.gov/drugsatfda_docs/nda/2005/019732_S029_Lupron%20Depot_APPROVAL%20PACKAGE.pdf .
[23] 安廣峰, 呂丕平. QbD 理念在微球制劑開發(fā)中的應用[J]. 上海醫(yī)藥, 2021,42(5): 77-81.
[24] ICH. Pharmaceutical Development Q8(R2) [EB/OL]. [2020-04-12]. https: //database.ich.org/sites/default/files/Q8_R2_Guideline.pdf.
[25] 張娟娟, 孫巍, 王萍, 等. 基于分析方法質(zhì)量源于設計(QbD)的復方丹參滴丸皂苷指紋圖譜開發(fā)方法初步研究[J]. 中草藥, 2017,48(19): 3992-3997.
[26] TECKEO J, MASCARO T,FARRELL T P, et al. Process optimization of a novel immediate release film coating system using QbD principles[J]. AAPS Pharm Sci Tech, 2013,14(2): 531-540.
[27] 張俊鴻, 何雁, 許燕, 等. 基于質(zhì)量源于設計理念的風咳顆粒噴霧干燥工藝研究[J]. 中草藥, 2017,48(10):2061-2066.
[28] 馮怡, 洪燕龍, 杜若飛, 等. QbD 理念的中藥新藥成型工藝研發(fā)模式的探討[J]. 中國中藥雜志, 2014,39(17):3404-3407.
[29] MAZUMDER S, PAVURALA N, MANDA P , et al. Quality by design approach for studying the impact of for mulationand process variables on product quality of oral disintegrating film[J]. Int J Pharm, 2017 ,527: 151-160.
[30] 張小飛, 邢傳峰, 果秋婷. 基于質(zhì)量源于設計(QbD)理念優(yōu)化穿心蓮內(nèi)酯固體脂質(zhì)納米粒[J]. 中草藥, 2015,46(2): 194-200.
[31] PATWARDHAN K, ASGARZADEH F, DASSINGER T, et al. A quality by design approach to understand formulationand process variability in pharmaceutical melt extrusion processes[J]. J Pharm Pharmacol, 2015,67(5): 673 -684.
[32] KOVACS S, BERKO E, CSANYI I, et al. Development of nanostructured lipid carriers containing salicyclic acid for dermal use based on the quality by design method[J]. Eur J Pharm Sci, 2017,99: 246-257.