摘 要 / Abstract
疫苗流通安全關(guān)系百姓接種安全�����,疫苗流通過程的質(zhì)量安全是決定達(dá)到接種單位的疫苗質(zhì)量安全的關(guān)鍵��,而追溯是對疫苗流通過程跟蹤和監(jiān)管的最佳手段��?!兑呙绻芾矸ā返谖鍡l和第十條對疫苗追溯進(jìn)行了明確規(guī)定,國家藥品監(jiān)督管理局疫苗追溯協(xié)同服務(wù)平臺已經(jīng)完成了上市許可持有人追溯數(shù)據(jù)和疾病預(yù)防控制機(jī)構(gòu)追溯數(shù)據(jù)的交換��,各級監(jiān)管部門也針對疫苗流通過程建立了以流向為核心的監(jiān)管系統(tǒng)��。目前的追溯是以流向為核心��,對流通過程的作業(yè)過程���、質(zhì)量控制等涉及不多,通過現(xiàn)有追溯體系實現(xiàn)對疫苗流通過程和質(zhì)量風(fēng)險的監(jiān)管還有所不足����。本文通過對疫苗流通全業(yè)務(wù)過程的分析,依托于國藥控股上海生物醫(yī)藥有限公司的疫苗業(yè)務(wù)����,探討了滿足疫苗特征的追溯數(shù)據(jù)驗證方法和在現(xiàn)有追溯數(shù)據(jù)基礎(chǔ)上對疫苗供應(yīng)鏈-物流作業(yè)過程��、質(zhì)量控制等方面的擴(kuò)展�����,有利于監(jiān)管部門在疫苗流向監(jiān)管的基礎(chǔ)上����,通過追溯數(shù)據(jù)以數(shù)字化方式實現(xiàn)對業(yè)務(wù)過程的規(guī)范性����、高質(zhì)量的監(jiān)管。
The safety of vaccine distribution is related to the safety of public vaccination.The quality and safety of the vaccine distribution process is the key to determining the quality and safety of vaccines reaching vaccination sites,and traceability is the best way to track and supervise the vaccine distribution process.Articles 5 and 10 of the Vaccine Administration Law clearly stipulate the traceability of vaccines.The vaccine traceability collaborative service platform of the National Medical Products Administration has completed the exchange between traceability data of marketing license holders and disease prevention and control institutions.The regulatory authorities at all levels have also established a regulatory system centered on the flow of vaccines for the distribution process.The current traceability is based on the flow direction,and there is not much involvement in the operation process and quality control of the distribution process.It is still insufficient to realize the supervision of the vaccine distribution process and quality risk through the existing traceability system.Based on the analysis of the whole process of vaccine distribution and relying on the vaccine business of Sinopharm Holding Shanghai Biopharmaceutical Co.,Ltd.,this paper discusses the traceability data verification method that meets the characteristics of vaccines and the expansion on vaccine supply chain-logistics operation process and quality control,etc.based on the existing traceability data.On the basis of the supervision of vaccine flow,the regulatory authorities can realize standardized and high-quality supervision of the business process in a digital way through traceability data.
疫苗屬于溫度敏感的生物藥品,其生產(chǎn)���、經(jīng)營受到相關(guān)法規(guī)的嚴(yán)格約束�����。疫苗從上市許可持有人到接種單位的流通過程涉及了上市許可持有人�����、各級疾控中心�����、接種單位和第三方物流服務(wù)商�。疫苗流通全程監(jiān)管既包括對疫苗流向的跟蹤,也包括對相關(guān)業(yè)務(wù)機(jī)構(gòu)圍繞疫苗業(yè)務(wù)的合規(guī)性和疫苗流通過程質(zhì)量的監(jiān)管。本文對疫苗流通全程業(yè)務(wù)場景和追溯場景進(jìn)行了分析,針對疫苗流通全程業(yè)務(wù)的監(jiān)管場景,提出了疫苗追溯數(shù)據(jù)的驗證思路,探討了追溯數(shù)據(jù)在業(yè)務(wù)環(huán)節(jié)的擴(kuò)展實現(xiàn)方式���。
1�����、疫苗流通全業(yè)務(wù)流程簡介
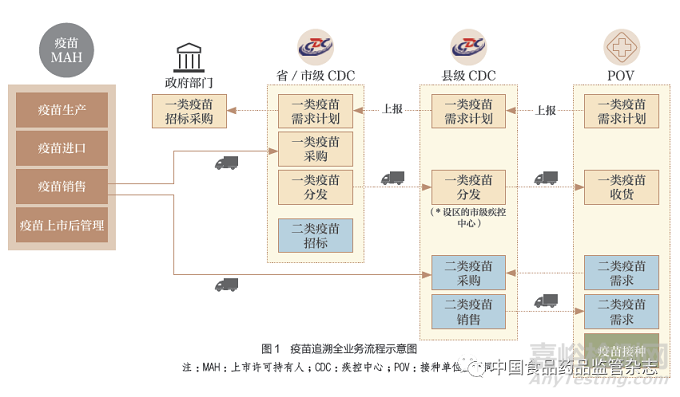
疫苗由上市許可持有人在中標(biāo)后,向疾控中心進(jìn)行銷售,再由疾控中心向接種單位進(jìn)行疫苗銷售或分發(fā),最后在接種單位完成向接種者的接種使用����。整個疫苗流通過程涉及政府相關(guān)管理部門(組織招標(biāo)和進(jìn)行監(jiān)管)�、上市許可持有人、各級疾控中心�����、接種單位以及第三方物流服務(wù)商(圖1)�����。
2����、疫苗流通全程監(jiān)管的法規(guī)要求
疫苗流通過程相關(guān)的法規(guī)和標(biāo)準(zhǔn)包括《疫苗管理法》[1]、《疫苗流通和預(yù)防接種管理條例》[2]�����、《疫苗儲存和運輸管理規(guī)范》[3]�、《新冠病毒疫苗貨物道路運輸技術(shù)指南》[4]、《疫苗生產(chǎn)流通管理規(guī)定》[5]���、DB31/T 1206—2020《疫苗冷鏈物流運作規(guī)范》[6]�。
2.1 疫苗流通全程監(jiān)管的目標(biāo)
疫苗由疫苗上市許可持有人向疾病預(yù)防控制機(jī)構(gòu)供應(yīng),再由疾病預(yù)防控制機(jī)構(gòu)向接種單位供應(yīng),這一供應(yīng)鏈單向不可逆���。
疫苗流通全程監(jiān)管的主要目標(biāo)是:①確保疫苗流通業(yè)務(wù)合規(guī)��。依據(jù)相關(guān)法規(guī)要求上市許可持有人/疾控中心在疫苗購銷����、退貨����、接種、召回等業(yè)務(wù)過程中合規(guī)且可以被追溯���。②業(yè)務(wù)風(fēng)險監(jiān)測和告警�����。對疫苗業(yè)務(wù)過程中的業(yè)務(wù)風(fēng)險進(jìn)行監(jiān)測,及時發(fā)現(xiàn)業(yè)務(wù)風(fēng)險和冷鏈質(zhì)量風(fēng)險,跟蹤風(fēng)險的處置情況,通過監(jiān)管手段規(guī)避接種風(fēng)險的發(fā)生��。③疫苗流通全程的冷鏈質(zhì)量安全�。通過對疫苗存儲運輸過程的冷鏈監(jiān)控,保障疫苗流通過程中冷鏈質(zhì)量安全。
2.2 疫苗流通全程監(jiān)管的主要內(nèi)容
按照《疫苗管理法》的規(guī)定,疫苗流通全程監(jiān)管的主要內(nèi)容包括以下5個方面�����。
2.2.1 批簽發(fā)制度的落實
國家實行疫苗批簽發(fā)制度����;疫苗上市許可持有人在銷售疫苗時,應(yīng)當(dāng)提供加蓋其印章的批簽發(fā)證明復(fù)印件或者電子文件;疾病預(yù)防控制機(jī)構(gòu)�����、接種單位在接收或者購進(jìn)疫苗時,應(yīng)當(dāng)索取前款規(guī)定的證明文件,并保存至疫苗有效期滿后不少于五年備查���。
2.2.2 疫苗采購和銷售業(yè)務(wù)過程監(jiān)管
疫苗上市許可持有人應(yīng)當(dāng)按照采購合同約定,向疾病預(yù)防控制機(jī)構(gòu)供應(yīng)疫苗。疾病預(yù)防控制機(jī)構(gòu)以外的單位和個人不得向接種單位供應(yīng)疫苗����。
2.2.3 疫苗儲存和運輸冷鏈質(zhì)量監(jiān)管
疫苗在儲存��、運輸全過程中應(yīng)當(dāng)處于規(guī)定的溫度環(huán)境,冷鏈儲存����、運輸應(yīng)當(dāng)符合要求,并定時監(jiān)測�����、記錄溫度�����。疾病預(yù)防控制機(jī)構(gòu)��、接種單位接收或者購進(jìn)疫苗時,應(yīng)當(dāng)索取本次運輸�����、儲存全過程溫度監(jiān)測記錄,并保存至疫苗有效期滿后不少于五年備查�。
2.2.4 疫苗購銷記錄檢查
建立真實、準(zhǔn)確��、完整的接收����、購進(jìn)�、儲存����、配送、供應(yīng)記錄,并保存至疫苗有效期滿后不少于五年備查��。
2.2.5 疫苗生命周期質(zhì)量管理檢查
疫苗上市許可持有人應(yīng)當(dāng)建立健全疫苗全生命周期質(zhì)量管理體系,制定并實施疫苗上市后風(fēng)險管理計劃,開展疫苗上市后研究,對疫苗的安全性���、有效性和質(zhì)量可控性進(jìn)行進(jìn)一步確證�。
3�、國內(nèi)通過追溯監(jiān)管疫苗流通的應(yīng)用情況
3.1 現(xiàn)有追溯體系下的疫苗流通過程追溯數(shù)據(jù)
《疫苗管理法》第十條規(guī)定:“國家實行疫苗全程電子追溯制度。國務(wù)院藥品監(jiān)督管理部門會同國務(wù)院衛(wèi)生健康主管部門制定統(tǒng)一的疫苗追溯標(biāo)準(zhǔn)和規(guī)范,建立全國疫苗電子追溯協(xié)同平臺,整合疫苗生產(chǎn)��、流通和預(yù)防接種全過程追溯信息,實現(xiàn)疫苗可追溯��。疫苗上市許可持有人應(yīng)當(dāng)建立疫苗電子追溯系統(tǒng),與全國疫苗電子追溯協(xié)同平臺相銜接,實現(xiàn)生產(chǎn)�、流通和預(yù)防接種全過程最小包裝單位疫苗可追溯、可核查����。疾病預(yù)防控制機(jī)構(gòu)、接種單位應(yīng)當(dāng)依法如實記錄疫苗流通、預(yù)防接種等情況,并按照規(guī)定向全國疫苗電子追溯協(xié)同平臺提供追溯信息��。”
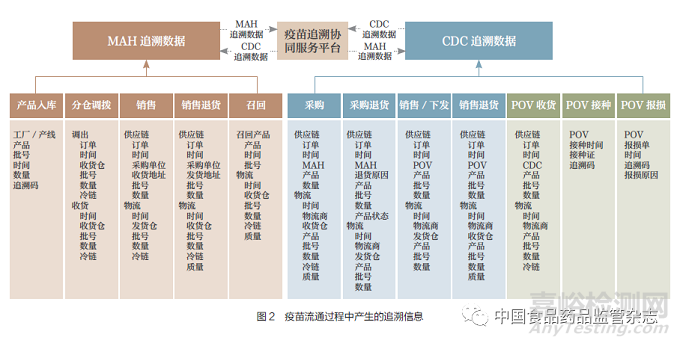
疫苗全業(yè)務(wù)流程中生成追溯數(shù)據(jù)的業(yè)務(wù)場景如圖2所示�����。
疫苗流通過程的追溯數(shù)據(jù)按數(shù)據(jù)生成的主體分為上市許可持有人追溯信息和疾病預(yù)防控制機(jī)構(gòu)追溯信息����。
上市許可持有人追溯信息是指上市許可持有人(包括委托的第三方物流機(jī)構(gòu))在業(yè)務(wù)過程中產(chǎn)生的追溯數(shù)據(jù)�����。主要包括:①疫苗產(chǎn)品生產(chǎn)入庫的追溯信息���。②多個倉庫之間疫苗調(diào)撥時的調(diào)撥出庫����、入庫追溯信息��。③疫苗銷售和銷售退貨時的追溯信息����。④疫苗召回產(chǎn)生的退貨追溯信息。
疾病預(yù)防控制機(jī)構(gòu)追溯信息是指疾病預(yù)防控制機(jī)構(gòu)和接種單位在疫苗購進(jìn)、接收��、銷售(二類疫苗)和分發(fā)(一類疫苗)��、退貨�����、報損����、接種疫苗產(chǎn)生的追溯信息。主要包括:①疫苗購進(jìn)��、入庫追溯信息���。②疫苗銷售�����、分發(fā)和接種單位接收追溯信息���。③疫苗退貨、報損追溯信息���。④疫苗接種追溯信息�����。
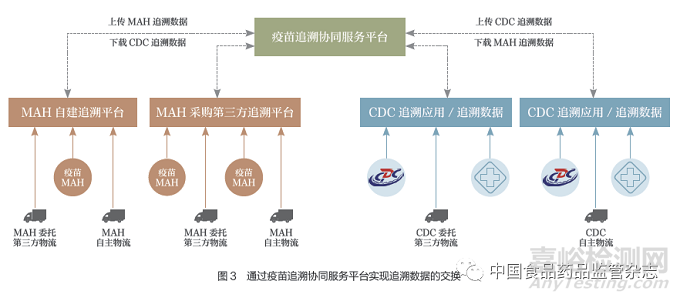
3.2 通過疫苗追溯協(xié)同服務(wù)平臺實現(xiàn)追溯數(shù)據(jù)的交換
疫苗上市許可持有人和疾病預(yù)防控制機(jī)構(gòu)向國家藥品監(jiān)督管理局疫苗追溯協(xié)同服務(wù)平臺上傳追溯數(shù)據(jù),通過疫苗追溯協(xié)同服務(wù)平臺完成追溯數(shù)據(jù)的交換(圖3)��。
3.3 通過追溯數(shù)據(jù)對疫苗流通全程進(jìn)行數(shù)字化監(jiān)管的可行性
疫苗流通全程涉及疫苗上市許可持有人(包括委托的第三方物流機(jī)構(gòu))��、疾病預(yù)防控制機(jī)構(gòu)(包括委托的第三方物流機(jī)構(gòu))和接種單位,分別有各自獨立的信息系統(tǒng)����。
疫苗追溯碼作為疫苗的身份代碼具有全流程唯一性,追溯數(shù)據(jù)的生成也是以追溯碼為關(guān)鍵字段,通過追溯信息可以有效完成對上市許可持有人業(yè)務(wù)流程和疾病預(yù)防控制機(jī)構(gòu)業(yè)務(wù)流程的串接����。因此,追溯數(shù)據(jù)具備對疫苗從上市許可持有人到接種單位的流通全程監(jiān)管的基礎(chǔ)。
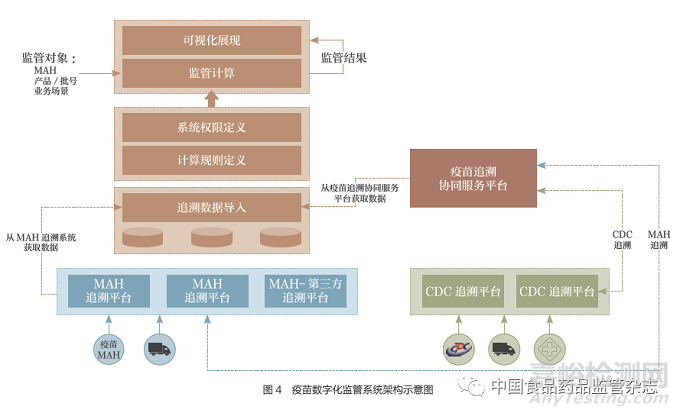
3.4 基于追溯數(shù)據(jù)的數(shù)字化監(jiān)管平臺設(shè)想
基于疫苗追溯數(shù)據(jù)的數(shù)字化監(jiān)管平臺的架構(gòu)如圖4所示��。
3.4.1 數(shù)據(jù)接入和存儲
從上市許可持有人追溯平臺��、疫苗追溯協(xié)同服務(wù)平臺獲取追溯數(shù)據(jù)��;對追溯數(shù)據(jù)按照規(guī)則進(jìn)行校驗和存儲,確保獲取數(shù)據(jù)的完整性��。
3.4.2 計算規(guī)則和權(quán)限定義
從疫苗采購�、銷售、庫存和有效期、疫苗退貨����、疫苗物流、疫苗接種等場景來定義追溯數(shù)據(jù)計算規(guī)則���;定義不同監(jiān)管部門�、不同監(jiān)管層次(省���、市��、縣)的監(jiān)管數(shù)據(jù)訪問權(quán)限���。
3.4.3 數(shù)據(jù)計算和展現(xiàn)
根據(jù)不同監(jiān)管場景算法,生成計算結(jié)果,進(jìn)行可視化展現(xiàn)。
3.5 現(xiàn)有追溯體系在疫苗流通全程監(jiān)管中的不足
目前國內(nèi)主要追溯系統(tǒng)同時面向包括疫苗在內(nèi)的全部藥品,以收集藥品流通過程的供應(yīng)鏈單據(jù)信息��、溫度信息等方式來產(chǎn)生追溯信息,并未針對疫苗的管理特性對追溯數(shù)據(jù)進(jìn)行嚴(yán)格的要求,主要存在以下不足之處:①對追溯數(shù)據(jù)缺乏嚴(yán)密的驗證規(guī)則,無法確保流通全業(yè)務(wù)流程中全部環(huán)節(jié)數(shù)據(jù)的完整性�、上報及時性和時序合理性。②追溯數(shù)據(jù)滿足疫苗流向的追溯,但不能完全滿足《疫苗管理法》等法規(guī)對疫苗業(yè)務(wù)規(guī)范性����、質(zhì)量和異常控制等管理要求��。
筆者針對上市許可持有人業(yè)務(wù)過程、疾病預(yù)防控制機(jī)構(gòu)疫苗采購和銷售過程�、疫苗接種過程和疫苗物流作業(yè)過程進(jìn)行了跟蹤,對比現(xiàn)有主要的追溯平臺數(shù)據(jù)采集/上傳要求,進(jìn)行了追溯數(shù)據(jù)校驗規(guī)則的設(shè)計和追溯信息在業(yè)務(wù)過程的內(nèi)容擴(kuò)展探索。
4��、疫苗流通追溯數(shù)據(jù)的校驗方式
追溯數(shù)據(jù)的完整性和合理性是實現(xiàn)對疫苗流通全程監(jiān)管的基礎(chǔ),因此從上市許可持有人追溯平臺或疫苗追溯協(xié)同服務(wù)平臺獲取追溯數(shù)據(jù),并導(dǎo)入到監(jiān)管平臺進(jìn)行數(shù)字化監(jiān)管,都需要對追溯數(shù)據(jù)進(jìn)行校驗,校驗的內(nèi)容主要包括以下幾個方面��。
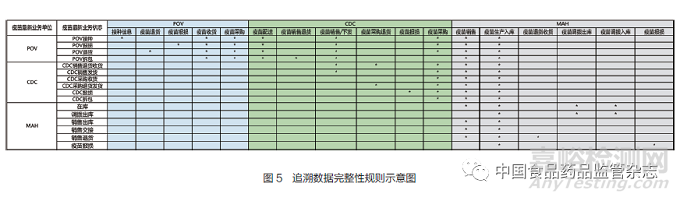
4.1 追溯數(shù)據(jù)完整性校驗
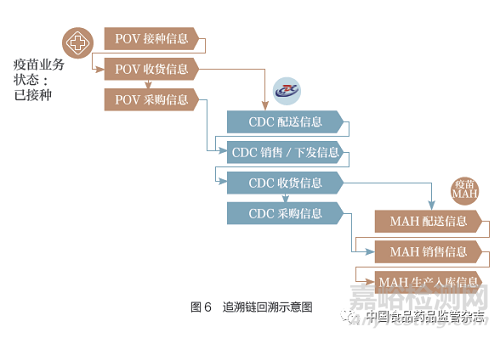
追溯數(shù)據(jù)完整性校驗是依據(jù)疫苗當(dāng)前狀態(tài)和當(dāng)前業(yè)務(wù)環(huán)節(jié),從追溯數(shù)據(jù)中對疫苗流通過程的追溯數(shù)據(jù)以數(shù)據(jù)鏈形式進(jìn)行回溯,檢查前序業(yè)務(wù)環(huán)節(jié)的追溯數(shù)據(jù)是否存在,并針對缺失的業(yè)務(wù)環(huán)節(jié)追溯數(shù)據(jù)進(jìn)行報警����。圖5是疫苗追溯數(shù)據(jù)完整性規(guī)則示例圖�。
對于接種單位接種的疫苗,以逆向回溯的完整追溯鏈應(yīng)該包括:①接種單位追溯數(shù)據(jù):接種單位接種信息→接種單位收貨信息→接種單位采購信息。②疾控中心追溯數(shù)據(jù):疾控中心配送信息→疾控中心銷售/下發(fā)信息→疾控中心收貨信息→疾控中心采購信息��。③上市許可持有人追溯數(shù)據(jù):上市許可持有人配送信息→上市許可持有人銷售信息→上市許可持有人生產(chǎn)入庫信息(圖6)���。
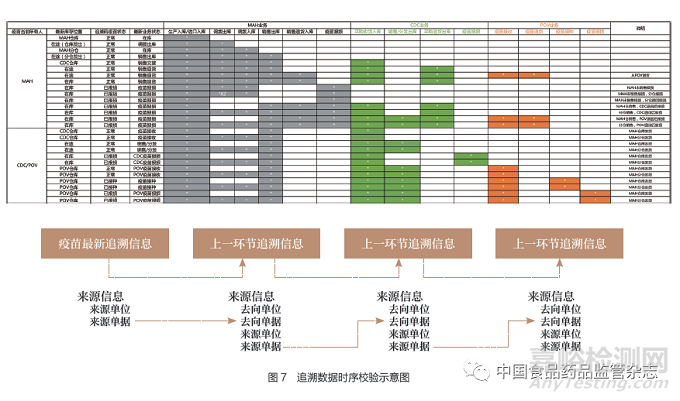
4.2 追溯數(shù)據(jù)時序校驗
由于疫苗追溯協(xié)同服務(wù)平臺主要扮演的角色是追溯數(shù)據(jù)在上市許可持有人和疾病預(yù)防控制機(jī)構(gòu)之間的交換,對上市許可持有人通過疫苗追溯協(xié)同服務(wù)平臺上傳和疾病預(yù)防控制機(jī)構(gòu)上傳的追溯數(shù)據(jù)的規(guī)范性尚未強(qiáng)制執(zhí)行,因此進(jìn)行追溯數(shù)據(jù)的分析需要對追溯數(shù)據(jù)鏈進(jìn)行校驗�����。圖7為追溯數(shù)據(jù)時序校驗示意圖����。
追溯數(shù)據(jù)的校驗以追溯碼中最新追溯數(shù)據(jù)為源頭進(jìn)行回溯,根據(jù)當(dāng)前追溯信息中的來源信息(來源單位��、來源單據(jù)、來源時間等)逆向查詢上一環(huán)節(jié)的追溯信息,直至最初的追溯數(shù)據(jù)源頭(生產(chǎn)入庫/進(jìn)口產(chǎn)品入庫)���。
4.3 按業(yè)務(wù)場景的數(shù)據(jù)完整性和重復(fù)性校驗
按照滿足業(yè)務(wù)監(jiān)管的需要,針對不同業(yè)務(wù)環(huán)節(jié)所產(chǎn)生的追溯數(shù)據(jù)的完整性進(jìn)行校驗,并按照業(yè)務(wù)環(huán)節(jié)對追溯數(shù)據(jù)進(jìn)行重復(fù)性檢查,確保用于監(jiān)管的追溯數(shù)據(jù)的純凈度���。
5、疫苗流通追溯信息的擴(kuò)展
目前疫苗追溯領(lǐng)域的核心數(shù)據(jù)標(biāo)準(zhǔn)為NMPAB/T 1004—2019《疫苗追溯基本數(shù)據(jù)集》[7],追溯信息的擴(kuò)展主要是在現(xiàn)有國家標(biāo)準(zhǔn)數(shù)據(jù)集的基礎(chǔ)上,以擴(kuò)展數(shù)據(jù)字段和增加輔助數(shù)據(jù)集的方式進(jìn)行擴(kuò)展,從而既可以滿足現(xiàn)有追溯平臺和疫苗追溯協(xié)同服務(wù)平臺數(shù)據(jù)的要求,又能針對性擴(kuò)展對業(yè)務(wù)過程監(jiān)管的內(nèi)容�。
5.1 現(xiàn)有追溯數(shù)據(jù)集構(gòu)成情況
NMPAB/T 1004—2019《疫苗追溯基本數(shù)據(jù)集》中將疫苗追溯基本數(shù)據(jù)集分為基礎(chǔ)信息數(shù)據(jù)子集和應(yīng)用信息數(shù)據(jù)子集2類。
5.1.1 基礎(chǔ)信息數(shù)據(jù)子集
①國產(chǎn)疫苗/進(jìn)口疫苗基本信息數(shù)據(jù)子集:國家藥品標(biāo)識碼����、通用名稱、商用名�、本位碼、劑型規(guī)格���、包裝�����、有效期��、批準(zhǔn)文號��、是否屬于國家免疫規(guī)劃疫苗����、生產(chǎn)企業(yè)、上市許可持有人等�。②生產(chǎn)企業(yè)/進(jìn)口疫苗代理企業(yè)基本信息數(shù)據(jù)子集:境內(nèi)疫苗生產(chǎn)企業(yè)(國產(chǎn)疫苗上市許可持有人)基本信息、境外疫苗生產(chǎn)企業(yè)基本信息����、進(jìn)口疫苗代理企業(yè)(進(jìn)口疫苗上市許可持有人)基本信息。③疾病預(yù)防控制機(jī)構(gòu)/接種單位基本信息數(shù)據(jù)子集:疾病預(yù)防控制機(jī)構(gòu)/接種單位名稱���、地址等�����。④疫苗配送單位(接收上市許可持有人或疾病預(yù)防控制機(jī)構(gòu)委托進(jìn)行疫苗倉儲和配送)基本信息數(shù)據(jù)子集:疫苗配送單位名稱、地址等��。⑤藥品生產(chǎn)許可證/藥品經(jīng)營許可證基本信息數(shù)據(jù)子集:許可證編號���、統(tǒng)一社會信用代碼��、企業(yè)名稱�、注冊地址����、法定代表人�、企業(yè)負(fù)責(zé)人����、有效期、發(fā)證機(jī)關(guān)等�����。
5.1.2 應(yīng)用信息數(shù)據(jù)子集
①生產(chǎn)信息數(shù)據(jù)子集:以疫苗最小銷售包裝(最小追溯碼賦碼單元)為計量標(biāo)準(zhǔn),記錄生產(chǎn)企業(yè)��、生產(chǎn)地址����、批號、生產(chǎn)數(shù)量�����、疫苗狀態(tài)等信息�。②進(jìn)口信息數(shù)據(jù)子集:以同批號進(jìn)口的疫苗最小銷售包裝為計量標(biāo)準(zhǔn),記錄進(jìn)口企業(yè)、生產(chǎn)企業(yè)����、進(jìn)口數(shù)量���、疫苗狀態(tài)等信息。③生產(chǎn)企業(yè)自檢信息數(shù)據(jù)子集:記錄疫苗的檢驗日期�、檢驗報告等信息。④批簽發(fā)信息數(shù)據(jù)子集:記錄疫苗的批號和批簽發(fā)信息�。⑤發(fā)貨單信息數(shù)據(jù)子集:記錄上市許可持有人或疾控中心的疫苗發(fā)貨信息,包括發(fā)貨單、發(fā)貨機(jī)構(gòu)����、發(fā)貨地址、收貨機(jī)構(gòu)���、收貨地址����、單據(jù)驗證狀態(tài)����、疫苗產(chǎn)品信息等���。⑥收貨單信息數(shù)據(jù)子集:記錄上市許可持有人或疾控中心�、接種單位的疫苗收貨信息,包括收貨單����、發(fā)貨機(jī)構(gòu)����、發(fā)貨地址�、收貨機(jī)構(gòu)、收貨地址���、收貨類型����、單據(jù)驗證狀態(tài)�����、疫苗產(chǎn)品信息(疫苗產(chǎn)品�、批號、應(yīng)收數(shù)量�����、實收數(shù)量)等��。⑦使用信息數(shù)據(jù)子集:接種單位接種疫苗時產(chǎn)生使用追溯數(shù)據(jù),包括接種單位、使用時間����、接種疫苗追溯碼等。⑧召回信息數(shù)據(jù)子集:疫苗召回時產(chǎn)生召回追溯數(shù)據(jù),包括召回機(jī)構(gòu)�����、開始和結(jié)束時間�、召回數(shù)量、召回疫苗追溯碼等�����。⑨溫度信息數(shù)據(jù)子集:記錄疫苗儲存�����、運輸過程中的溫度數(shù)據(jù),包括疫苗追溯碼����、溫度采集位置、溫度采集時間���、溫度數(shù)據(jù)等。⑩消費者查詢基本信息數(shù)據(jù)子集:藥品追溯碼、上市許可持有人�����、生產(chǎn)日期��、生產(chǎn)批號��、有效期����、劑型、規(guī)格等�。
5.2 追溯數(shù)據(jù)擴(kuò)展的方式
追溯數(shù)據(jù)將采取現(xiàn)有數(shù)據(jù)集字段擴(kuò)展和新增業(yè)務(wù)數(shù)據(jù)集方式來進(jìn)行擴(kuò)展,同時可以滿足現(xiàn)有疫苗追溯協(xié)同服務(wù)平臺數(shù)據(jù)上傳需求和擴(kuò)展后追溯系統(tǒng)及追溯應(yīng)用的需求。
5.3 追溯數(shù)據(jù)的擴(kuò)展內(nèi)容
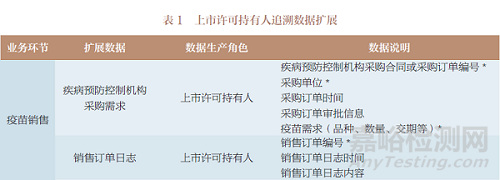
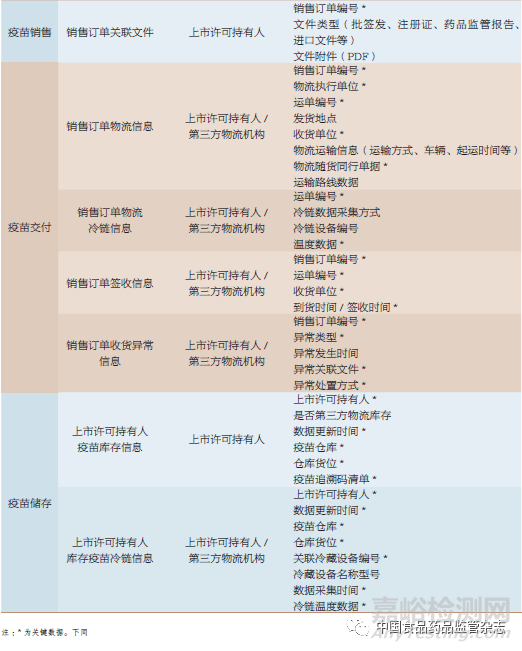
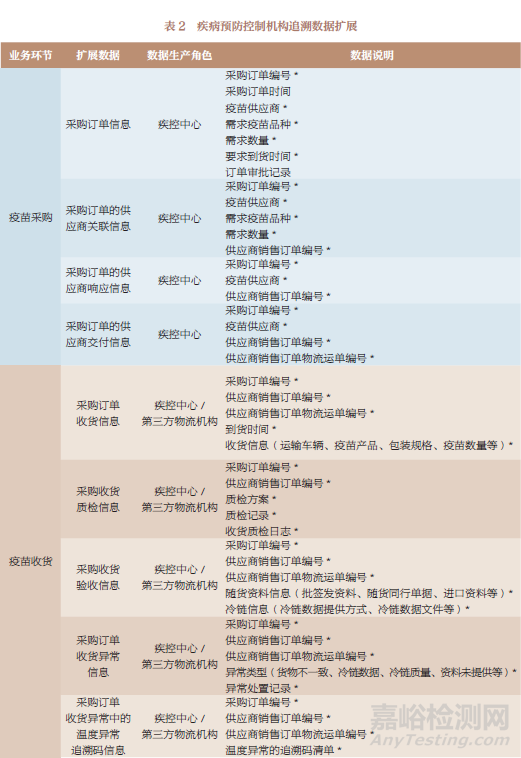
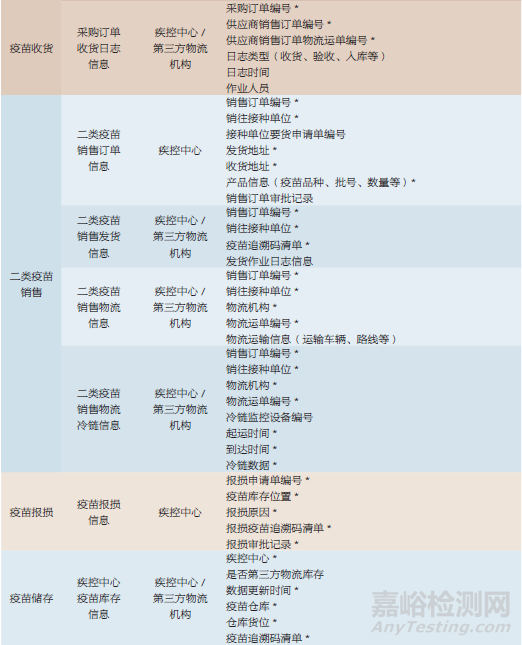
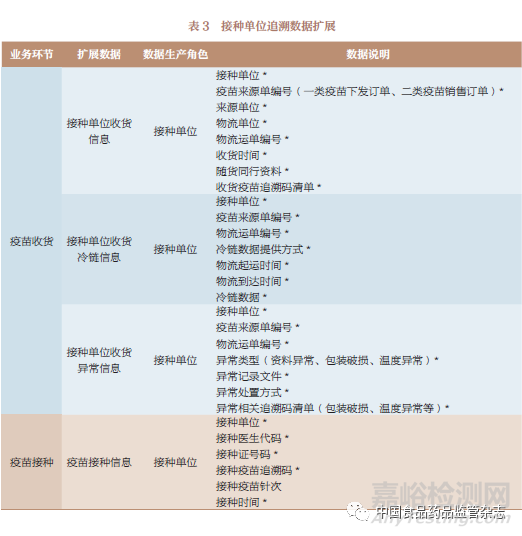
追溯數(shù)據(jù)按其產(chǎn)生主體(上市許可持有人和疾病預(yù)防控制機(jī)構(gòu))的業(yè)務(wù)場景進(jìn)行擴(kuò)展,表1~表3是追溯數(shù)據(jù)擴(kuò)展的部分示例��。

5.4 疫苗業(yè)務(wù)狀態(tài)數(shù)據(jù)擴(kuò)展
NMPAB/T 1004—2019《疫苗追溯基本數(shù)據(jù)集》中對疫苗生產(chǎn)流通使用過程中對應(yīng)疫苗所處的狀況定義如下:已自檢�����、已批簽��、已過期���、已損壞���、已銷毀����、召回中��、已召回����、已使用、已停用�、其他,共10種類型。
考慮到疫苗在流通過程中如果追溯平臺能通過追溯碼的應(yīng)用場景為業(yè)務(wù)操作提供驗證����、控制等服務(wù),同時結(jié)合冷鏈質(zhì)量過程,可以考慮增加:①“正常”狀態(tài):上市許可持有人在疫苗生產(chǎn)/進(jìn)口完成批簽,質(zhì)檢合格后入庫時的狀態(tài)。“正常”狀態(tài)下可以直接采購�、銷售或接種。②鎖定狀態(tài),包括“待定����、待召回、異常”3種狀態(tài)類型:在流通過程中因冷鏈���、待召回����、流通所需資料不完整等原因?qū)е乱呙鐣簳r不能流通和接種時,疫苗處于鎖定狀態(tài)��。“待定”狀態(tài)需針對疫苗質(zhì)量狀態(tài)進(jìn)行判定,可以調(diào)整為“正常”“待召回”“異常”�����;“異常”狀態(tài)的疫苗只能退貨或退貨后進(jìn)行銷毀,處于“異常”狀態(tài)的疫苗需要提供異常原因��;“待召回”狀態(tài)的疫苗將由上市許可持有人進(jìn)行召回后處理����。
5.5 供應(yīng)鏈業(yè)務(wù)相關(guān)的證明文件擴(kuò)展
《疫苗管理法》第三十八條規(guī)定:“疫苗上市許可持有人在銷售疫苗時,應(yīng)當(dāng)提供加蓋其印章的批簽發(fā)證明復(fù)印件或者電子文件;銷售進(jìn)口疫苗的,還應(yīng)當(dāng)提供加蓋其印章的進(jìn)口藥品通關(guān)單復(fù)印件或者電子文件��。疾病預(yù)防控制機(jī)構(gòu)����、接種單位在接收或者購進(jìn)疫苗時,應(yīng)當(dāng)索取前款規(guī)定的證明文件,并保存至疫苗有效期滿后不少于五年備查。”
NMPAB/T 1004—2019《疫苗追溯基本數(shù)據(jù)集》僅僅在發(fā)貨單/收貨單中記錄了單據(jù)驗證狀態(tài)��、單據(jù)驗證日期和未通過驗證原因�。
追溯數(shù)據(jù)中證明文件的擴(kuò)展包括證明文件類型、證明文件提供方式����、證明文件編號�����、證明文件電子版/掃描版附件內(nèi)容���。
6、追溯驗證和追溯數(shù)據(jù)擴(kuò)展在生產(chǎn)中的應(yīng)用
國藥控股上海生物醫(yī)藥有限公司作為疫苗領(lǐng)域的供應(yīng)鏈-物流服務(wù)商,自主研發(fā)的“全溯”系統(tǒng)在遵照《疫苗追溯基本數(shù)據(jù)集》標(biāo)準(zhǔn)的同時,對追溯數(shù)據(jù)進(jìn)行了擴(kuò)展,并在疫苗供應(yīng)鏈業(yè)務(wù)過程�����、物流作業(yè)過程和疫苗接種時進(jìn)行追溯數(shù)據(jù)驗證,初步驗證了追溯數(shù)據(jù)擴(kuò)展和驗證在實際業(yè)務(wù)操作中的可行性,取得了良好的應(yīng)用效果,主要應(yīng)用場景如下�。
6.1 疫苗流通全程驗證場景
在物流收貨、發(fā)貨和接種單位接收疫苗時,通過追溯數(shù)據(jù)對疫苗來源單位����、供應(yīng)鏈業(yè)務(wù)單據(jù)和追溯碼、冷鏈質(zhì)量等進(jìn)行驗證,并通過驗證服務(wù)實現(xiàn)對疫苗流向的報警和控制����。
6.2 接種時的掃碼驗證場景
在疫苗接種時通過掃描追溯碼進(jìn)行追溯數(shù)據(jù)驗證,檢查待接種疫苗的當(dāng)前狀態(tài)、合法來源���、有效期��、流通過程是否冷鏈異常��、是否被標(biāo)注為異常疫苗等,確保驗證通過的疫苗才能被接種使用��。
6.3 異常疫苗鎖定場景
基于疫苗批號和追溯碼對異常疫苗進(jìn)行標(biāo)注,并調(diào)整疫苗狀態(tài)為“待定”“待召回”“異常”,上傳標(biāo)注相關(guān)的原因����、質(zhì)量資料(如異常的溫度數(shù)據(jù)),通過追溯平臺的驗證服務(wù)實現(xiàn)對異常疫苗的鎖定�����。
6.4 通過追溯碼跟蹤業(yè)務(wù)操作過程和質(zhì)量的場景
擴(kuò)展追溯信息到供應(yīng)鏈-物流業(yè)務(wù)信息和作業(yè)信息,通過掃描追溯碼實現(xiàn)追溯數(shù)據(jù)關(guān)聯(lián)供應(yīng)鏈訂單信息和物流作業(yè)信息及冷鏈配送信息,實現(xiàn)通過追溯碼跟蹤業(yè)務(wù)作業(yè)過程和冷鏈質(zhì)量���。
7�、結(jié) 語
本文結(jié)合疫苗流通實際業(yè)務(wù)場景,提出了一種驗證疫苗追溯數(shù)據(jù)完整性和數(shù)據(jù)合理性的方法,對疫苗追溯數(shù)據(jù)從業(yè)務(wù)操作過程和關(guān)聯(lián)信息角度進(jìn)行了擴(kuò)展,既實現(xiàn)了通過追溯數(shù)據(jù)對業(yè)務(wù)作業(yè)過程的記錄和再現(xiàn),又確保了追溯數(shù)據(jù)的完整性和合理性,無論是通過追溯實現(xiàn)疫苗全流程上下游的數(shù)字化協(xié)作,還是通過追溯實現(xiàn)業(yè)務(wù)合規(guī)性監(jiān)管都具備可操作性和較強(qiáng)的現(xiàn)實意義�。