近日��,國外某團隊總結(jié)了基于HA水凝膠作為傷口敷料的研究進展�,并比較了三種不同導(dǎo)電材料加入水凝膠后對于傷口愈合的效果�。同時也對未來用于人體健康監(jiān)測的水凝膠進行了探究�。
本文介紹了基于透明質(zhì)酸設(shè)計的具有導(dǎo)電性質(zhì)和相互作用的水凝膠作為傷口敷料的最先進的研究,這些水凝膠通過電刺激 (ES) 或通過結(jié)合其他多功能材料來增強皮膚組織再生�。研究團隊也對未來的交互式水凝膠進行了探究。
介紹
最近相關(guān)技術(shù)的快速發(fā)展為利用基于水凝膠的系統(tǒng)作為可植入生物醫(yī)學(xué)設(shè)備��,即生物電子學(xué)打開了大門����。事實上,導(dǎo)電水凝膠是材料工程應(yīng)用于生物醫(yī)學(xué)的主要軟材料��,其設(shè)計結(jié)合了先進的特性�,使其成為促進對電信號敏感的組織,如心臟��、皮膚和神經(jīng)組織再生的理想手段��。不僅如此,多功能性的整合和長期性能為組織修復(fù)方面的長期臨床應(yīng)用帶來了有希望的機會��,但尚未實現(xiàn)��。
皮膚是人體最大����、暴露最多的器官,重量約4.5kg��,厚度在0.5 ~ 4 mm之間����。它對電信號敏感,因此是使用導(dǎo)電功能材料進行電刺激的明顯靶點����。皮膚結(jié)構(gòu)由幾層(即表皮、真皮和皮下)組成����,包括廣泛的元素(細胞、細胞外基質(zhì)��、膠原纖維��、神經(jīng)�、血管、皮下腺體��、脂肪組織��、毛發(fā)和指甲等)�,其主要功能是作為機械力、紫外線�、溫度等的屏障保護身體免受外界環(huán)境的影響,也是我們在病原體面前的免疫防御的第一道防線����。然而,盡管如此����,皮膚也是一種極其脆弱的組織,會受到衰老�、外傷、外科手術(shù)或燒傷等疾病以及腿部靜脈潰瘍等疾病的影響����。
在過去的50年里,對幾個領(lǐng)域(例如皮膚細胞生物學(xué)��、聚合物支架或組織再生)的研究已經(jīng)產(chǎn)生了用于皮膚組織工程的商業(yè)醫(yī)療產(chǎn)品。更具體地說��,利用水凝膠特有的優(yōu)勢特性:親水性�、類似軟組織的含水量、足夠的生物相容性和柔韌性�,已在近年來開發(fā)出了一系列用于治療皮膚傷口的軟敷料?�?傮w而言��,如果經(jīng)過充分設(shè)計��,水凝膠是能夠滿足額外要求和最近高度先進的生物技術(shù)特征的優(yōu)秀候選材料�。
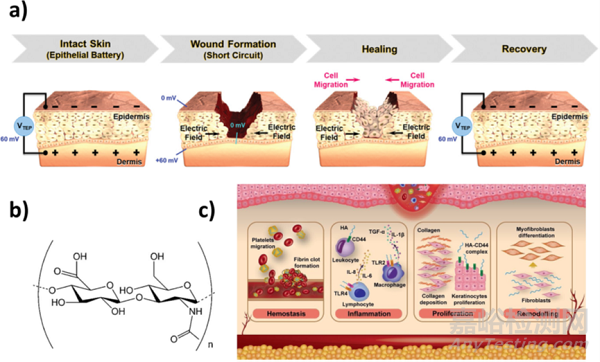
圖 皮膚修復(fù):透明質(zhì)酸水凝膠和電刺激:(a) 愈合過程前后傷口部位的跨上皮電位和電場。(b) HA 的分子結(jié)構(gòu)和 (c) HA在傷口愈合過程中主要作用的說明��。
皮膚修復(fù):透明質(zhì)酸水凝膠和電刺激
雖然傷口愈合和皮膚修復(fù)是復(fù)雜而緩慢的過程��,包括四個相互作用的階段(即止血��、炎癥��、增殖和重塑)��,但大多數(shù)皮膚缺損在 2 周內(nèi)就會有效愈合�。然而����,更嚴重的皮膚損傷�,包括急性(超過 8-12 周的愈合期)或慢性傷口(數(shù)月)�,可能需要更長的時間。例如�,糖尿病足潰瘍等廣泛的全層皮膚傷口是難以愈合的慢性病�,易受細菌感染和局部炎癥的影響�,最終對患者的健康產(chǎn)生嚴重的負面影響并引發(fā)相關(guān)費用�。因此當(dāng)前開發(fā)具有成本效益的傷口護理療法的迫切需求����。
1�、電刺激和皮膚修復(fù)
早在2013年�,G. Thakral等人在進行了21項隨機臨床試驗后得出結(jié)論�,電刺激(ES)可以加速傷口愈合且不良反應(yīng)少。幾年后��,Rajendran等人也得出了類似的結(jié)論����。事實上����,傷口愈合過程涉及電場����,電場作為細胞定向遷移的覆蓋指導(dǎo)信號,因此電活性支架被設(shè)計為最大限度地實現(xiàn)皮膚組織工程(圖1a)�。與清創(chuàng)�、負壓治療�����、皮瓣修復(fù)等技術(shù)相比�����,以ES為基礎(chǔ)的治療方法在加速創(chuàng)面閉合的同時顯示出高效�����、低成本和安全性�����。事實上�����,對于去除不存活的創(chuàng)面組織(即清創(chuàng)),手術(shù)方法是應(yīng)用最廣泛的���,這需要熟練的從業(yè)者和局部麻醉�����,也需要皮瓣手術(shù)的條件。關(guān)于負壓療法���,其確切作用機制尚不清楚,也沒有收集到足夠的數(shù)據(jù)支持其普遍應(yīng)用�����。
例如,Y. Wang和他的同事已經(jīng)用糖尿病大鼠進行了體內(nèi)ES實驗�,當(dāng)導(dǎo)電支架被用作傷口敷料時�,傷口愈合速度會更快�。在另一個例子中�����,用銀納米線和甲基丙烯酸海藻酸鹽制備了一種柔性電貼片(ePatch)�����,體外和體內(nèi)ES研究均顯示出良好的結(jié)果�����。進一步考慮電源的技術(shù)要求和治療的限制(時間和地點),最近設(shè)計了一種一體化自供電的電子刺激傷口敷料�,其中透明質(zhì)酸鈉作為活性物質(zhì)可加速電刺激下的傷口愈合���。此外���,利用天然生物基單體���,將吡咯���、明膠和海藻酸鹽結(jié)合���,制備出一種可3d打印的水凝膠���,用于電刺激輔助組織工程。
2�����、HA在傷口愈合中的作用
透明質(zhì)酸 (HA) 是一種天然線性陰離子多糖(圖 1b)�����,是 ECM 的主要成分�����,在人體中廣泛分布�����。本文團隊發(fā)現(xiàn) HA 被是組織再生過程中的關(guān)鍵參與者之一���,并且是一種電調(diào)節(jié)介質(zhì)�����。具體而言,HA 可增強膠原沉積���、上皮形成和傷口血管形成(圖 1c)���。在增殖階段,HA促進成纖維細胞和角質(zhì)形成細胞的遷移和增殖���。此外���,HA的吸水能力在不具有抗原性的情況下維持了創(chuàng)面的水分。這種生物功能導(dǎo)致相對于其他材料具有獨特特征���,從而有利地加速傷口愈合���。然而�,作為一個缺點,HA 本身不會形成水凝膠���,而是需要化學(xué)功能化來引入交聯(lián)位點�����。
盡管如此�����,由于HA的特異點 (包括生物相容性、生物降解性�、天然生物功能、親水性和非免疫反應(yīng)性)�,基于HA的水凝膠最近還是引起了廣泛關(guān)注���。
鑒于此�,本文綜述了近年來在皮膚組織工程領(lǐng)域制備HA電響應(yīng)性水凝膠的研究進展。據(jù)作者所知�����,盡管最近的一些綜述顯示了類似的范圍,但沒有一篇綜述關(guān)注HA作為一種多面多糖的相關(guān)性�。因此���,本文的目標是首先研究 HA 水凝膠如何通過利用多個導(dǎo)電部分而具有電活性來填補這一空白�����。然后�����,突出顯示已準備好處理皮膚再生復(fù)雜性的選定多功能系統(tǒng)���;最后���,討論了交互性�,這是該研究方向的未來方向���。綜上所述,本文總結(jié)了HA和ES聯(lián)合應(yīng)用治療皮膚創(chuàng)傷的重要研究進展�����。
使HA水凝膠具有電活性
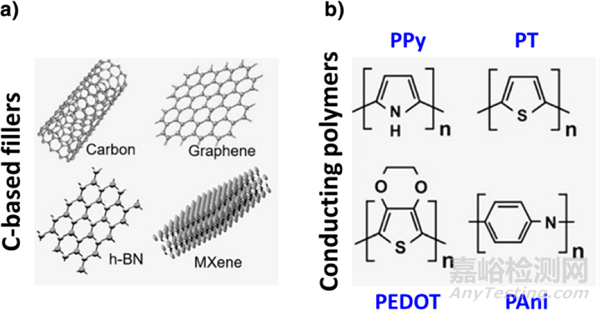
一般來說�,導(dǎo)電水凝膠主要通過在配方中使用各種導(dǎo)電材料來實現(xiàn),如金屬/金屬氧化物納米顆粒(NPs�;例如 Au���、Ag���、Pt、FeO 和 ZnO)�、碳基部分(例如石墨烯�、氧化石墨烯�、碳納米管和納米線)和導(dǎo)電聚合物(CPs;例如聚吡咯 (PPy)�����,聚苯胺(PAni)���、聚噻吩(PT)�����、聚(3,4-乙烯二氧噻吩(PEDOT)等)(圖2)�����。此外�����,向讀者展示多功能導(dǎo)電HA基水凝膠的多功能性和應(yīng)用范圍���,表 1 總結(jié)了以下部分中描述的選定作品。
圖 使水凝膠具有電活性的導(dǎo)電材料:(a)碳基部分和(b)導(dǎo)電聚合物
表 本綜述中描述的多功能導(dǎo)電ha基水凝膠在皮膚護理中的通用性和應(yīng)用范圍
1�����、含金屬/金屬氧化物納米粒子
為了在 HA 水凝膠中構(gòu)建具有金屬納米顆粒的 0D 性質(zhì)的滲透網(wǎng)絡(luò)這一項具有挑戰(zhàn)性的任務(wù),Shin等人利用微流控通道和油包水液滴形成�,制備了基于甲基丙烯酸酯和倍醇化合物修飾的透明質(zhì)酸的微凝膠(MeHA-Ga)。Shin等人的新方法提出了一種可用于多種應(yīng)用的通用系統(tǒng)���,如3D打印和電活性組織傳導(dǎo)���,該系統(tǒng)可提高細胞活力�����,并可控制電導(dǎo)率�����。類似地���,盡管選擇的生物聚合物是陽離子瓜爾膠�,但最近也用同樣的方法在聚多巴胺(PDA)納米粒子上合成了銀納米粒子,這些納米粒子隨后被包裹在水凝膠網(wǎng)絡(luò)中以促進傷口愈合。
在糖尿病慢性傷口處理的背景下�,鉑金合金納米顆粒被嵌入一種自愈合水凝膠敷料中,這種敷料是通過氧化透明質(zhì)酸和羧甲基殼聚糖的席夫堿反應(yīng)合成的�。然而���,這些納米粒子的主要作用是引入相關(guān)的生物功能,如降低血糖���,減輕活性氧(ROS)的氧化損傷,以及通過模擬葡萄糖氧化酶和過氧化氫酶提供氧氣�����。
氧化鋅(ZnO)也被包括在傷口敷料的配方中���,因為它可以模擬某些生長因子的作用�����,盡管確切的傷口愈合機制需要進一步研究�,但其同時顯示出抗炎和抗菌作用�。事實上�,ZnO NP/肉桂精油混合物已經(jīng)作為抗菌愈合促進劑添加到基于HA的傷口治療納米纖維支架中���?����;谶@一目標�,本文團隊將鋅有機框架(Zn- mof)添加到基于甲基丙烯酸酯HA的可降解微針(MeHA)中���,通過紫外線(UV)交聯(lián)制備出具有抗菌活性的微針�����。盡管沒有導(dǎo)電性能,但在傷口部位實現(xiàn)了金屬陽離子(Zn2+)的連續(xù)和穩(wěn)定的釋放�,促進愈合,幾乎沒有二次損傷�。
2、采用碳基材料
碳基填料具有良好的導(dǎo)電性和機械強度���,是將水凝膠轉(zhuǎn)化為導(dǎo)電網(wǎng)絡(luò)的理想材料�。在將其用于生物技術(shù)目的時�����,需要考慮其有限的整合/可有可無性以及其細胞毒性。
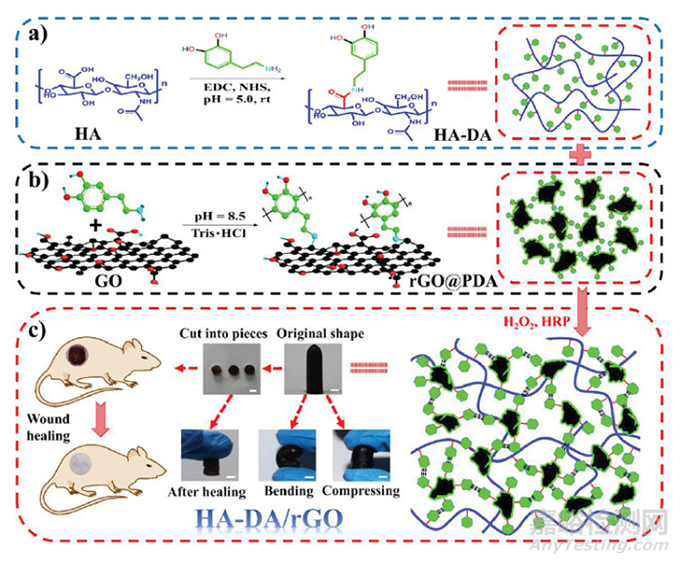
例如�,Liang等人利用H2O2/HPR(辣根過氧化物酶)系統(tǒng),開發(fā)了基于 HA 接枝多巴胺和還原氧化石墨烯 (rGO)用于傷口愈合的可注射納米復(fù)合導(dǎo)電水凝膠敷料�����。(圖3)除了高溶脹性���、可降解性和可調(diào)節(jié)的流變學(xué)性能外�,PDA的存在還誘導(dǎo)了抗氧化活性和組織黏附性�,以及止血和自愈合能力?����?傊?��,多功能系統(tǒng)作為一個具有光熱抗菌活性的藥物緩釋平臺���。氧化石墨烯(GO)也作為導(dǎo)電填料被負載在天然聚合物網(wǎng)絡(luò)中。此外���,它還被用作一種載體���,用于分散和穩(wěn)定基于明膠�����、PVA和HA的局部水凝膠中的銀納米顆粒�。
此外�,Ou等人以雙重策略將氧化石墨烯引入水凝膠傷口敷料中。一方面�����,氧化石墨烯增強了水凝膠的力學(xué)性能���,通過氧化HA的醛與n -羧乙基殼聚糖的氨基進行動態(tài)希夫堿反應(yīng)合成�。另一方面���,氧化石墨烯不僅使水凝膠具有良好的導(dǎo)電性,還具有免疫調(diào)節(jié)作用�。因此,這種功能的結(jié)合賦予了多功能系統(tǒng)指導(dǎo)內(nèi)源性電流和調(diào)節(jié)免疫的可能性�。
最后�����,為了治療感染的慢性傷口���,本文還將氧化石墨烯與稀土鋱離子(Tb3+)結(jié)合到聚乙烯醇(PVA) -海藻酸鹽水凝膠中,該水凝膠在不含任何抗生素藥物的情況下顯示出抗菌效果�����,這一方法可適用于基于HA的平臺���。在碳基材料中���,碳點(CDs)具有獨特的光學(xué)、電化學(xué)�、生物相容性和光致發(fā)光特性。此外�,還有其他特性,例如低毒�����,在生理pH下的穩(wěn)定性和在水中良好的分散性,使其可以用作含有 HA 的系統(tǒng)中的生物材料���。例如在最近的一項工作中,研究人員利用嵌入在軟透明質(zhì)酸水凝膠中的光響應(yīng)性cd的光動力能力���,制造了一個能夠?qū)垢腥拘约毦钠脚_�����。有趣的是,Ti3C2MXene 納米片的突出特性(大比表面積�����、高導(dǎo)電性�、低毒性和可生物降解性)被用于 HA/藻酸鹽配方中�,以提供用于擠出的導(dǎo)電細胞負載生物墨水�。
圖 HA-多巴胺/rGO 水凝膠制備示意圖。(a) HA-多巴胺聚合物和(b) rGO@PDA的制備方案���,(c) HA-多巴胺/rGO水凝膠的方案以及原始、彎曲、壓縮和自愈的表征及其在傷口愈合中的應(yīng)用
3�、含導(dǎo)電聚合物和其他填料
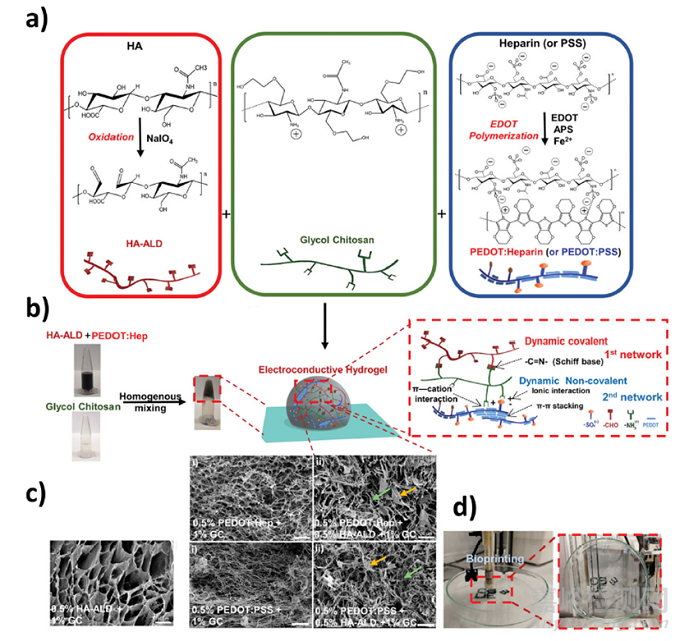
盡管金屬納米粒子和碳基材料被廣泛報道用于組織工程應(yīng)用�,但它們的長期細胞毒性和在某些情況下的低穩(wěn)定性限制了它們的進一步使用。相比之下���,除其他優(yōu)勢外,CPs 具有出色的電光性能���、高穩(wěn)定性和多功能摻雜化學(xué)例如,PPy已被用于增強基于HA的水凝膠的機械和導(dǎo)電性能�,還有硫酸軟骨素膜和水凝膠,這些水凝膠通過增強局部神經(jīng)血管再生來促進糖尿病創(chuàng)面修復(fù)���。此外,苯胺寡聚物和PAni20,也被用來生產(chǎn)生產(chǎn)導(dǎo)電HA水凝膠���。例如,具有優(yōu)良導(dǎo)電性的聚噻吩衍生物PEDOT因其與聚苯乙烯磺酸鹽(PSS)摻雜時的生物相容性和水分散性而脫穎而出�。事實上,PEDOT:PSS被用于醛(ALD)修飾的HA水凝膠中的導(dǎo)電網(wǎng)絡(luò)�。該體系在非共價相互作用和希夫堿鍵方面的動力學(xué)特性賦予了其自愈合、剪切變薄和黏著的能力(圖4)。
最后���,在意識到治療糖尿病傷口的重要性以及 ES 對促進糖尿病傷口愈合的積極作用后�。Liu等人使用離子液體通過Schiff反應(yīng)���,誘導(dǎo)了抗菌性能。最值得注意的是���,與市售Tegaderm™膜相比,所得系統(tǒng)與覆蓋的糖尿病傷口上的外源性 ES 相結(jié)合�����,誘導(dǎo)了愈合�����。
圖 雙交聯(lián)導(dǎo)電PEDOT:Heparin/HA-ALD/GC水凝膠的特性。(a) HA被NaIO4氧化�,形成具有醛基存在特征的HA- ald(左);二醇殼聚糖(中)的結(jié)構(gòu);PEDOT:肝素和PEDOT:PSS通過使用肝素或PSS作為摻雜劑聚合EDOT形成PEDOT顆粒來合成(右)���。(b) 混合后形成的水凝膠;雙交聯(lián)水凝膠網(wǎng)絡(luò)的三維結(jié)構(gòu)方案以及參與形成雙網(wǎng)絡(luò)的相互作用�。(c)水凝膠網(wǎng)絡(luò)掃描電子顯微鏡(SEM)圖像�����。
多功能性能的實現(xiàn)
由于創(chuàng)面愈合過程中復(fù)雜的病理機制和潛在的生理條件,單一功能的創(chuàng)面敷料治療效果有限�。因此對多功能性的追求意味著具有多種不同用途以使系統(tǒng)通用。具體而言�����,功能性水凝膠包含許多特性���,例如抗菌反應(yīng)、粘附和止血���、抗炎和抗氧化性能、物質(zhì)輸送�、自我修復(fù)、刺激反應(yīng)和導(dǎo)電性等�����。
本節(jié)中�,將重點關(guān)注那些具有獨特特征的導(dǎo)電 HA水凝膠���,它們具有可以徹底改變皮膚再生的性質(zhì)�,并推動了向臨床的過渡(表 1)�����。HA水凝膠中的生物黏附性���,可以快速有效地促進皮膚組織重新連接。它是從貽貝中獲得靈感���,引入蛋白質(zhì)-兒茶酚基團�����,如PDA NPs或通過對HA骨架的化學(xué)修飾獲得�。事實上�����,現(xiàn)在的趨勢是制備智能生物粘附材料,因為它們包含生物傳感功能(在某些情況下是無線的)���,從而可以實時和精確地評估愈合階段�����。在這種情況下,有研究者通過使用 Li+和 Na+作為導(dǎo)電離子�,利用硼砂作為動態(tài)交聯(lián)劑,設(shè)計了類似貽貝的導(dǎo)電HA水凝膠���。
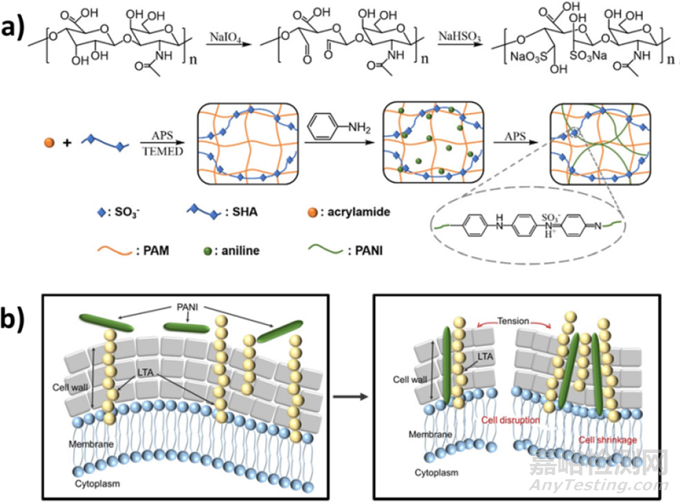
雖然最終目標是獲得用于電子皮膚(e-skin)應(yīng)用的應(yīng)變傳感器,但該系統(tǒng)的整體性能�����、高拉伸韌性(42.4 kPa)�����、自黏附性(與豬皮的黏附強度為49.6 kPa)和良好的自愈合性能可用于離子導(dǎo)電智能傷口敷料的設(shè)計���。由于電子皮膚設(shè)備以及任何與皮膚接觸的傷口電子貼片可能容易發(fā)生細菌感染,因此抗菌性能也非常需要�。2019年�,研究人員首次使用苯胺低聚物生產(chǎn)了基于HA的多功能傷口敷料。除電導(dǎo)率外�,還獲得了其他特性,如抗菌和抗氧化的有效反應(yīng)���,以及降解性和可注射性。具體來說�����,阿莫西林是包裹的抗生素�����,而苯胺四聚體顯著加快了全層皮膚缺損的傷口愈合速度�����。事實上���,最近���,攜帶高密度正電荷的摻雜聚苯胺對革蘭氏陽性菌的殺菌作用已經(jīng)得到證實�����。研究人員將 PAni 與大分子摻雜劑磺化 HA 偶聯(lián)以構(gòu)建導(dǎo)電水凝膠敷料,利用ES在體內(nèi)研究了其治愈難治性感染慢性傷口的潛力(圖5)�����。在后來的工作中���,類似的水凝膠平臺(即PAni共價接枝到季銨化殼聚糖上)結(jié)合ES加速了慢性糖尿病傷口愈合,同時顯示出增強的電導(dǎo)率和內(nèi)在的抗菌反應(yīng)���。
圖 (a) 聚丙烯酰胺-磺化透明質(zhì)酸-聚苯胺(PAM-SHA-PAni, PSP)水凝膠的制備�����;(b) PAni與脂磷壁酸特異性相互作用誘導(dǎo)革蘭陽性菌損傷的方案�。
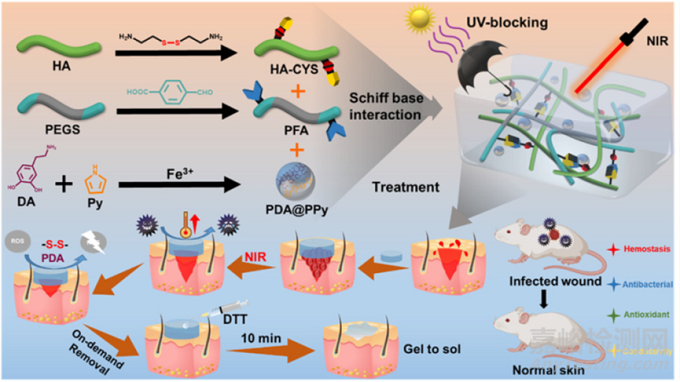
本文團隊還利用四苯胺制備了一種可注射的導(dǎo)電水凝膠,這種水凝膠具有新的附加功能�����,即可持續(xù)的缺氧誘導(dǎo)能力���。在這里���,本文選擇了一個糖尿病傷口作為代表性的損傷模型,并在其上注射了水凝膠���。其他研究者設(shè)計了一種復(fù)雜的體系�,具有以前沒有發(fā)現(xiàn)過的獨特特征���,如紫外線阻隔能力���,光熱抗感染,按需拆卸�,以及其他能力(如可注射性,自愈合���,組織黏附等)�。詳盡表征證明了它的多功能性,其重點是改進對耐甲氧西林金黃色葡萄球菌 (MRSA) 感染傷口的治療���。具體來說�����,網(wǎng)絡(luò)中存在的二硫鍵被二硫蘇糖醇(DTT)快速分解是其崩潰的原因(按需移除)�,而紫外線阻擋能力歸因于類似黑色素的PDA@PPy納米復(fù)合材料的存在(圖6)���。
盡管不一定導(dǎo)電,但值得一提的是�����,抗氧化劑HA水凝膠被設(shè)計成具有葡萄糖反應(yīng)性的水凝膠,以清除導(dǎo)致糖尿病慢性傷口延遲愈合的活性氧(ROS)���。最后要說明的是���,如果通過真空下簡單的處理,黑色素衍生物會具有高導(dǎo)電性���。為了促進傷口愈合,研究者將具有優(yōu)良光熱能力的墨魚黑色素納米顆粒引入透明質(zhì)酸水凝膠中用于光熱抗菌治療���,完成了一系列附加特性,包括抗氧化�、止血�����、滲出吸收和緩釋特性�����,以及其他(即可注射�����、可拉伸和自愈合系統(tǒng))�����。
圖 HA-CYS/PFA/PDA@PPy水凝膠的制備、功能和應(yīng)用
未來展望:交互式HA水凝膠
通過趨電性���,傷口處電流有利于傷口愈合并促進組織再生���。事實上,這種內(nèi)源性 ES 引導(dǎo)生物細胞運動以閉合傷口���。如前所述�,當(dāng)額外施加外部電流時���,即外源性 ES�����,可以進一步加速這種愈合過程。然而�����,最先進的導(dǎo)電傷口敷料不僅旨在促進 ES 的均勻應(yīng)用,而且還通過監(jiān)測和分析愈合階段充當(dāng)交互平臺�。
作為實現(xiàn)一定程度相互作用的第一種方法,各種各樣的刺激響應(yīng)性納米復(fù)合水凝膠被設(shè)計成可以對大量的內(nèi)部或外部刺激進行動態(tài)反應(yīng)���。然而�����,目前的趨勢是通過智能醫(yī)療設(shè)備來關(guān)注個人健康診斷和護理���,這些設(shè)備允許運動檢測、溫度控制���,甚至對其他設(shè)備進行無線控制�����。因此�����,下一代皮膚傷口敷料是什么樣子的?它們能否克服在促進皮膚傷口愈合的同時對人體健康進行實時監(jiān)測的苛刻組合?
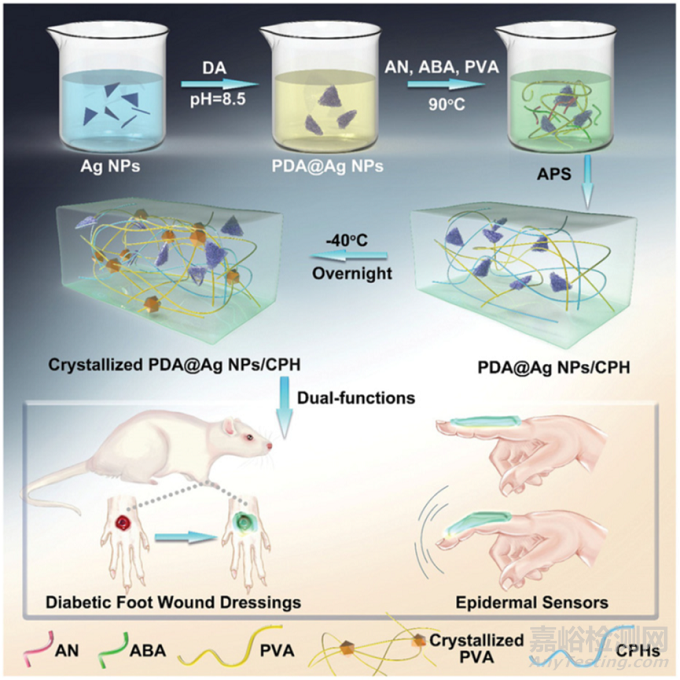
例如���,Yao等人已經(jīng)報告了幾個基于聚乙烯醇-海藻酸鈉-g-多巴胺-銀納米線-硼砂89和殼聚糖90的系統(tǒng),它們確實為這些問題提供了初步的答案�。具體來說���,表皮應(yīng)變傳感器除了具有正確的在體傷口愈合性能外,還記錄了各種尺度的人類活動�,如脈搏和呼吸、眨眼�、手指和手腕的運動以及握拳和張開手的運動���,響應(yīng)速度快,穩(wěn)定性好�����。同樣�����,在尋找交互功能的過程中,本文團隊開發(fā)了具有抗菌能力的導(dǎo)電水凝膠�����,用于表皮傳感器和糖尿病足傷口敷料�����,以模擬真皮層組織的功能(圖7)�����。
雖然聚乙烯醇被用作生物相容性聚合物�����,但在這種皮膚仿生裝置中�����,由PDA 修飾的銀 NPs 充當(dāng)抗菌成分���,而聚苯胺是導(dǎo)電的�����。另一群研究者研究了一種具有多功能特性的水凝膠�����,用于健康檢測(即實時檢測傷口的壓縮程度)和傷口愈合�。該裝置的獨特之處在于在海藻酸鹽敷料中添加了甘油,提高了水凝膠的彈性和抗凍性�����,以確保其在寒冷環(huán)境中作為傳感器的正常功能�����。
因此�,很明顯,擺在面前的是一個巨大的挑戰(zhàn):制造導(dǎo)電的多功能 HA 水凝膠皮膚敷料�����,不僅可以通過被動功能促進皮膚修復(fù)�����,還可以通過實時監(jiān)測患者的健康狀況與患者互動���,然后���,將此信息轉(zhuǎn)交給醫(yī)療團隊。在這方面,通過利用 HA 的優(yōu)異特性�,期望未來的設(shè)備能夠最終通過ES增強皮膚組織再生,同時顯示細菌生長來進行控制�����。
圖 PDA@Ag NPs/導(dǎo)電聚合物基水凝膠的合成及其作為糖尿病足傷口敷料表皮傳感器的進一步應(yīng)用
結(jié)論
本論文總結(jié)了近年來基于透明質(zhì)酸設(shè)計導(dǎo)電和相互作用的水凝膠作為傷口敷料的進展���,其中皮膚護理和組織修復(fù)是通過ES和/或多功能特性實現(xiàn)的�。在用于使透明質(zhì)酸水凝膠具有電活性的導(dǎo)電材料中�����,最相關(guān)的材料包括金屬/金屬氧化物納米顆粒、碳基部分和導(dǎo)電聚合物�。不過�����,我們預(yù)計在接下來的幾年中�����,當(dāng)其他導(dǎo)電材料(例如 PEDOT 衍生物)將應(yīng)用于基于 HA 的水凝膠時,會有更先進的發(fā)展�����。
為了解決皮膚再生過程及其多個方面的問題���,水凝膠被設(shè)想為多功能系統(tǒng)�����,從而結(jié)合了優(yōu)越的特性���,例如自我修復(fù)�����、粘合、抗菌���、可注射和抗氧化特性等�����。事實上�,性能更佳的一體式多功能創(chuàng)面敷料避免了使用多個單次使用的單一功能敷料�����,從而節(jié)約了成本�����。
在這方面�,3D制造方法,甚至4D方法�,已經(jīng)用于其他生物聚合物�����,預(yù)計將在短期內(nèi)應(yīng)用于HA基水凝膠。同樣���,ha -水凝膠可以與靜電紡絲毯結(jié)合�����,以提高性能和更復(fù)雜的形貌�����。盡管HA基水凝膠的生物活性較低傷口敷料已經(jīng)明顯優(yōu)于其他材料。在愈合方面�,可能會更進一步通過添加其他生物分子或干細胞來改進���。事實上�,研究者們也正在探索新的途徑�,包括基因治療���、激素/酶的添加以及生長因子的控制作用。具有足夠生產(chǎn)率和可重復(fù)性的大規(guī)模制造是這一研究領(lǐng)域的另一個挑戰(zhàn)���,它決定了商業(yè)化能否成功���。此外,隨著我們邁向個性化醫(yī)療時代�����,還需要努力開發(fā)便攜式低成本 ES 設(shè)備,這些設(shè)備具有易于使用的組件和低維護成本�����,以及種類繁多的可原位調(diào)整的敷料更好地匹配需要治療的傷口類型�����。