摘要
基因毒性雜質(zhì)是受到藥品監(jiān)管機(jī)構(gòu)和制藥企業(yè)重點(diǎn)關(guān)注和控制的對象����,由于其較一般雜質(zhì)具有微量水平就存在潛在致突變性和致癌性風(fēng)險的特點(diǎn),需要嚴(yán)格控制其在藥物中的含量以保證藥物質(zhì)量與臨床應(yīng)用的安全性����。本文從識別警示結(jié)構(gòu)、文獻(xiàn)及數(shù)據(jù)庫檢索���、量化構(gòu)效關(guān)系軟件預(yù)測����、體內(nèi)外遺傳毒性試驗(yàn)����、依照法規(guī)和指南要求制定合理限度等方面綜述了評估雜質(zhì)基因毒性的研究策略�,并總結(jié)了目前為了應(yīng)對其含量低���,穩(wěn)定性較差����,結(jié)構(gòu)多樣等特點(diǎn)開發(fā)的各類前處理技術(shù)及分析方法���,為基因毒性雜質(zhì)的研究提供參考�。
背景
基因毒性雜質(zhì)( genotoxic impurity����,GTI) 是指藥物中能直接或間接導(dǎo)致 DNA 受損引起基因突變,并具有致癌性或者潛在致癌可能性的一類雜質(zhì)[1]���。為了保證藥物的質(zhì)量安全���,2002 年歐洲藥物管理局( EMA) 最先出臺了關(guān)于基因毒性雜質(zhì)的管理法規(guī),美國食品藥物管理局( FDA) �、國際人用藥品注冊技術(shù)要求國際協(xié)調(diào)會( ICH) 等組織也針對基因毒性雜質(zhì)先后頒發(fā)了相關(guān)界定、分類���、限度���、檢測和風(fēng)險評估程序等一系列指南����,目前已經(jīng)成為藥品獲批及上市的關(guān)鍵指標(biāo)之一���。歐洲藥品質(zhì)量管理局( European Directorate for the Quality of Medicines & Health Care�,EDQM) 每年發(fā)布的上一年度申報資料中存在的十大常見缺陷問題報告中曾多次提到企業(yè)缺乏對基因毒性雜質(zhì)的討論���。提出的問題包括: ①缺少對工藝中使用到的起始物質(zhì)����、溶劑�、中間體����、試劑等可能引入基因毒性雜質(zhì)的討論; ②缺少對終產(chǎn)物中基因毒性雜質(zhì)的危害性評估; ③缺少對產(chǎn)品中基因毒性質(zhì)控制的討論。為解決以上問題�,本文通過概括基因毒性雜質(zhì)的研究思路,從其分類�、危害評估方法、限度及分析方法建立等方面進(jìn)行分析和總結(jié),為基因毒性雜質(zhì)的控制提供一定的理論依據(jù)和參考���。
藥物中基因毒性雜質(zhì)的具體研究思路如下:①通過對藥物合成�、生產(chǎn)及貯存過程進(jìn)行分析���,結(jié)合警示結(jié)構(gòu)�,鑒別并分離出其中可能引入的基因毒性雜質(zhì); ② 通過數(shù)據(jù)庫文獻(xiàn)檢索����、( 定 量) 構(gòu) 效 關(guān) 系[( quantitative ) structure- activity relationships,QSAR]評估和體內(nèi)外相關(guān)毒理學(xué)試驗(yàn)對可能存在的基因毒性雜質(zhì)進(jìn)行分類; ③結(jié)合相關(guān)指南及法規(guī)�,確定基因毒性雜質(zhì)可接受的限度標(biāo)準(zhǔn); ④根據(jù)基因雜質(zhì)的理化性質(zhì)及結(jié)構(gòu)特點(diǎn),建立理想的分析方法���,并進(jìn)行方法學(xué)驗(yàn)證; ⑤對藥品進(jìn)行檢測����,確定其中基因毒性雜質(zhì)含量是否符合要求�。
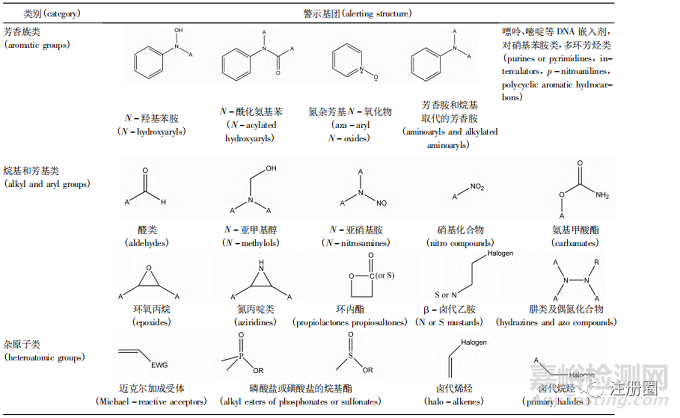
一、基因毒性警示結(jié)構(gòu)
基因毒性化合物多種多樣����,其結(jié)構(gòu)中通常含有某些可能誘導(dǎo)基因突變或癌癥發(fā)生的特殊基團(tuán)����,被稱為警示結(jié)構(gòu)�。在缺乏安全性數(shù)據(jù)支持的情況下,目前的法規(guī)和指導(dǎo)原則均采用警示結(jié)構(gòu)作為普通雜質(zhì)和基因毒性雜質(zhì)的區(qū)分標(biāo)志����。目前美國國立衛(wèi)生研究院數(shù)據(jù)庫已經(jīng)發(fā)布了 1 574 種致癌物質(zhì)的結(jié)構(gòu)式、CAS 號等常用信息����,常見的警示結(jié)構(gòu)主要有 3類,見表1[2]���。然而����,警示結(jié)構(gòu)的意義僅在于它對于可能存在遺傳毒性和致癌性的雜質(zhì)起到了基礎(chǔ)的提示作用�,需要結(jié)合雜質(zhì)的理化性質(zhì)及其結(jié)構(gòu)特點(diǎn)����,為其危害評估與進(jìn)一步的限度控制提供方向。
▲ 表1-基因毒性雜質(zhì)警示結(jié)構(gòu)
Tab. 1 Alerting structures of genotoxic impurities
注(note) : A. 烷基����、芳基或氫原子( Alkyl�,Aryl or H) ; Halogen. 鹵素原子( F���,Cl���,Br,I) ; EWG. 吸電子基團(tuán)( electron withdrawing group)
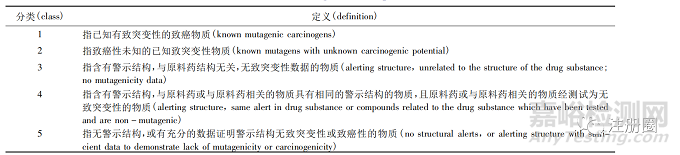
二����、遺傳毒性雜質(zhì)的危害評估方法
目前根據(jù)致突變和致癌風(fēng)險危害程度可將雜質(zhì)分為5 類,見表2[3]����。對于1 個未知的、可能具有潛在基因毒性的化合物����,其危害評估應(yīng)通過數(shù)據(jù)庫文獻(xiàn)檢索、QSAR 評估以及體內(nèi)外遺傳毒性試驗(yàn)等評估方法對化合物進(jìn)行分類�,再根據(jù)分類制定具體的可接受限度標(biāo)準(zhǔn)。
▲ 表2-基因毒性雜質(zhì)分類
Tab. 2 Classification of genotoxic impurities
2. 1 數(shù)據(jù)庫����、文獻(xiàn)檢索評估方法
在鑒定1個雜質(zhì)是否為基因毒性雜質(zhì)時���,首先可以通過查詢相關(guān)數(shù)據(jù)庫中毒理學(xué)事實(shí)數(shù)據(jù)快速有效地對雜質(zhì)進(jìn)行分類,從而避免不必要的動物試驗(yàn)�,節(jié)省成本?��?捎糜谂袛嗷衔锘蚨拘缘臄?shù)據(jù)庫包括: ①毒理學(xué)數(shù)據(jù)庫(TOXNET) ( https: / /toxnet. nlm. nih. gov /) ����,該數(shù)據(jù)庫由美國國立醫(yī)學(xué)圖書館建立�,其中 TOXLINE為文獻(xiàn)型數(shù)據(jù)庫,危險化合物數(shù)據(jù)庫(HSDB) ����、遺傳毒理學(xué)(GENE-TOX) 、化學(xué)物質(zhì)致癌作用研究信息系統(tǒng)(CCRIS) 等為事實(shí)與數(shù)值型數(shù)據(jù)庫�,均可用于檢測化合物的致突變性以及致癌性[4]。②The carcinogenic potency database ( https: / /toxnet.nlm.nih.gov /new toxnet /cpdb.htm) 為 TOXNET的子數(shù)據(jù)庫����,收錄了1980-2011年間發(fā)表過的文獻(xiàn)或由美國癌癥研究所和國家毒理學(xué)計劃報告過的致癌性化合物相關(guān)數(shù)據(jù),共收錄 1547 種致癌性化合物[5]���。③化學(xué)物質(zhì)毒性數(shù)據(jù)庫( https: / /www.drugfuture.com/toxic /) ���,該數(shù)據(jù)庫收錄了約15 萬個化合物的毒理方面的數(shù)據(jù),包括遺傳毒性���、致癌以及生殖毒性并提供數(shù)據(jù)來源�,可供多種方式查詢���,包括化學(xué)名稱���、CAS 登記號、英文名等�。
除了以上幾個可專門查詢化合物相關(guān)毒性的數(shù)據(jù)庫,其他數(shù)據(jù)庫如SciFinder 或 PubMed 等也可以查詢相關(guān)毒理學(xué)數(shù)據(jù)����。如果目前未收錄待測化合物體內(nèi)外相關(guān)實(shí)驗(yàn)數(shù)據(jù),可結(jié)合 QSAR 對其基因毒性進(jìn)行進(jìn)一步的評估���。
2. 2 QSAR 評估方法
QSAR評估方法是根據(jù)化合物結(jié)構(gòu)特性與致突變性和致癌性的定量相關(guān)性來對待測化合物的基因毒性進(jìn)行預(yù)測���。EMEA 和 FDA 指南草案均認(rèn)為QSAR是一種評估潛在基因毒性的有效方法。應(yīng)用QSAR方法進(jìn)行評估時����,應(yīng)采用2個預(yù)測原理互補(bǔ)的QSAR預(yù)測方法: 1個方法基于專家規(guī)則���,另1個方法基于統(tǒng)計學(xué),專家規(guī)則中包含的知識基于統(tǒng)計學(xué)大量數(shù)據(jù)證明���,而統(tǒng)計學(xué)規(guī)則中的分子描述符���、模型的建立和數(shù)據(jù)的收集則應(yīng)由專家指導(dǎo)[3]。
2. 2. 1 基于專家規(guī)則
基于專家規(guī)則的評估軟件是通過收集現(xiàn)有數(shù)據(jù)(已發(fā)表的文獻(xiàn)�、公開或內(nèi)部數(shù)據(jù)庫等) 建立解決問題所需的知識庫,從而模擬具有化學(xué)和遺傳毒理學(xué)專業(yè)知識和經(jīng)驗(yàn)的專家的判斷和行為����。專家規(guī)則軟件的 1個特點(diǎn)是能夠解釋自己的推理并提供相關(guān)證據(jù),交由使用者來理解和判斷所得出的結(jié)果的合理性���。如有必要�,所有基于計算機(jī)系統(tǒng)的分析結(jié)果均可以使用專家知識進(jìn)行回溯�,為所有預(yù)測的陽性、陰性�、相互矛盾或無法得出結(jié)論的結(jié)果提供額外的支持性證據(jù),從而保障最終結(jié)論的合理性[3]。目前使用較為廣泛的基于專家規(guī)則的軟件有DEREK�、Leadscope Expert Alerts�、MultiCASE、ToxTree 等�。
2. 2. 2 基于統(tǒng)計學(xué)
與專家規(guī)則不同,基于統(tǒng)計學(xué)的軟件是通過收集細(xì)菌致突變性試驗(yàn)數(shù)據(jù)及相關(guān)毒理學(xué)文獻(xiàn)�,建立起一類基于化合物結(jié)構(gòu)和基因毒性之間相關(guān)性的統(tǒng)計學(xué)模型。輸入待測物的結(jié)構(gòu)式�,軟件可以通過計算參數(shù)、結(jié)構(gòu)相關(guān)性以及各類統(tǒng)計方法來預(yù)測其潛在基因毒性�。數(shù)據(jù)庫除了可以預(yù)測化合物整體結(jié)構(gòu)的毒性,還可以給出化合物結(jié)構(gòu)中某個官能團(tuán)對毒性的貢獻(xiàn)水平����。目前常用的基于統(tǒng)計學(xué)規(guī)則的軟件有Leadscope、Sarah Nexus���、TOPKAT����、Multi-CASE����、Case Ultra 等。
獲得 2 種 QSAR 方法的評估結(jié)果后需要根據(jù)其給出的證據(jù)進(jìn)行分析。當(dāng) 2 種方法判斷該雜質(zhì)均為陽性時�,表明該雜質(zhì)有很大幾率為 1 類或 2 類雜質(zhì),除非有更為權(quán)威的數(shù)據(jù)證明其為 4 類雜質(zhì); 如果 2 種方法的結(jié)果均為陰性���,表明該雜質(zhì)有可能為 4 類或 5類雜質(zhì)����,或數(shù)據(jù)不足以判斷為基因毒性雜質(zhì); 如果 2種方法的結(jié)果 1 個為陽性而另 1 個為陰性�,或者出現(xiàn)模棱兩可及超出判斷范圍的結(jié)果,則可以將其評估歸為 3 類雜質(zhì)���,并進(jìn)一步開展遺傳毒性試驗(yàn)���。祝清芬等[6]采用 Derek( 專家知識規(guī)則) 和 Sarah( 統(tǒng)計學(xué))2 類 QSAR 評價軟件,對左羥丙哌嗪中的 3 個雜質(zhì)以及羥苯磺酸鈣中的 1 個雜質(zhì)進(jìn)行基因毒性評價和分類�。其中縮水甘油被 Derek 判斷具有環(huán)氧化物警示結(jié)構(gòu),結(jié)合 Sarah 列舉相關(guān)文獻(xiàn)和數(shù)據(jù)庫匹配的支持性結(jié)構(gòu)判斷其遺傳毒性為陽性的可信度為 100% ; 另1種雜質(zhì)氫醌雖然在 Derek 中預(yù)測結(jié)果為陰性���,但是結(jié)合 Sarah 提供的陽性支持性結(jié)構(gòu)和文獻(xiàn)判斷其遺傳毒性定為陽性���。已知縮水甘油和氫醌分別被國際癌癥研究所( IARC) 列為 2A 類和 3A 類致癌物,說明基于指導(dǎo)原則的要求使用 QSAR 軟件可以對雜質(zhì)做出合理的遺傳毒性預(yù)測���。
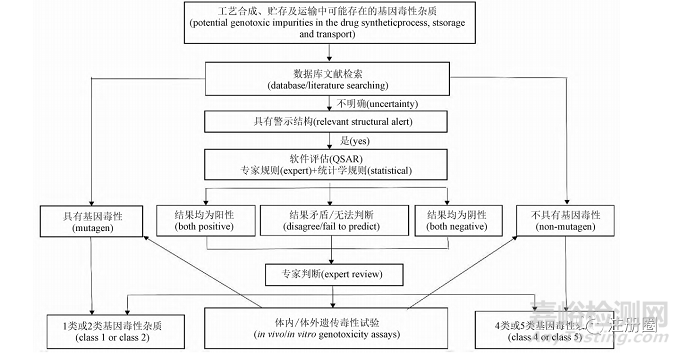
2. 3 遺傳毒性試驗(yàn)
遺傳毒性試驗(yàn)是指用于檢測受試物通過不同原理直接或間接導(dǎo)致遺傳物質(zhì)損傷的體內(nèi)外試驗(yàn)�,遺傳物質(zhì)的損傷包括基因突變、染色體數(shù)目的改變���、染色體損傷或重組導(dǎo)致的 DNA 損傷等���,對于基因毒性不明確的雜質(zhì)�,應(yīng)進(jìn)一步進(jìn)行遺傳毒性試驗(yàn)評估。如果遺傳毒性試驗(yàn)結(jié)果呈陽性���,在結(jié)合其他藥學(xué)研究數(shù)據(jù)排除了假陽性的情況下可判斷該雜質(zhì)具有遺傳毒性���,為 1 類或 2 類雜質(zhì),若為陰性���,則可判斷該雜質(zhì)為 4 類或 5 類雜質(zhì)����,見圖 1�。試驗(yàn)方法可分為體內(nèi)和體外 2 種類型,體外試驗(yàn)包括細(xì)菌回復(fù)突變試驗(yàn)( Ames 試驗(yàn))���、體外中期相染色體畸變試驗(yàn)���、體外微核試驗(yàn)���、小鼠淋巴瘤細(xì)胞試驗(yàn)( mouse lymphoma assay,MLA) 等���,可選擇的試驗(yàn)材料包括從原核細(xì)胞����、真核細(xì)胞和高等哺乳動物細(xì)胞等; 體內(nèi)試驗(yàn)包括體內(nèi)骨髓微核或外周血紅細(xì)胞微核試驗(yàn)�、骨髓細(xì)胞染色體變試驗(yàn)、單細(xì)胞凝膠電泳試驗(yàn)( 彗星試驗(yàn)) ����、轉(zhuǎn)基因小鼠體內(nèi)突變試驗(yàn)、外周淋巴細(xì)胞測定染色體畸變試驗(yàn)���、DNA 共價結(jié)合試驗(yàn)等���,試驗(yàn)材料多采用嚙齒類動物[7]。以上實(shí)驗(yàn)均已得到驗(yàn)證并被廣泛應(yīng)用����。
▲ 圖1-基因毒性雜質(zhì)危害性評估步驟
Fig. 1 Hazard assessment steps of genotoxic impurities
遺傳毒性試驗(yàn)的設(shè)計應(yīng)根據(jù)受試物特點(diǎn)選擇合理的方案����,為制定合理雜質(zhì)限度標(biāo)準(zhǔn)提供可靠數(shù)據(jù)�。目前,為了全面評估待測物的遺傳毒性風(fēng)險���,通常采用體內(nèi)和體外試驗(yàn)相互補(bǔ)充的方法對待測物的遺傳學(xué)終點(diǎn)進(jìn)行全面考察���,其中體外試驗(yàn)應(yīng)包含 Ames 試驗(yàn)并且至少采用 5 種菌株�。除此之外,由于體內(nèi)試驗(yàn)具有更貼合臨床實(shí)際使用情況的優(yōu)勢且可檢出體外試驗(yàn)無法檢出的某些遺傳毒性化合物�,因此標(biāo)準(zhǔn)試驗(yàn)組合中應(yīng)至少包含 1 項體內(nèi)試驗(yàn),在藥物遺傳毒性研究指導(dǎo)原則中推薦了 2 種標(biāo)準(zhǔn)試驗(yàn)組合�,見表 3。推薦組合并不代表其更優(yōu)����,可以根據(jù)待測物具體生物活性特點(diǎn)合理采用其他經(jīng)過驗(yàn)證的試驗(yàn)作為替代試驗(yàn),用作對標(biāo)準(zhǔn)試驗(yàn)組合得到的遺傳毒性試驗(yàn)結(jié)果的進(jìn)一步研究���。
▲ 表3-推薦標(biāo)準(zhǔn)實(shí)驗(yàn)組合 Tab. 3 Standard combinatorial tests
注(note) : + . 需做( request the test) ; ± . 視情況而定( depend on the situation)
在完成一組體內(nèi)外標(biāo)準(zhǔn)試驗(yàn)組合后對結(jié)果進(jìn)行分析�,若試驗(yàn)結(jié)果為陰性,通?���?商崾臼茉囄锶狈z傳毒性。對于得到陽性結(jié)果的待測物���,應(yīng)結(jié)合其他藥學(xué)研究數(shù)據(jù)進(jìn)行綜合分析����。Asuka等[8]對谷氨酸鈉進(jìn)行了一系列遺傳毒性試驗(yàn)以研究其致突變性和致癌性����,包括 Ames 試驗(yàn)、體外染色體畸變試驗(yàn)�、小鼠淋巴瘤tk試驗(yàn)、人外周血淋巴細(xì)胞體外微核試驗(yàn)以及和大鼠骨髓微核試驗(yàn)����。與對照組相比,谷氨酸鈉對任何細(xì)菌株均無致突變性���,無致染色體畸變���、基因突變或致微核作用����,判斷谷氨酸鈉在研究條件下不具有遺傳毒性����。
三、限度計算
為了控制藥品中基因毒性雜質(zhì)的含量����,EMA 2006 年頒布了《基因毒性雜質(zhì)限度指南》,引用毒理學(xué)關(guān)注閾值 ( threshold of toxicological concern-based����,TTC) 這一概念界定所有未經(jīng)研究,但具有致癌風(fēng)險或其他毒性效果的化合物的可接受攝入量����,基因毒性雜質(zhì)的可接受限度為1. 5 μg·d-1[9]���。TTC作為風(fēng)險評估指標(biāo)����,不能理解為絕對無風(fēng)險����,部分化合物已被證實(shí)具有較高的致癌風(fēng)險����,因此需要制定較 TTC 更為嚴(yán)格的控制標(biāo)準(zhǔn)����。各個國家及制藥企業(yè)的研究學(xué)者提出了“階段化TTC”的概念,即原料藥中的基因毒性雜質(zhì)限度應(yīng)當(dāng)考慮藥物的暴露周期���,暴露周期較短的藥物應(yīng)當(dāng)可以設(shè)定較高的控制限度���。2017年5月31日 ICH出臺了第4版指南 M7( R1) ,在階段性 TTC 策略的基礎(chǔ)上進(jìn)一步調(diào)整和增補(bǔ)相關(guān)指導(dǎo)原則�,使得研究人員能夠根據(jù)藥物暴露周期,科學(xué)地控制基因毒性雜質(zhì)含量�,使風(fēng)險評估更 加靈活準(zhǔn)性[3]。在實(shí)際制定某一 GTIs 的可接受標(biāo)準(zhǔn)時���,應(yīng)根據(jù) GTIs 致突變和致癌風(fēng)險危害類別以及其現(xiàn)有毒理學(xué)數(shù)據(jù)選擇合適的計算方法���,雜質(zhì)限值的計算公式一般為雜質(zhì)限值 = 雜質(zhì)每日可接受攝入量 /藥物每 日 最 大 用 量。其中可接受攝入量計算方法見表 4�,對于無毒理學(xué)研究數(shù)據(jù)的雜質(zhì)可采用 TTC 計算可接受攝入量,其計算方法分為單個雜質(zhì)和多個雜質(zhì)����,見表 5。
以N-二甲基亞硝胺( NDMA) 為例�,NDMA 為第1類雜質(zhì),在小鼠與大鼠中的TD50值分別為 0. 189 mg·kg-1·d -1和 0. 095 9 mg·kg-1·d-1( 按照更為保守的大鼠TD50值0. 0959 mg·kg -1·d-1計算) �,人體質(zhì)量50 kg����,風(fēng)險概率按腫瘤發(fā)生風(fēng)險為十萬分之一來計算每日攝入量可得[3]: 每日攝入量( PDE) = TD50 × W人體質(zhì)量 /50 000 =0. 095 9 ×50/50 000 =0. 095 9 μg·d-1。
對于缺少致癌性數(shù)據(jù)����,但化學(xué)結(jié)構(gòu)與已知致癌物類似的致突變雜質(zhì)����,可以采用化合物特異性的方法來計算致突變雜質(zhì)的可接受攝入量�,ICH M7( R1)中詳細(xì)列舉了不同分類下 GTIs 的每日可接受攝入量計算方法。在明確了GTIs的限度后�,可以根據(jù)要求 開發(fā)適宜的分析方法,并對其進(jìn)行優(yōu)化及驗(yàn)證���。
▲ 4-基因毒性雜質(zhì)可接受攝入量的計算方法
Tab. 4 Counting method of acceptable intakes of genotoxic impurities

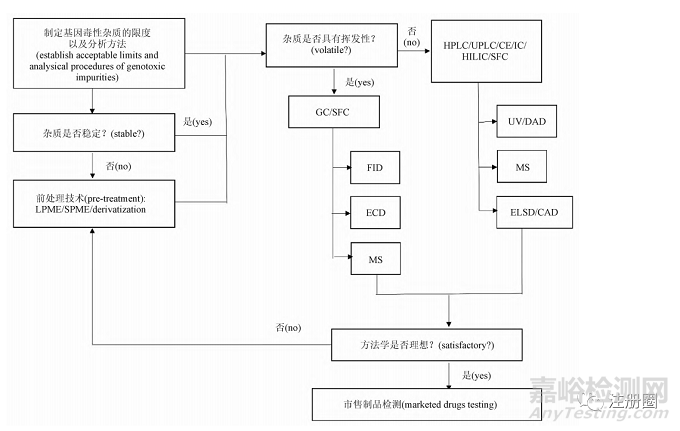
四����、分析方法的建立及策略
與一般雜質(zhì)相比���,基因毒性雜質(zhì)特點(diǎn)是在微量水平即可造成人體內(nèi)遺傳物質(zhì)的損傷����,因此 GTIs 的分析檢測是一項具有挑戰(zhàn)性的研究���。目前藥物中基因毒性雜質(zhì)限度通常被控制在非常低的水平����,對分析儀器的靈敏度要求較高; 部分 GTIs 化學(xué)反應(yīng)活性較高或穩(wěn)定性較差����,在提取、制備或者分析過程中易發(fā)生反應(yīng)或揮發(fā)���,導(dǎo)致回收率低�,準(zhǔn)確度差; 除了靈敏度和準(zhǔn)確度之外,分析方法還應(yīng)具有能將 GTIs 與一般雜質(zhì)分離開的高選擇性�。為了應(yīng)對這些挑戰(zhàn),需根據(jù)不同基因毒性雜質(zhì)的特點(diǎn)探索各種分析策略����,選擇合理的樣品前處理手段和分析儀器,開發(fā)并優(yōu)化分析方法�,以便準(zhǔn)確地測量和控制藥品中 GTIs水平,分析思路見圖 2���。
4. 1 樣品前處理技術(shù)
恰當(dāng)?shù)那疤幚硎侄慰梢杂行p少樣品損耗����,提高分析方法的選擇性以及靈敏度�,以便獲得更好的檢測結(jié)果。這些前處理手段可以使樣品的純化����、富集和檢測一體化,優(yōu)化檢測效率����。
4. 1. 1 萃取技術(shù)
由于基因毒性雜質(zhì)檢測很低,檢測時有可能引入原料藥或者溶劑雜質(zhì)���,導(dǎo)致無法得到準(zhǔn)確的結(jié)果���,需要采用適當(dāng)?shù)妮腿〖夹g(shù),對樣品進(jìn)行分離純化和富集����,從而滿足進(jìn)樣標(biāo)準(zhǔn),在減少基質(zhì)的干擾及提高檢測靈敏度的同時可以與氣相色譜或液相色譜在線聯(lián)用����,具有萃取效率高及操作簡單等優(yōu)點(diǎn)。
4. 1. 1. 1 夜-液萃取法及液相微萃取法
液液萃取( LLE) 是最為傳統(tǒng)的一種萃取方式����,歐洲藥典( EP) 采用 LLE - 頂空進(jìn)樣(headspace,HS) - GC/MS 法測定藥物中的硫酸甲酯( MMS) ���、硫酸乙酯( EMS) 和硫酸異丙酯( IMS)[10]����。但是 LLE法操作煩瑣���,萃取溶劑毒性大且用量較多�,容易發(fā)生乳化,從而影響測定結(jié)果���。1996 年液相微萃取( LPME) 技術(shù)出現(xiàn)���,具有萃取效率高及溶劑消耗少的優(yōu)點(diǎn),可以與色譜儀在線聯(lián)用���,實(shí)現(xiàn)樣品萃取����、富集和檢測一體化�。Cui 等[11]采用了分散液相微萃取作為前處理手段去除基質(zhì)效應(yīng),并聯(lián)用HPLC-UV 法測定酒石酸依格列司他原料藥中的1�,4-苯并二 烷-6-甲醛,檢測限為1. 29 μg·g-1����。Durak 等[12]采用可切換溶劑的液相微萃取技術(shù)作為樣品前處理和富集手段,聯(lián)用 GC - MS 法對4個氯化有機(jī)物進(jìn)行檢測����,其檢測限較直接采用GC-MS分析樣品的方法提高了33~115倍�。
▲ 圖2-基因毒性雜質(zhì)分析方法建立思路
Fig.2 Analytical procedures of genotoxic impurity
HPLC. 高效液相色譜( high performance liquid chromatography) UPLC. 超高效液相譜(ultraperformance liquid chromatography) CE. 毛細(xì)管電泳色譜( capillary electrophoresis) IC. 離子色譜( ion chromatography) HILIC. 親水作用色譜( hydrophilic interaction liquid chromatography) SFC. 超臨界色譜( super critical fluid chromatography) GC. 氣相色譜( gas chromatography) FID. 氫火焰離子化檢測器( flameionization detector) ECD. 電子捕獲檢測器( electron capture detector) MS. 質(zhì)譜( mass spectrometry) UV. 紫外吸收檢測器( ultraviolet absorption detector) DAD. 二極管陣列檢測器( diode array detector) ELSD. 蒸發(fā)光散射檢測器( evaporative light scattering detector) CAD. 電噴霧檢測器( corona charged aerosol detector) LPME. 液相微萃取技術(shù)( liquid phase microextraction) SPME. 固相微萃取技術(shù)( solid phase microextraction)
4. 1. 1. 2 固相萃取法及固相微萃取法
固相萃取(SPE) 是一種利用固定相對分析組分的吸附作用����,將待測物從基質(zhì)中萃取并富集的前處理過程����,一般選擇具有良好吸附性能的材料如碳納米管、分子印跡聚合物等顆粒固相進(jìn)行萃取����,待測物檢測限也隨著固相成分的發(fā)展大大降低,例如以吩噻嗪鍵合硅膠為固相聯(lián)合GC-MS進(jìn)行分析[13]�,硝基苯類化合物的檢出值可以低至0. 06~0. 3 ng·mL-1。Tzanavaras等[14]通過在線固相萃取技術(shù)分離并測定別嘌呤醇中肼的含量�,以鄰苯二甲醛作為衍生化試劑在酸性條件下與肼反應(yīng)形成腙衍生物,利用親水吸附劑成功地將待測物從別嘌呤醇中分離���,避免了美國藥典中提出的溶劑萃取過程并提高了靈敏度���。與固相萃取技術(shù)相比,固相微萃取( SPME) 技術(shù)更加高效簡便���,可以采用纖維針式 SPME�、管內(nèi) SPME、固態(tài)攪拌棒萃取等多種形式從復(fù)雜基質(zhì)中富集待測物進(jìn)行檢測�,在藥物分析領(lǐng)域中應(yīng)用廣泛。Ivelisse等[15]采用固相微萃?��。瓪庀嗌V/質(zhì)譜聯(lián)用技術(shù)����,在選擇離子監(jiān)測模式下完成了原料藥中 7個磺酸酯類基因毒性雜質(zhì)的測 定���,并 比較了Carboxen /聚二甲基硅氧烷(CAR/PDMS) ����、聚二甲基硅氧烷/二乙烯基苯( PDMS /DVB) 以及聚乙二醇/二乙烯基苯(CW/DVB) 等固相微萃取萃取頭之間的差異���。由于PDMS /DVB能更有效地從原料藥中提取磺酸酯類基因毒性雜質(zhì)�,與質(zhì)譜聯(lián)用進(jìn)樣時靈敏度更高���,重現(xiàn)性更好�,因此作者選擇其作為萃取頭材質(zhì)�,并對微萃取時間以及提取介質(zhì)的 pH 等條件進(jìn)行了優(yōu)化。最終該方法可以有效檢測原料藥中5 ng·g-1左右的磺酸酯類基因毒性雜質(zhì)�,所得萃取溶液中磺酸酯類雜質(zhì)的濃度為50 ng·g - 1左右���,方法重現(xiàn)性較好。
4. 1. 2 衍生化技術(shù)
衍生化技術(shù)是一種利用化學(xué)反應(yīng)改變難以分析檢測的待測物的化學(xué)和物理性質(zhì)�,定量地轉(zhuǎn)化成另一種更易分離檢測的化合物的前處理技術(shù)。通過衍生化可以改善雜質(zhì)的色譜特性和分離效果���,提高方法的選擇性和靈敏度,同時對檢測過程中不穩(wěn)定的待測物起到保護(hù)作用���。應(yīng)根據(jù)不同類型GTIs 的理化性質(zhì)或限度要求選擇合適的衍生化試劑進(jìn)行反應(yīng)����。
4. 1. 2. 1 磺酸酯類化合物
由于酯類易水解的特點(diǎn)����,磺酸酯類化合物通常采用衍生化的手段將其轉(zhuǎn)化為較為穩(wěn)定的化合物,以有效提高檢測結(jié)果的準(zhǔn)確性���。EP提供了一種以碘化鈉作為衍生化試劑����,采用頂空進(jìn)樣GC/MS法檢測甲磺酸倍他司汀�、苯磺酸氨氯地平和對甲苯磺酸舒他西林原料藥中的痕量甲磺酸酯���、苯磺酸酯和對甲苯磺酸酯的方法,因操作簡便而受到廣泛的應(yīng)用����。Zhou 等[16]使用衍生化試劑N,N-二乙基二硫代氨基甲酸酯(DDTC) 向待測甲磺酸甲酯和甲磺酸乙酯中引入生色基團(tuán)����,使其適用于HPLC- UV作為分析方法。Li 等[17]通過碘化鈉將甲磺酸伊馬替尼和甲磺酸左氧氟沙星原料藥中的GTIs 甲基磺酸甲酯�、甲基磺酸乙酯和甲基磺酸異丙酯衍生化為相應(yīng)的碘化烷烴,經(jīng)頂空單液滴微萃取法富集后再使用 DDTC 衍生化����,經(jīng) HPLC- UV分離檢測,檢測限最低為15 ng·mL-1�。
4. 1. 2. 2 肼類化合物
肼類化合物具有活潑性高,揮發(fā)性強(qiáng)�,分子量小,不具備發(fā)色基團(tuán)等特殊化學(xué)性質(zhì)�,且容易與色譜柱中的硅氧基生反應(yīng)從而導(dǎo)致峰形不理想,因此常采用衍生化法手段減少藥物基質(zhì)的干擾�,提高穩(wěn)定性和結(jié)果準(zhǔn)確性。Wang等[18]采用2-羥基-1-萘醛作為衍生化試劑與肼反應(yīng)生成腙類化合物,減少基質(zhì)干擾的同時提高了方法選擇性和靈敏度�。卡巴克洛( CBZ) 和卡巴克洛磺酸鈉( CSS) 中都含有氨基脲基團(tuán)�,合成過程中可能會引入肼類基因毒性雜質(zhì),Canavesi 等[19]開發(fā)了一種LC-DAD 法用來測定CBZ 和 CSS 藥物中氨基脲鹽酸鹽含量的方法�,采用 2 - 萘甲醛作為柱前衍生化試劑將氨基脲轉(zhuǎn)化為具有發(fā)色基團(tuán)的 2-萘甲醛氨基脲( NCS) ,并聯(lián) LLE 富集純化����,檢測限可達(dá)到0. 02 μg·mL-1。
4. 1. 2. 3 鹵代烷烴類及酰氯類化合物
鹵代烷烴種類繁多且性質(zhì)各不相同���,對于非揮發(fā)的烷基鹵化物,可通過衍生化法改善其揮發(fā)性���,進(jìn)而采用GC法進(jìn)行測定�。例如氯乙醇和1- 氯丁醇沸點(diǎn)較高����,不適合氣相色譜法檢測,結(jié)構(gòu)中只有1個氯原子取代也使 ECD的靈敏度和回收率較低�。David 等[20]采用七氟叔丁基氯對氯乙醇和1-氯丁醇進(jìn)行衍生,引入了多個氟原子����,使樣品雜質(zhì)的揮發(fā)性增加���,提高其在ECD 中的檢測靈敏度,其檢測限為5 ng·mL-1����。Bai等[21]開發(fā)了一種以二甲胺作為衍生化試劑下與 2 種氯代烷烴反應(yīng)引入胺基的衍生方法,有效提高了其靈敏度�,1 ng·mL-1 濃度下其信噪比為 30 和 36。Zheng等[22]建立了一種測定藥物中芳香族化合物和脂肪族酰氯的衍生化 HPLC-UV 法����,并且對比了硝基苯胺和硝基苯肼2種衍生化試劑; 結(jié)果表明,硝基取代苯肼衍生物顯示出最大波長和吸光強(qiáng)度的增加����,可以有效減少基質(zhì)干擾,提高了方法的特異性和靈敏度����,檢測限范圍在0. 01~ 0. 03 μg·ml-1�。
4. 1. 2. 4 環(huán)氧類化合物
環(huán)氧化合物中三元環(huán)通常不穩(wěn)定��,常在氣相色譜樣品入口處受高溫影響而開環(huán)降解��,導(dǎo)致分析過程精密度和準(zhǔn)確度較差����。衍生化是解決以上問題常用的方法�����。Bai 等[21]報道了一種利用二甲胺作為衍生化試劑使環(huán)氧化物形成穩(wěn)定結(jié)構(gòu)的方法�����,并利用衍生化物的高質(zhì)子親和力采用液相色譜 - 電噴霧質(zhì)譜法(LC-ESI-MS) 進(jìn)行檢測��,提高了靈敏度,2種環(huán)氧化物信噪比在5 ng·mL-1和7. 5 ng·mL-1濃度下分別為 50 和 260����。Wu等[23]報道了一種利用 Meerwein 反應(yīng)進(jìn)行衍生化�����,再聯(lián)合LC- MS 測定環(huán)氧化合物含量的方法�����,檢測限為10 ng·mL-1; 研究發(fā)現(xiàn)以乙基氮雜炔正離子作為衍生化試劑與環(huán)氧化合物反應(yīng)�����,可以增加環(huán)氧化合物的穩(wěn)定性��,?���;x子也顯示可以與環(huán)氧類化合物發(fā)生相同的反應(yīng)��。
4. 1. 2. 5 芳香胺類化合物
芳香胺類化合物分子結(jié)構(gòu)中與苯環(huán)相連的氮原子經(jīng)代謝活化,易生成穩(wěn)定的氮正離子�����,能與 DNA 結(jié)構(gòu)中的親核活性基團(tuán)發(fā)生反應(yīng),因此具有潛在致突變性。除此之外芳香硝基類化合物缺乏足夠的電離效率�����,可通過化學(xué)衍生化將其轉(zhuǎn)化為帶電荷的芳香胺類化合物�����,再進(jìn)行液相色譜或氣相色譜聯(lián)用質(zhì)譜法進(jìn)行痕量分析檢測�����。Wu 等[24]選擇利用 50% 甲酸銨溶液作為2- ( 溴甲基) - 6-硝基苯甲酸甲酯的衍生化試劑��,鋅粉作為催化劑����,搖勻后離心取上清液進(jìn)行LC-MS 分析,檢測限低至 0. 2 ng · mL - 1�����,回收率均 在80% 以上��。Vanhoenacker 等[25]開發(fā)了一種檢測原料藥中13 類芳香胺和氨基吡啶的原位衍生化 LC-MS方法��,并對鄰苯二甲醛�����、9-氟甲氧羰基氯��、氯甲酸己酯��、3����,5 -二硝基苯甲酰氯等幾種常用胺類衍生化試劑進(jìn)行研究,結(jié)果表明氯甲酸己酯作為衍生化試劑可獲得較好的靈敏度和回收率����。
化學(xué)衍生化法目前廣泛用于各類藥品相關(guān)物質(zhì)分析研究中��,除了其帶來的優(yōu)點(diǎn)之外�����,也有不可忽視的缺點(diǎn),如操作過程煩瑣����,重現(xiàn)性差,衍生化試劑形成的副產(chǎn)物可能對色譜分離造成較大困難��,引入雜質(zhì)或干擾峰����,造成樣品損失等�����。因此,選擇適當(dāng)?shù)那疤幚砑夹g(shù)是建立理想的分析方法的前提��,為下一步選擇合理的分析檢測儀器打下基礎(chǔ)����。
4. 2 高效液相色譜法
高效液相色譜法( HPLC) 是檢測不易揮發(fā)或熱不穩(wěn)定 GTIs 的常用方法��,通常需要從樣品處理��、色譜柱����、柱溫�����、流動相��、梯度比例����、檢測器等各方面對方法進(jìn)行優(yōu)化,以滿足 GTIs 的痕量檢測需求�����。其常聯(lián)用的檢測器包括紫外檢測器����、二極管陣列檢測器����、質(zhì)譜檢測器�����、帶電氣溶膠檢測器和蒸發(fā)光散射檢測器等����。
4. 2. 1 紫外檢測器和二極管陣列檢測器
紫外檢測器( UV 檢測器) 作為最常見的液相色譜聯(lián)用檢測器,具有靈敏度高��,選擇性好和可檢測范圍廣的特點(diǎn)�����,由于其簡單且有效����,對于非揮發(fā)性 GTIs一般可將高效液相色譜 - 紫外檢測法( HPLC - UV)法作為首選��。二極管陣列檢測器( DAD) 原理與 UV檢測器相同�����,并且能夠進(jìn)行全波長掃描�����、檢測峰純度等操作,在建立不確定檢測波長的 GTIs 分析方法時具有優(yōu)勢�����。Griˇcar 等[26]建立了一種反相 HPLC - UV法以梯度洗脫測定沙坦類藥物中疊氮化物含量��,在波長 205 nm 處進(jìn)行紫外檢測,其檢測限可以達(dá)到0. 84 μg·g - 1�����,具有良好的選擇性和準(zhǔn)確性�����。芳基磺酸酯類 GTIs 沸點(diǎn)較高����,不宜用 GC 法測定�����,通常采用HPLC - DAD 法 測 定。García 等[27] 開 發(fā) 了 反 相HPLC - DAD法用來檢測氯哌斯汀芬地柞酸原料藥中的對甲基苯磺酸甲酯和 2 - 氯乙基對甲苯磺酸酯��,在227 nm 波長處檢測,其檢測限分別為 2. 1 μg·mL - 1和 2. 1 μg·mL - 1����,均低于氯哌斯汀芬地柞酸原料藥中 GTIs 的規(guī)定限值。由于部分 GTIs 超低水平的限度要求��,或者具有與 API 相同或者相似結(jié)構(gòu)的發(fā)色基團(tuán)�����,甚至缺少發(fā)色基團(tuán)��,使得 UV 檢測器往往不能提供足夠的靈敏度和選擇性�����,需要結(jié)合衍生化的手段對樣品進(jìn)行前處理�����,使其可以適用于 UV 檢測。Luo 等[28]建立了檢測氯霉素中痕量 4 - 硝基苯甲醛的衍生化 HPLC - UV 分析方法��,并且比較了 4 個硝基取代苯肼作為衍生化試劑的優(yōu)勢。結(jié)果顯示 3 -硝基苯肼衍生化物可以使得待測 GTI 吸收波長明顯紅移到 397 nm����,能最大限度地減少藥物基質(zhì)和衍生化試劑的干擾,提高了其靈敏度��,使得檢測限達(dá)到0. 009 μg·mL - 1。Wang 等[18]建立了一種衍生化法反相 HPLC - UV 測定原料藥中痕量肼的方法�����。該方法采用 2 - 羥基 - 1 - 萘醛作為衍生化試劑,與肼反應(yīng)生成具有發(fā)色基團(tuán)的腙類化合物�����,并遠(yuǎn)離原料藥的吸收波長范圍����,減少了基質(zhì)干擾�����,大大提高了方法的靈敏度和選擇性��。同 UV 檢測器一樣����,DAD 同樣可以選用衍生化手段來提高方法靈敏度。Hou 等[29]建立了一種衍生化 HPLC - DAD 法��,在溫和條件下采用 2 - 硝基苯肼作為衍生化試劑����,乙基二甲基胺丙基碳化二亞胺作為催化劑測定 8 個藥物中 6 個鹵代羧酸的含量,該方法的靈敏度�����、專屬性��、線性����、回收率及耐用性試驗(yàn)均符合要求��,檢測限為 0. 02 ~ 0. 05 μg·mL - 1����,為檢測高溫不穩(wěn)定且缺少發(fā)色團(tuán)的極性 GTIs提供了一種思路��。
4. 2. 2 MS 檢測器
HPLC-MS是一種檢測范圍廣的普適性分析方法�����,MS 檢測器因其具有較其他檢測器更高的靈敏度和特異性的特點(diǎn)����,常用于各類基因毒性雜質(zhì)的痕量檢測����。Zhang 等[30]采用HPLC-MS/MS法測定氟胞嘧啶中的 N,N-二甲基苯胺����,MRM 模式下對雜質(zhì)進(jìn)行定量分析,檢測限為0. 1ng·mL - 1����。Bhavani 等[31]建立了一種靈敏的LC - MS法測定阿扎那韋硫酸鹽藥物中的遺傳毒性雜質(zhì)2-[4( 吡啶-2-基) 芐基]肼羧酸酯,該方法檢測限低至 0. 3 μg·g-1�����,回收率在 96. 4%~ 100. 4% ����。Sun 等[32]在發(fā)現(xiàn)合成雷沙吉蘭時會引入 2 種炔丙基氨基甲酸酯類結(jié)構(gòu)的 GTIs����,建立了 HPLC - MS 法以測定其含量�����,該方法具有良好的特異性��、線性����、精密性和準(zhǔn)確性,其檢測限為 0. 07 ng·mL - 1����。Guo 等[33]利用 LC-MS 法測定 12 種磺酸鹽GTIs 的含量����,并對 2 種離子源 ESI 和 APCI 進(jìn)行了評價。結(jié)果表明 ESI 和 APCI 得到的 MS 結(jié)果在檢測限和相對豐度上都有很大的不同��。在 SRM 模式下選擇APCI 負(fù)離子模式可使檢測限更低��。在 ESI 電離條件下,GTIs 的前體離子[M + H]+ 容易被[M + NH4]+離子或[M + Na]+ 離子所競爭�����,導(dǎo)致其豐度降低��,靈敏度較差�����。
4. 2. 3 帶電氣溶膠檢測器和蒸發(fā)光散射檢測器
帶電氣溶膠檢測器( CAD) 和蒸發(fā)光散射檢測器( ELSD) 是近年來較新穎的檢測器�����,由于其檢測原理不受樣品的光學(xué)特性或者結(jié)構(gòu)特點(diǎn)所影響����,可以對不含發(fā)色基團(tuán)的樣品產(chǎn)生響應(yīng)而在藥物分析中得到了廣泛的應(yīng)用。Lecoeur 等[34]建立了 HPLC - ELSD法用于檢測鄰苯二甲酸二( 2 - 乙基己) 酯�����,并與超臨界流體色譜( SFC) - ELSD 法進(jìn)行了對比��,結(jié)果表明HPLC - ELSD 法比 SFC - ELSD 法更加準(zhǔn)確��。Abdelrahman 等[35]建立了一種 HPLC - CAD 法用于測定醋酸氫化可的松、福西地酸中的雜質(zhì)以及羥苯甲酸甲酯����,結(jié)果表明該方法具有良好的系統(tǒng)適用性、線性�����、回收率��、耐用性以及準(zhǔn)確性����。
4. 2. 4 超高效液相色譜法
超高效液相色譜( UPLC) 分離原理與 HPLC 一致,但 UPLC 具有耐高壓且柱填料粒徑更小的特點(diǎn)����,在痕量基因毒性雜質(zhì)檢測中提供了一種較 HPLC 分離度更好,靈敏度更高的分析思路�����。Reddy 等[36]測定了佐米曲普坦中的 4 個 GTIs�����,由于之前所報道HPLC 法分析時間長且分離效率低�����,作者重新建立了一種靈敏度高����、選擇性好的 UPLC - MS /MS 方法,采用 3. 0 μm 粒徑的 C8 柱��,可以同時分離和定量 4 個GTIs����,檢測限降至 75 μg·g - 1之下。Wang 等[37]開發(fā)了 UPLC - UV 法和柱切換 HPLC - UV 法檢測鹽酸沙普格雷中間體中的環(huán)氧化物 GTIs; 對比2 種方法發(fā)現(xiàn)����,UPLC 具有較高的靈敏度,而柱切換法可以較好地降低基質(zhì)效應(yīng)�����,柱切換 UPLC 法可以作為檢測具有嚴(yán)重的基體效應(yīng)和極低限度要求 GTIs 的一種新思路��。
4. 2. 5 親水作用色譜法
親水作用色譜( HILIC) 分離原理與 HPLC 一致,主要用作大多數(shù)極性化合物的分離檢測�����,例如磺酸類 GTIs�����。由于部分磺酸揮發(fā)性差�����,酸度強(qiáng)��,因此不適用常規(guī)的 GC - MS 法����,必要時需要進(jìn)行復(fù)雜的樣品前處理以保證達(dá)到所需的靈敏度。HILIC 法作為一種簡便 的 替 代 方 法����,近年來得到了廣泛的關(guān)注。Huang 等[38]建立了一種簡便靈敏的 HIPIC - ESI/MS方法用于測定痕量的 8 個烷基磺酸類 GTIs�����,該法選擇含正電荷官能團(tuán)的固定相以保持有機(jī)酸的穩(wěn)定性,提高了流動相中乙腈的含量以增強(qiáng) ESI/MS 信號強(qiáng)度�����,提高了整個方法的靈敏度��。HILIC 也可以檢測其他極性 GTIs����。Shackman[39]評估了甘氨酸��、苯丙氨酸和阿那匹韋中氮丙啶和 2 - 氯乙胺的含量����,建立了一種無需衍生化且測定快速的 HILIC - MS 法。結(jié)果表明 2 種目標(biāo)分析物的線性在 0. 5 ~ 10 mg·L - 1范圍內(nèi)良好��,且靈敏度����、重復(fù)性和準(zhǔn)確性均符合要求。Jain 等[40]建立了一種定量分析達(dá)伐吡啶中 5 個潛在芳香胺 GTIs 的 HILIC - UV 法�����,在波長 280 nm 進(jìn)行檢測,5 個 GTIs 的檢測限可以達(dá)到 7. 5μg·g - 1�����,具有良好的分離度����、線性及準(zhǔn)確性�����。
4. 3 氣相色譜法
氣相色譜( GC) 是檢測具有揮發(fā)性的 GTIs 常用方法之一��,相較于直接進(jìn)樣容易污染進(jìn)樣器和色譜柱����,GC 可以選擇性地將待測樣品揮發(fā)至密閉頂空空間進(jìn)樣,具有減少揮發(fā)性成分的損失和基質(zhì)效應(yīng)��,同時減少對進(jìn)樣器或色譜柱的污染�����。目前頂空分析技術(shù)主要包括靜態(tài)頂空( static headspace�����,SHS) 分析以及動態(tài)頂空( dynamic headspace,DHS) 分析等技術(shù)����。SHS 的原理是將供試品溶液置于恒溫密封的頂空樣品瓶中�����,使其中的揮發(fā)性組分逸出�����,在達(dá)到氣液或氣固分配平衡后�����,采集定量氣相部分進(jìn)入氣相色譜儀進(jìn)行分析����,通過測定樣品基質(zhì)上方的氣體成分來測定它們在原樣品中的含量[41]。Karine 等[42]開發(fā)了一種 SHS -GC - MS 法用于檢測原料藥合成過程中產(chǎn)生的甲磺酸乙酯��,該方法解決了直接進(jìn)樣導(dǎo)致的基質(zhì)污染問題��,并結(jié)合衍生化手段克服了甲磺酸乙酯可能會在進(jìn)樣口加熱分解的困難。與 SHS 相比����,DHS 則是通過惰性氣體連續(xù)吹掃樣品從而多次萃取其中的待測揮發(fā)組分,在吸附劑或冷阱中富集后再脫吸附��,用載氣載入色譜柱進(jìn)行分析測定。由于氣體的吹掃可以破壞密閉容器中氣液兩相的平衡�����,使揮發(fā)成分不斷地從液相進(jìn)入氣相而被吹掃出來��,因此幾乎可把全部被測物萃取出來����,具有取樣量少����,富集效率高��,受基體干擾小等優(yōu)點(diǎn)�����,一般情況下比靜態(tài)頂空法靈敏度更高,適用于痕量基因毒性雜質(zhì)的檢測�����。Tore 等[43]采用 DHS- GC-MS法測定鹽酸奇霉素原料藥中的環(huán)氧乙烷�����,并對吹掃捕集過程進(jìn)行了優(yōu)化��,其檢測限較直接進(jìn)樣法及靜態(tài)頂空法降低了約 2~ 3個數(shù)量級。除了進(jìn)樣方式之外��,還可以通過選擇合適的檢測器來提高方法的靈敏度�����。GC 常聯(lián)用的檢測器包括氫火焰離子檢測器�����、電子俘獲檢測器和質(zhì)譜檢測器等�����。
4. 3. 1 氫火焰離子檢測器
氫火焰離子檢測器( FID) 適用于有機(jī)化合物的常量到痕量分析��,它的簡便性使其成為檢測揮發(fā)性有機(jī)分子的首選,是目前GC必備的檢測器之一����。由于磺酸酯類基因毒性雜質(zhì)檢測時易出現(xiàn)遇水分解的現(xiàn)象����,具有一定揮發(fā)性的磺酸酯類GTIs 可以采用GC-FID法進(jìn)行分析����。Schulz 等[44]采用 HS-GC-FID 聯(lián)用技術(shù)測定丙谷胺片中的痕量基因毒性雜質(zhì)4 - 氯苯胺����,檢測出片劑中 其含量僅為9. 5 ng�����。Daoud 等[45]運(yùn)用酸化乙醇作為衍生化試劑����,建立了一種 SHS-GC-FID檢測藥物輔料中甲醛的分析方法,檢測限為 2. 44 μg·g-1�����。FID 雖然是目前應(yīng)用最廣泛氣相色譜檢測器�����,然而對于檢測極低限度 GTIs的選擇性和靈敏度在一定程度上都受到限制��,并且FID 對含雜原子的有機(jī)化合物響應(yīng)值偏低����,因此其靈敏度不一定能滿足檢測需求�����。張萌萌等[46]采用 GC分別聯(lián)用 FID��、電子俘獲檢測器和 MS 3 種檢測器的方法測定甲磺酸達(dá)比加群酯中的甲磺酸乙酯和甲磺酸異丙酯��,對比評價了不同檢測器的靈敏度及空白干擾性并進(jìn)行樣品測定,結(jié)果表明 FID靈敏度不及MS檢測器和 ECD����,無法檢測出樣品中所含甲磺酸酯類 GTIs。
4. 3. 2 電子俘獲檢測器
電子俘獲檢測器( ECD) 常用于分析痕量電負(fù)性化合物��,例如鹵代烴��、金屬有機(jī)化合物����、共軛雙鍵化合物以及含磷、硫�����、羥基�����、硝基化合物等�����。在 GTIs 分析檢測中��,常用 GC - ECD 技術(shù)檢測揮發(fā)性鹵代烴。Skett 等[47]利用 GC - ECD 聯(lián)用法檢測并評估了一系列短鏈烷基鹵化物的靈敏度����,并證明待測氯化物、溴化物�����、碘化物的響應(yīng)值隨其組分的電負(fù)性增強(qiáng)依次增加��。由此可見��,ECD 檢測含溴和含碘的烷烴化合物靈敏度更高��,且適用于含有多個鹵原子的 GTIs����。除了烷基鹵化物之外����,ECD 也適用于鹵代芳香烴以及硝基芳香烴的檢測。Ho 等[48]用 HS - GC - ECD法測定了高沸點(diǎn)鹵代烷烴�����、鹵代芳香烴以及硝基芳香烴等一系列 GTIs����,進(jìn)一步擴(kuò)大了 HS - GC - ECD法的適用范圍及靈敏度,檢測限最低可以達(dá)到 0. 0025 μg·g - 1����。ECD 同樣適用于檢測磺酸酯類基因毒性雜質(zhì)。張倩穎等[49] 采取原位衍生 化 GC - ECD法�����,檢測甲磺酸伊馬替尼中 3 個磺酸酯類 GTIs�����,定量限最低為 0. 0025 μg·mL - 1����。雖然 ECD 泛適用于電負(fù)性化合物,然而其對不含電負(fù)性基團(tuán)的成分無信號或者信號很小����,并且對部分鹵化物的選擇性較差��。
4. 3. 3 MS 檢測器
GC- MS也常用于易揮發(fā)性基因毒性雜質(zhì)的痕量檢測�����,當(dāng)其他檢測器的靈敏度和選擇性無法滿足檢測需 求 時����,通常首先考慮選用 MS 檢測器����。Liu等[50]探討了 HS- GC 聯(lián)用 ECD 和 MS 檢測器測定氯甲烷和氯乙烷,結(jié)果表明 2 個氯化物在色譜柱中分離度較差�����,并且在相同條件和濃度下��,聯(lián)用 ECD 無法檢測出氯乙烷��,但是聯(lián)用 MS 檢測器選擇 SIM 模式檢測 m /z 64 離子時�����,其信噪比為 109�����,表明在烷烴的一氯代物的檢測中����,HS - GC - MS 法的靈敏度和特異性明顯高于 HS-GC-ECD 法。GC-MS 分析磺酸酯類 GTIs 也有較高的靈敏度�����。Liu 等[51] 建 立 了GC - MS /MS法測定藥物中 9 個常見磺酸酯類 GTIs含量��,采用 MRM 模式分別提取 9 個 GTIs 的離子對可有效降低基體效應(yīng)�����,定量限在 0. 10 ~ 1. 05 ng·mL - 1范圍內(nèi)����,低于其他方法( 2. 5 ~ 1 500 ng·mL-1) 。除此之外�����,MS 檢測器在檢測沒有發(fā)色基團(tuán)的 GTIs 上也具有優(yōu)勢。Chen 等[52]采用 GC - MS 法����,SIM 模式下檢測藥物合成工藝中引入的環(huán)氧化物 GTIs 的含量��。由于該藥物熱不穩(wěn)定��,作者通過優(yōu)化進(jìn)樣口溫度以降低基 質(zhì) 干 擾��,測得環(huán)氧化合物 GTI 的 LOD 為0. 001 4 μg·mL - 1�����,遠(yuǎn)低于依照 ICH M7 指南計算的限度����。Sun 等[53]建立了一種原位衍生 HS - GC - MS 法用于測定原料藥中的痕量肼,該方法使用丙酮或丙酮 - D6作為衍生化試劑��,能夠測定 1 ng·mg - 1水平的肼����。MS 檢測器因其高靈敏性及可廣泛應(yīng)用的特點(diǎn),成為檢測痕量 GTIs 的首選��。
4. 4 毛細(xì)管電泳法
毛細(xì)管電泳( CE) 是以毛細(xì)管為分離通道,高壓直流電場為驅(qū)動力的一種液相分離分析技術(shù)����,可用于藥物中痕量 GTIs 的富集和檢測��。Khan 等[54]建立了一種簡便快速的 CE 法用于測定 GTIs 硫酸二甲酯( DMS) 和氯乙酰氯( CAC) ��。DMS 和 CAC 在 pH 為5. 6 時均以單負(fù)離子存在��,在外加電場的作用下向陽極遷移��,省去了煩瑣的衍生化步驟����。van Wijk等[55]使用4 - 二甲氨基吡啶( DMAP) 或 1 - (4-吡啶基)哌啶-4-甲酸正丁酯( BPPC) 作為衍生化試劑,富集待測物后聯(lián)用CE - MS 法測定了4個鹵代烷烴GTIs��。結(jié)果表明����,CE-MS 預(yù)富集法的靈敏度較LC-MS法更高。雖然這2種方法都適用于GTIs 的痕量 分 析��,但在這4種鹵代烷烴 GTIs 檢 測 中����,CE-MS法更好地利用了衍生化產(chǎn)物的特性�����,提高了檢測的特異性和樣品的分離效率����。
4. 5 超臨界流體色譜法
超臨界流體色譜( SFC) 是一種以超臨界流體如二氧化碳等作為流動相��,調(diào)節(jié)其溶劑化能力以達(dá)到分離分析目的的方法����。SFC 通過改變溫度和壓力等參數(shù)來控制超臨界流體轉(zhuǎn)化為氣體、液體或保持其超臨界流體狀態(tài)����,可以聯(lián)用各類 LC 或 GC 的檢測器,具有分離效率高及分析時間短等優(yōu)點(diǎn)��,為理化性質(zhì)各異的GTIs 分析提供新的分析思路�����。Schmidtsdorff等[56]建立了一種用 SFC 聯(lián)用二極管陣列( photodiodearray,PDA) 檢測器以及質(zhì)譜檢測器技術(shù)檢測沙坦類藥物中 10 個亞硝胺類 GTIs 的方法�����,PDA 掃描記錄190 ~ 400 nm 范圍并在 230 nm 下進(jìn)行測定�����,MS 檢測器在 SRM 模式下對待測 GTIs 進(jìn)行定量分析��,其檢測限值在 0. 22 ~ 4. 55 ng·mL - 1范圍內(nèi)��,靈敏度與 FDA和 EMA 發(fā)布的 LC 法和 GC - MS /MS 方法相當(dāng)�����,但分析速度更快��,并且能夠一次性檢測多種與 API 相關(guān)的 GTIs����。Lecoeur 等[34]采用 SFC 法對多種致突變化合物和線性多環(huán)芳烴進(jìn)行檢測����,并且與 HPLC -ELSD 法作對比,結(jié)果表明 SFC 法的靈敏度更高。
4. 6 離子色譜法
使用離子色譜( IC) 法測量帶電離子如常見陰離子( 鹵素離子) 或常見陽離子( 銨離子) 時較其他分析手段分析時間更少�����,靈敏度更好����,因此烷基氯化物類和肼類 GTIs 均可考慮使用 IC 法進(jìn)行檢測。Harihara 等[57]建立了一種抑制電導(dǎo)離子色譜法檢測厄貝沙坦原料藥中的疊氮化合物��,與 GC - MS 法和反相 LC 法相比����,IC 法允許直接進(jìn)樣,避免了煩瑣的衍生或樣品處理�����,且 靈 敏 度 高����。Karthikeyan等[58]測定鹽酸司維拉姆中的丙烯胺( AAM) 含量,由于 AAM 的紫外吸收能力差����,且 SPE - HS - GC 法無法萃取完全等問題,作者選擇非抑制電導(dǎo)檢測的IC 法,省去了衍生化的過程��,可以直接檢測質(zhì)子化形式的有機(jī)胺����,并利用陽離子抑制器提高了方法的靈敏度。除 此 之 外��,該方法一針運(yùn)行時間小于8 min����,節(jié)省了檢測成本。
五��、總結(jié)
基因毒性雜質(zhì)是近年來的研究熱點(diǎn)����。對于雜質(zhì)的基因毒性評估應(yīng)從藥物的合成�����、生產(chǎn)及貯存過程入手�����,通過分析不同雜質(zhì)的結(jié)構(gòu)特點(diǎn)及理化性質(zhì)判斷其中可能引入的潛在的基因毒性雜質(zhì),結(jié)合數(shù)據(jù)庫文獻(xiàn)查詢��、QSAR 評估和遺傳毒性試驗(yàn)對其進(jìn)行分類����,根據(jù)指南中明確的不同類別雜質(zhì)可接受攝入量計算方法確定其合理限度,并建立起滿足靈敏度����、專屬性、穩(wěn)定性�����、準(zhǔn)確性的分析方法并進(jìn)行驗(yàn)證。
Adrian 等[59]對 H1 抗組胺藥鹽酸西替利嗪合成過程中可能產(chǎn)生潛在基因毒性雜質(zhì)的風(fēng)險作出了詳盡的評估�����,包括涉及到的起始物料�����、溶劑����、催化劑��、可能產(chǎn)生的中間體等各項可能引入基因毒性雜質(zhì)的途徑����。在確認(rèn)這些雜質(zhì)無法在過程中被完全清除且可能引入到終產(chǎn)品中后����,作者根據(jù)其是否具有警示結(jié)構(gòu)或是否有相關(guān)毒理學(xué)數(shù)據(jù)等對雜質(zhì)進(jìn)行分類并制定了限度。最后�����,作者建立了 HPLC - MS 法對 1 批鹽酸西替利嗪及其雜質(zhì)進(jìn)行了檢測��,為進(jìn)一步提出合理的控制策略提供支持����。在 Adrian 等[59]研究中�����,作者依據(jù)化學(xué)知識以及對合成途徑的充分理解,對可能引入的基因毒性雜質(zhì)及其轉(zhuǎn)入終產(chǎn)品的理論風(fēng)險評估作出了合理的預(yù)測; 但是研究仍有不足之處:作者并未對潛在基因毒性雜質(zhì)進(jìn)行充分的危害性評估��。在確認(rèn)該潛在遺傳毒性雜質(zhì)可能引入到終產(chǎn)品之后����,僅僅通過警示結(jié)構(gòu)對雜質(zhì)進(jìn)行分類是不合理的,有可能會對雜質(zhì)進(jìn)行錯誤的分類�����,以至于建立的雜質(zhì)限度并不合理��。目前的基因毒性雜質(zhì)研究中�����,有部分研究人員在發(fā)現(xiàn)了具有警示結(jié)構(gòu)的雜質(zhì)后便將其定性為基因毒性雜質(zhì)進(jìn)行控制��,這樣做有可能會將一般雜質(zhì)誤定為遺傳毒性雜質(zhì)�����,從而一味降低限度�����,除了把資源浪費(fèi)在開發(fā)高敏感性分析方法之外,也造成了工藝開發(fā)過程中雜質(zhì)控制困難��,消耗不必要的成本等問題����。因此,參照 ICH M7 ( R1) 以及ICH S2( R1) 等指導(dǎo)原則對雜質(zhì)進(jìn)行充分的遺傳毒性危害性評估是必要的�����。
對雜質(zhì)的基因毒性研究應(yīng)不僅僅停留在確定其遺傳終點(diǎn)和限度要求上�����,還應(yīng)結(jié)合質(zhì)量標(biāo)準(zhǔn)����,考慮如何建立科學(xué)的基因毒性雜質(zhì)控制策略。例如采取優(yōu)化相關(guān)工藝步驟或參數(shù)����,建立中間體驗(yàn)收標(biāo)準(zhǔn)����,開發(fā)高效的純化方法等手段去除終產(chǎn)品中的遺傳毒性雜質(zhì)或者將其降低至可接受的限度����,充分理解質(zhì)量源于設(shè)計( quality by design�����,QbD) 理念����,保證和提高藥品質(zhì)量。
參考文獻(xiàn)
[1] SZEKELY G��,AMORES DE SOUSA MC�����,GIL M��,et al. Genotoxic impurities in pharmaceutical manufacturing: sources�����,regulations�����,and mitigation[J]. Chem Rev,2015�����,115( 16) : 8182
[2] MÜLLER L��,MAUTHE RJ�����,RILEY CM�����,et al. A rationale for determining�����,testing�����,and controlling specific impurities in pharmaceuticals that possess potential for genotoxicity[J]. Regul ToxicolPharmacol��,2006,44( 3) : 198
[3] ICH M7( R1) . Assessment and Control of DNA Reactive ( Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk[EB /OL]. ( 2017 - 05 - 31) [2020 - 02 - 03]. https: / /database. ich. org /sites/default /files/M7_R1_Guideline. pdf
[4] USA National Library of Medicine National Institutes of Health[EB /OL]. ( 2019 - 12 - 05) [2020 - 02 - 03]. https: / /www. nlm. nih. gov /databases/download /toxlinesubset. html
[5] CUNNINGHAM AR��,ROSENKRANZ HS��,ZHANG YP����,et al. Identification of genotoxic and non - genotoxic alerts for cancer inmice: the carcinogenic potency database[J]. Mutat Res����,1998,398( 1 - 2) : 1
[6] 祝清芬��,魏霞�����,耿雪��,等 . 左羥丙哌嗪和羥苯磺酸鈣中 2 個 1類雜質(zhì)的遺傳毒性( Q) SAR 評價及質(zhì)控限度評估[J]. 藥物分析雜志����,2018,38( 2) : 354 ZHU QF�����,WEI X,GENG X��,et al. Assessment and control of two class 1 genotoxic impurities in levodropropizine and calcium dobesilate[J]. Chin J Pharm Anal����,2018,38( 2) : 354
[7] ICH S2( R1) . Guidance on Genotoxicity Testing and Data Inter pretation for Pharmaceuticals Intended for Human Use[EB /OL].( 2011 - 12 - 09) [2020 - 02 - 03]. https: / /database. ich. org /sites/default /files/S2%28R1%29%20Guideline. pdf
[8] TAKUMI A��,KAWAMATA Y����,SAKAI R,et al. In vitro and in vivo genotoxicity studies on monosodium L - glutamate monohydrate[J]. Regul Toxicol Pharmacol����,2019,107: 104399
[9] European Medicines Agency. Guideline on the Limits of Genotoxic Impurities[EB/OL]. ( 2006 - 06 - 28) [2020 - 02 - 03].www. emea. europa. eu /docs/en_GB /document_library /Scientific_guideline /2009 /09 /WC500002903. pdf
[10] European Directorate for Quality and Medicines & Health Care( EDQM) . Methyl��,Ethyl and Isopropyl Methanesulfonate in MethanesulfonicAcid[ EB /OL ] .[ 2020. 02. 03 ] .
https: / /www. edqm. eu /sites/default /files/publication_calendar_for_the_9th_edition_pheur. pdf
[11] CUI Y�����,LIU D��,BIAN J,et al. Dispersive liquid - liquid microex traction with high - performance liquid chromatography for the analysis of 1�����,4 - benzodioxane - 6 - aldehyde in eliglustat tartrate active pharmaceutical ingredient[J]. J Pharm Biomed Anal����,2020����,179: 112988
[12] DURAK BY,CHORMEY DS��,F(xiàn)IRATM�����,et al.Validation of ultrasonic- assisted switchable solvent liquid phase microextraction for trace determination of hormones and organochlorine pesticides by GC - MS and combination with QuEChERS[J]. Food Chem����,2020,305: 125487
[13] PENG XT��,ZHAO X��,F(xiàn)ENG YQ. Preparation of phenothiazinebonded silica gel as sorbents of solid phase extraction and their application for determination of nitrobenzene compounds in environmental water by gas chromatography - mass spectrometry[J]. JChromatogr A,2011����,1218( 52) : 9314
[14] TZANAVARAS PD,THEMISTOKLEOUS S�����,ZACHARIS CK. Automated fluorimetric determination of the genotoxic impurity hydrazine in allopurinol pharmaceuticals using zone fluidics and on - line solid phase extraction[J]. J Pharm Biomed Anal��,2020�����,177: 112887
[15] COLÓN I����,RICHOLL SM . Determination of methyl and ethyl esters of methanesulfonic�����,benzenesulfonic and p - toluenesulfonic acids in active pharmaceutical ingredients by solid - phase micro extraction( SPME) coupled to GC/SIM - MS[J]. J Pharm Biomed Anal,2005�����,39( 3 - 4) : 477
[16] ZHOU J,XU J����,ZHENG X,et al. Determination of methyl meth anesulfonate and ethyl methanesulfonate in methanesulfonic acid by derivatization followed by high ‐ performance liquid chromatography with ultraviolet detection[J]. J Sep Sci�����,2017�����,40( 17) : 3414
[17] LI M�����,GU C��,LUO L��,et al. Determination of trace methanesul fonates in drug matrix using derivatization and headspace single drop microextraction followed by high - performance liquid chromatography with ultraviolet detection[J]. J Chromatogr A�����,2019��,1591: 131
[18] WANG J��,YANG S��,ZHANG K. A simple and sensitive method to analyze genotoxic impurity hydrazine in pharmaceutical materials[J]. J Pharm Biomed Anal��,2016�����,126: 141
[19] CANAVESI R����,APRILE S,DEL GROSSO E����,et al. Semicarbaz ide hydrochloride as impurity in drug substances: a validated LC -DAD - UV method for its determination in carbazochrome and carbazochrome sodium sulfonate[J]. Chromatographia,2017�����,80( 10) : 1535
[20] LIU D Q�����,SUN M,KORD AS. Recent advances in trace analysis of pharmaceutical genotoxic impurities[J]. J Pharm Biomed Anal�����,2010����,51( 5) : 999
[21] BAI L,SUN M����,AN J��,et al. Enhancing the detection sensitivity of trace analysis of pharmaceutical genotoxic impurities by chemical derivatization and coordination ion spray - mass spectrometry[J]. JChromatogr A�����,2010����,1217( 3) : 302
[22] ZHENG X,LUO L����,ZHOU J��,et al. Development and validation of a generalderivatization HPLC method for the trace analysis ofacyl chlorides in lipophilic drug substances[J]. J Pharm BiomedAnal�����,2017��,140: 327
[23] WU L����,LIU DQ����,VOGT FG,et al. Gas - phase derivatization via the Meerwein reaction for selective and sensitive LC - MS analysis of epoxides in active pharmaceutical ingredients[J]. J Pharm Biomed Anal��,2011��,56( 5) : 1106
[24] WU X��,ZHU L�����,VISKY D����,et al. Derivatization of genotoxic nitroaromatic impurities for trace analysis by LC - MS[J]. AnalMethods����,2014,6( 18) : 7277
[25] VANHOENACKER G�����,DUMONT E��,DAVID F�����,et al. Determination of arylamines and aminopyridines in pharmaceutical products using in - situ derivatization and liquid chromatography - massspectrometry[J]. J Chromatogr A�����,2009�����,1216( 16) : 3563
[26] GRIˇCAR M����,ANDRENŠEK S. Determination of azide impurity insartans using reversed - phase HPLC with UV detection[J]. JPharm Biomed Anal,2016�����,125: 27
[27] GARCíA A����,RUPÉREZ FJ����,CEPPA F,et al. Development of chromatographic methods for the determination of genotoxic impurities in cloperastine fendizoate[J]. J Pharm Biomed Anal�����,2012�����,61: 230
[28] LUO L,GU C��,LI M����,et al. Determination of residual 4-nitrobenzaldehyde in chloramphenicol and its pharmaceutical for mulation by HPLC with UV /Vis detection after derivatization with 3 - nitrophenylhydrazine[J]. J Pharm Biomed Anal,2018��,156: 307
[29] HOU D����,F(xiàn)AN J����,HAN L�����,et al. Determination of small halogenated carboxylic acid residues in drug substances by high performance liquid chromatography - diode array detection following derivatization with nitro - substituted phenylhydrazines[J]. J Chromatogr A��,2016����,1438: 46
[30] 張云峰,錢建欽��,王建. HPLC - MS /MS 法分析氟胞嘧啶中痕量基因毒性雜 質(zhì) N�����,N - 二 甲 基 苯 胺[J]. 藥 物 分 析 雜 志��,2017�����,37( 2) : 265 ZHANG YF����,QIAN JQ����,WANG J. Determination of trace level ofgenotoxic impurity N, N - dimethylaniline in flucytosine byHPLC - MS /MS[J]. Chin J Pharm Anal��,2017����,37( 2) : 265
[31] SRINIVASU N��,RAMACHANDRAN D. Determination of genotoxic impurity in atazanavir sulphate drug substance by LC - MS[J].J Pharm Biomed Anal��,2017����,132: 156
[32] SUN Y,ZHANG X����,YAN Y,et al. Identification and genotoxicityevaluation of two carbamate impurities in rasagiline[J]. RSC Adv����,2016����,6( 108) : 106268
[33] GUO T,SHI Y�����,ZHENG L����,et al. Rapid and simultaneous determination of sulfonate ester genotoxic impurities in drug substance by liquid chromatography coupled to tandem mass spectrometry:comparison of different ionization modes[J]. J Chromatogr A,2014�����,1355: 73
[34] LECOEUR M��,DECAUDIN B����,GUILLOTIN Y,et al. Comparison of high - performance liquid chromatography and supercritical fluid chromatography using evaporative light scattering detection for thedetermination of plasticizers in medical devices[J]. J ChromatogrA�����,2015�����,1417: 104
[35] ABDELRAHMAN MM��,EMAM RA��,ALI NW����,et al. Novel eco -friendly chromatographic determinations of hydrocortisone acetate,
fusidic acid�����,their pharmacologically active impurities and pharma ceutical excipients: a comparative study[J]. Chem Pap��,2020����,74: 2175
[36] VIJAYA BHASKAR REDDY A,VENUGOPAL N��,MADHAVI G��,et al. A selective and sensitive UPLC - MS /MS approach for trace level quantification of four potential genotoxic impurities in zolmitriptan drug substance[J]. J Pharm Biomed Anal��,2013��,84: 84
[37] WANG R�����,ZHU Z��,QIU X,et al. Determination of epoxide impurity in sarpogrelate hydrochloride intermediate by UHPLC and column - switching liquid chromatography[J]. J Pharm Biomed Anal����,2019,174: 57
[38] HUANG Z��,F(xiàn)RANCIS R�����,ZHA Y����,et al. Development of a simple method for quantitation of methanesulfonic acid at low ppm level using hydrophilic interaction chromatography coupled with ESI - MS[J]. J Pharm Biomed Anal����,2015,102: 17
[39] SHACKMAN JG. Rapid�����,direct�����,and sensitive determination of aziridine and 2 - chloroethylamine by hydrophilic interaction liquid chromatography - mass spectrometry[J]. MethodsX,2019����,6: 2176
[40] JAIN M��,SRIVASTAVA V����,KUMAR R,et al. Determination of five potential genotoxic impurities in dalfampridine using liquid chromatography[J]. J Pharm Biomed Anal��,2017����,133: 27
[41] RODINKOV OV,BUGAICHENKO AS��,MOSKVIN LN. Static headspace analysis and its current status[J]. J Anal Chem����,2020,75(1) : 1
[42] JACQ K�����,DELANEY E,TEASDALE A�����,et al. Development and validation of an automated static headspace gas chromatography-mass spectrometry ( SHS - GC - MS) method for monitoring the formation of ethyl methane sulfonate from ethanol and methane sulfonic acid[J]. J Pharm Biomed Anal����,2008,48( 5) : 1339
[43] RAMSTAD T����,MILLER LS��,THOMAS VN. Determination of residual ethylene oxide in spectinomycin hydrochloride bulk drug by dynamic headspace gas chromatography[J]. J AOAC Int����,1993,76( 2) : 313
[44] SCHULZ K�����,OBERDIECK U�����,WEITSCHIES W. Degradation products of proguanil—4 - chloroaniline and related components with regard to genotoxicity[J]. Chem Pap,2013����,67( 6) : 657
[45] DAOUD AGHA DIT DAOUDY B,AL - KHAYAT MA����,KARA BET F,et al. A robust static headspace GC - FID method to detect and quantify formaldehyde impurity in pharmaceutical excipients[J]. J Anal Methods Chem�����,2018: 4526396
[46] 張萌萌�����,姚曉華�����,蔣元森��,等. 不同檢測器 - 頂空氣相色譜法測定甲磺酸達(dá)比加群酯中的甲磺酸乙酯和甲磺酸異丙酯[J].中國醫(yī)藥工業(yè)雜志����,2015�����,46( 10) : 1108 ZHANG MM����,YAO XH�����,JIANG YS����,et al. Comparison on different detectors for the determination of ethyl and isopropyl methane sulfonate in dabigatran etexilate mesylate by headspace gas chroma-tography[J]. Chin J Pharm��,2015����,46( 10) : 1108
[47] SKETT P W,SMITH RJ����,WEBB ML. Low - level measurement of potent toxins[J]. Anal Drug Impurities,2007,1: 82
[48] HO TD����,YEHL PM,CHETWYN N P����,et al. Determination of trace level genotoxic impurities in small molecule drug substances using conventional headspace gas chromatography with contemporary ionicliquid diluents and electron capture detection[J]. J Chromatogr A,2014��,1361: 217
[49] 張倩穎�����,馮芳 . GC - ECD 法檢測甲磺酸伊馬替尼中甲磺酸烷基酯[J]. 廣州化工����,2018,46(9) : 66ZHANG QY��,F(xiàn)ENG F. Determination of alkyls methanesulfonatein imatinib mesylate by GC - ECD[J]. Guangzhou Chem Ind�����,2018����,46( 9) : 66
[50] LIU DQ,SUN M��,KORD AS. Recent advances in trace analysis ofpharmaceutical genotoxic impurities[J]. J Pharm Biomed Anal�����,2010��,51( 5) : 999
[51] LIU Z�����,F(xiàn)AN H��,ZHOU Y�����,et al. Development and validation of a sensitive method for alkyl sulfonate genotoxic impurities determination in drug substances using gas chromatography coupled to triplequadrupole mass spectrometry[J]. J Pharm Biomed Anal�����,2019�����,168: 23
[52] CHEN L�����,ZHANG W��,HU S. Determination of genotoxic epoxideat trace level in drug substance by direct injection GC /MS[J]. J Pharm Biomed Anal,2017��,146: 103
[53] SUN M��,BAI L��,LIU DQ. A generic approach for the determination of trace hydrazine in drug substances using in situ derivatization - headspace GC - MS[J]. J Pharm Biomed Anal,2009����,49(2) : 529
[54] KHAN M,JAYASREE K����,REDDY KK��,et al. A validated CEmethod for determining dimethylsulfate a carcinogen and chloroacetyl chloride a potential genotoxin at trace levels in drug substances[J]. J Pharm Biomed Anal��,2012�����,58: 27
[55] VAN WIJK AM��,NIEDERLÄNDER HAG����,VAN OGTEN MD��,et al.Sensitive CE - MS analysis of potentially genotoxic alkylation compounds using derivatization and electrokinetic injection[J]. Anal ChimActa��,2015�����,874: 75
[56] SCHMIDTSDORFF S����,SCHMIDT AH. Simultaneous detection ofnitrosamines and other sartan - related impurities in active pharmaceutical ingredients by supercritical fluid chromatography[J]. JPharm Biomed Anal��,2019�����,174: 151
[57] SUBRAMANIAN NH��,BABU VR����,JEEVAN RG,et al. matrixelimination ion chromatography method for trace level azide determination in irbesartan drug[J]. J Chromatogr Sci�����,2009����,47( 7) :529
[58] KARTHIKEYAN K����,SHANMUGASUNDARAM P,RAMADHAS R����,et al. Development and validation of rapid ion - chromatographic method with conductivity detection for trace level determination of allylamine in sevelamer drug substances[J]. J Pharm Biomed Anal��,2011�����,54( 1) : 203
[59] LEISTNER A�����,HAERLING S��,KREHER JD�����,et al. Risk assessment report of potential impurities in cetirizine dihydrochloride[J]. J Pharm Biomed Anal����,2020��,189: 113425