摘 要 Abstract
為了給藥品上市后監(jiān)管提供技術支撐��,按照國家藥監(jiān)局統(tǒng)一部署��,國家藥監(jiān)局藥品審評中心制定了《已上市生物制品藥學變更研究技術指導原則(試行)》��,并于2021 年6 月發(fā)布��,受到了廣泛關注����。本文詳細論述了在基于風險進行分類管理的上市后監(jiān)管制度下,藥品質(zhì)量體系在變更中的重要作用����,明確了基于變更進行分類管理及開展相關研究的基本原則,并對幾個具有代表性的變更事項的分級及需要開展的技術研究進行了說明,以期加強指導原則的指導作用�����。
In order to provide technical support for regulation of post-approval pharmaceutical changes of biological products, the Center for Drug Evaluation drafted the Technical Guideline for Post-approval Pharmaceutical Changes of Biological Products (Trial), which has received extensive attention since its official release in June 2021. This paper discusses in detail the important role of pharmaceutical quality system in change management under post-marketing regulatory system and the basic principles of classification management and related research based on the change classification. In addition, this paper explains the classification of several representative change items and the technical research needed to be carried out, so as to strengthen the guiding role of the guiding principle.
近年來����, 隨著《藥品管理法》《疫苗管理法》《藥品生產(chǎn)監(jiān)督管理辦法》《藥品注冊管理辦法》《藥品上市后變更管理辦法(試行)》等一系列法律法規(guī)的頒布實施,我國藥品監(jiān)管領域法規(guī)體系建設更加科學和現(xiàn)代化����,對于藥品的管理更加強調(diào)全生命周期管理,對于已上市生物制品的藥學變更��,逐漸由既往基于事項的變更轉(zhuǎn)變?yōu)榛陲L險進行分類管理的模式�����,并且強調(diào)了藥品上市許可持有人(以下簡稱持有人)是上市后變更管理的責任主體��。這種監(jiān)管模式的轉(zhuǎn)變更有利于激發(fā)企業(yè)上市后自主變更的主動性��,使企業(yè)可以更靈活地基于風險和企業(yè)實際進行上市后藥學變更管理����,從而有助于實現(xiàn)生物制品的全生命周期管理,保障生物制品上市后供應。為了給藥品上市后監(jiān)管提供技術支撐�����,按照國家藥監(jiān)局統(tǒng)一部署��,國家藥監(jiān)局藥品審評中心起草了《已上市生物制品藥學變更研究技術指導原則(試行)》(以下簡稱《變更指導原則》)����,明確了藥學變更分類及開展相關技術研究等內(nèi)容[1]。筆者在此對在《變更指導原則》起草�����、宣貫過程中公眾普遍關心或者比較疑惑的上市后變更問題進行論述��,以供參考����。
1��、穩(wěn)健的藥品質(zhì)量體系是基于風險的上市后變更管理的前提
藥品質(zhì)量體系(pharmaceutical quality system����,PQS)的建立和完善貫穿于藥品的整個生命周期。在全生命周期的各個階段, 使用基于科學和風險的方法對生物制品進行管理��,可促進整個生命周期的持續(xù)改進��。穩(wěn)健的PQS 不僅能保證在受控的藥品生產(chǎn)質(zhì)量管理規(guī)范(Good Manufacturing Practice of Medical Products��,GMP) 條件下獲得符合要求的產(chǎn)品�����,還意味著持有人具備較為完善的知識管理和質(zhì)量風險管理能力��。具備有效的PQS�����,是實施生物制品上市后藥學變更的前提和必要條件[2]�����。對于生物制品的上市后藥學變更�����,PQS 的重要作用具體表現(xiàn)在以下方面����。
首先����,持有人通過對生物制品前期研發(fā)資料�����、變更前開展的工藝驗證進行研究��,以及對既往生產(chǎn)經(jīng)驗和通過變更管理所獲得的產(chǎn)品和工藝知識的理解��,有助于更好地判斷擬開展變更的風險��。
其次�����,持有人應科學識別��、評估和控制潛在的變更風險����,從而合理地開展基于風險的變更分級和變更研究����。
再次����,上市后變更分為審批類變更����、備案類變更和報告類變更,所有上市后藥學變更驗證都應當符合GMP 要求����, 在PQS的變更管理體系中完成。
最后�����,持有人在變更完成后獲得的變更知識有助于促進工藝性能和產(chǎn)品質(zhì)量持續(xù)改進��,從而進一步強化PQS��。
需要注意的是����,生物制品上市后藥學變更情形復雜、種類繁多��,無法只通過一個技術指導原則來涵蓋所有變更情形。實際中存在大量變更需要在已經(jīng)建立的PQS 內(nèi)將持有人作為上市后變更的責任主體����,根據(jù)內(nèi)部變更分類原則、工作程序和風險管理標準�����,并結(jié)合產(chǎn)品特點����,參考有關技術指導原則,在充分研究��、評估和必要驗證的基礎上確定變更管理類別����。
2、上市后藥學變更分類及考量
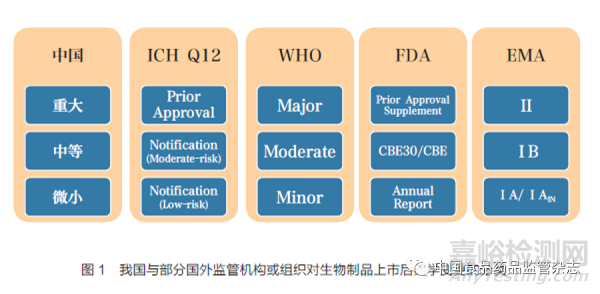
基于風險的上市后變更管理已在部分國家和地區(qū)實施多年��,鑒于我國尚缺乏足夠的經(jīng)驗����,在《變更指導原則》起草過程中����,起草小組廣泛查閱了國際人用藥品注冊技術協(xié)調(diào)會(the International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use�����,ICH)����、世界衛(wèi)生組織(World Health Organization����,WHO)、美國食品藥品監(jiān)督管理局(Food and Drug Administration�����,F(xiàn)DA)�����、歐洲藥品管理局(European Medicines Agency��,EMA)等組織或機構(gòu)發(fā)布的基于風險進行變更分類的相關指南�����,并結(jié)合我國既往變更監(jiān)管實際,對常見的生物制品上市后藥學變更事項進行了分類列舉�����。這一方面體現(xiàn)了現(xiàn)階段我國對變更事項的風險認知�����,另一方面也符合我國的監(jiān)管實際����。
《變更指導原則》按照對安全、有效和質(zhì)量可控的風險和產(chǎn)生影響的程度��,將已上市生物制品藥學變更依次分為重大變更�����、中等變更和微小變更��。我國與部分國外監(jiān)管機構(gòu)或組織對生物制品上市后變更的分類如圖1 所示[3-7]����。根據(jù)《藥品注冊管理辦法》��,變更應當相應地以補充申請、備案和年度報告的方式進行管理�����。除重大變更��、中等變更和微小變更外�����,通過以上方式進行管理的還有其他變更事項����,如對于新增制劑規(guī)格等需要發(fā)放新藥品批準文號的上市后變更,隸屬國家藥監(jiān)局職責范圍����,應當按照《藥品注冊管理辦法》相關要求申報補充申請[8]。此外��,部分藥學變更事項對生物制品的物質(zhì)基礎產(chǎn)生影響的可能性較大�����,如疫苗佐劑變更,應考慮按照《生物制品注冊分類及申報資料要求》中改良型相關類別進行申報[9]�����。為了充分體現(xiàn)基于風險的管理理念�����,隨著生物制品行業(yè)的發(fā)展以及持有人內(nèi)部管理經(jīng)驗的積累�����,持有人在確保內(nèi)部PQS 穩(wěn)健的前提下�����,可以根據(jù)《藥品上市后變更管理辦法(試行)》對目前《變更指導原則》中已經(jīng)確定的分類級別進行降級管理����,同時應與省級藥品監(jiān)管部門溝通,并在達成一致意見后實施����。對于疫苗、細胞治療產(chǎn)品等生物制品的上市后變更����,除參考《變更指導原則》開展研究外��, 另有規(guī)定和技術要求的, 也應遵照執(zhí)行����。
3、上市后藥學變更研究
《藥品上市后變更管理辦法(試行)》規(guī)定����,藥品上市后變更不得對藥品的安全性、有效性和質(zhì)量可控性產(chǎn)生不良影響�����。對于任何生物制品的上市后藥學變更����,均需要開展相應的變更研究來支持變更。
一般情況下����,持有人可以通過線性縮小規(guī)模對擬變更的工藝參數(shù)、新物料等開展研究�����,初步確定擬變更的參數(shù)范圍,但變更可比性研究一般應在商業(yè)化規(guī)模下完成��。生物制品變更可比性研究的開展可參考ICH Q5E[10]����。可比性研究是基于風險�����、數(shù)據(jù)驅(qū)動的全面評價����,開展變更可比性研究是進行已上市生物制品藥學變更評價的基礎和關鍵。對于已上市生物制品的藥學變更�����,產(chǎn)品可比性的確定可以藥學研究為基礎��。但當現(xiàn)有藥學數(shù)據(jù)對于確定可比性而言不充分時��,應開展相關的非臨床和(或)臨床研究來獲得補充性證據(jù)��,可能涉及的情況包括:可比性研究結(jié)果顯示變更前后存在差異,但持有人無充分的數(shù)據(jù)來證實該差異對于安全性��、有效性無不良影響����;藥學變化影響較大或部分生物制品本身較復雜時,僅通過藥學研究無法全面評價變更對安全性�����、有效性的影響��;變更前的藥學研究數(shù)據(jù)缺失����,無法確定可比性驗收標準��,無法評價藥學可比性����。在開展橋接研究方面,原則上�����,如果非臨床研究數(shù)據(jù)足以彌補藥學研究數(shù)據(jù)的不足,從而能夠獲得可比性結(jié)論時�����,則無需開展臨床研究��。但對于部分生物制品�����,由于缺乏合適的動物模型����,或動物模型與人體數(shù)據(jù)相關性不確定時,可能需要開展適宜的臨床橋接研究來確定變更的影響�����。
在開展變更可比性研究時��,研究批次與變更風險程度相關��。通常情況下�����,針對重大變更,至少需要利用變更后的工藝開展連續(xù)3 批商業(yè)化規(guī)模驗證����。在該階段,持有人一方面應根據(jù)工藝參數(shù)執(zhí)行情況和中間體監(jiān)測數(shù)據(jù)等��,對變更后的工藝穩(wěn)健性�����、外源因子控制能力�����、生產(chǎn)物料的循環(huán)次數(shù)����、中間體的暫存時間等進行確證��,另一方面應利用通過工藝驗證獲得的產(chǎn)品開展質(zhì)量和穩(wěn)定性可比性分析��,從而既能確保變更后工藝控制能力不降低��,又能證明變更前后的產(chǎn)品具有可比性��。在驗證批次數(shù)量方面,某些情況下可考慮適當減少驗證批次��。例如����,當存在多種不同裝量規(guī)格時,將同樣的原液分別灌裝不同裝量的制劑����,若原液工藝完全一致,持有人可考慮在原液階段開展至少連續(xù)3 批驗證��,在制劑階段結(jié)合裝量差異����,可以考慮采用括號法、矩陣法等來減少驗證批次����。同時,建議持有人提前與監(jiān)管機構(gòu)進行溝通交流�����,通過提供充分的依據(jù)支持括號法或矩陣法的使用��。
在目前我國實施的基于風險進行變更分類的變更管理模式下,持有人作為變更責任主體�����,其變更管理能力的高低直接決定變更管理的成敗����。對于已經(jīng)具有較完備的PQS 的企業(yè),現(xiàn)有的變更管理模式可以使持有人更加自主��、靈活�����、高效地結(jié)合實際開展變更管理�����;但對于變更風險識別經(jīng)驗不足����、既往藥品研發(fā)及生產(chǎn)中積累的工藝和產(chǎn)品相關知識缺乏的持有人����,若不能全面評估和識別變更風險�����,將會導致變更分類錯誤����,進而導致變更研究不足��,從而造成變更風險不可控����。因此,若持有人無法全面評估變更風險�����,建議參照《變更指導原則》�����,按照較高級別的要求開展相關研究�����,獲得的研究結(jié)果一方面有助于持有人對變更進行評估,另一方面積累了企業(yè)內(nèi)部知識����,有利于對產(chǎn)品全生命周期的變更管理。
4����、生物制品上市后藥學變更分類示例及技術要求解讀
4.1 表達載體的變更
利用重組表達技術生產(chǎn)的生物制品(包括重組蛋白制品、重組蛋白制品衍生物)通常需要在原核或真核表達系統(tǒng)中導入穩(wěn)定的表達載體����,選擇理想的單克隆后,建立三級種子庫或細胞庫�����,然后利用工作種子批或細胞庫進行發(fā)酵生產(chǎn)����。因此,一旦變更表達載體��,通常需要重新建立細胞庫�����,并需要對后續(xù)一系列工藝參數(shù)(可能包括生產(chǎn)用原材料)進行必要的調(diào)整����,影響范圍廣,且導致產(chǎn)品翻譯后修飾等質(zhì)量屬性發(fā)生改變的可能性較大��。由于該類變更風險較大��,凡是涉及表達載體變更的均屬于重大變更����。但即便是重大變更,表達載體的變更也有前提條件�����,即目的蛋白和宿主細胞均未改變����。設置該前提條件的含義包含兩個層面:一方面,改變表達載體的同時不能改變宿主細胞�����,是因為二者同時變更的影響程度和風險會進一步升高�,不僅會對目的蛋白本身的質(zhì)量屬性造成影響����,還會對殘留宿主蛋白�、殘留宿主DNA 等雜質(zhì)的種類和殘留量造成影響,僅通過變更研究可能無法全面評估其對產(chǎn)品安全性���、有效性的影響����,需要重新申報新的臨床試驗來評估產(chǎn)品的安全性���、有效性����;另一方面�,表達載體變更時不能對目的蛋白的序列造成改變,即不能增加或刪除標簽�、不能改變蛋白質(zhì)氨基酸序列,但通過同義突變對目的基因序列進行密碼子優(yōu)化以提高表達量���,不影響目的基因最終翻譯成的氨基酸序列是被允許的����。
持有人需要按照《變更指導原則》中相關技術要求開展變更研究和可比性分析�。需要說明的是,《變更指導原則》中“表達載體�、種子批及細胞庫”變更類別對應的1~14 條技術要求,并非對所有品種均適用�。例如,第11條技術要求規(guī)定�,“如涉及,更新種子批/ 細胞庫質(zhì)量標準�。提供變更種子批/ 細胞庫質(zhì)量標準的依據(jù)和檢驗結(jié)果。”若持有人未變更內(nèi)部的種子批/ 細胞庫的驗收標準����,則無需提供相關研究數(shù)據(jù)。只有發(fā)生了關聯(lián)變更的����,持有人才需要提交相關數(shù)據(jù)。如果表達載體變更后���,同時伴隨了生產(chǎn)工藝的變更����,持有人應當對相關變更進行明確����,提供變更前后工藝流程及工藝參數(shù)的對比內(nèi)容����,并且應當按照關聯(lián)變更的要求提供工藝變更的支持性數(shù)據(jù)����。應特別注意的是,一旦工藝參數(shù)變更影響了病毒去除/ 滅活工藝����,持有人還應開展病毒去除/ 滅活工藝再驗證,并重新參考ICH Q5A[11]的要求分析產(chǎn)品的病毒安全限度�。同理,如果伴隨設備變更�、生產(chǎn)用物料變更等,要參照《變更指導原則》相關變更事項���,針對各個變更分別開展變更研究���,同時商業(yè)化規(guī)模的可比性研究可以一并開展。
根據(jù)質(zhì)量源于設計(quality by design�,QbD)的研發(fā)理念,原則上�,在產(chǎn)品開發(fā)階段�,持有人應當從全生命周期的角度����,選擇最適宜的表達載體����。考慮到表達載體變更風險較大����,不鼓勵在上市后特別是在持有人對工藝和產(chǎn)品知識積累不足時開展表達載體變更。但隨著監(jiān)管政策完善�、科技進步、行業(yè)發(fā)展等���,某些產(chǎn)品確實面臨著必須變更表達載體的問題����。例如�,針對去除β- 內(nèi)酰胺類抗生素抗性,持有人應當開展充分�、全面的可比性研究,并且�,考慮到表達載體變更的風險較高�、影響范圍較廣���,通常建議持有人開展適當?shù)姆桥R床/ 臨床橋接研究�。
4.2 生產(chǎn)場地的變更
生產(chǎn)場地的變更可能涉及管理法規(guī)問題�,持有人需要根據(jù)相關法律法規(guī)要求,確保產(chǎn)地變更符合現(xiàn)有的相關法律法規(guī)要求���,參考《變更指導原則》進行變更研究����、確定變更級別�。對于疫苗的生產(chǎn)場地變更,應同時參考《疫苗生產(chǎn)場地變更質(zhì)量可比性研究技術指導原則》[12] 相關要求���。
由于生物制品場地變更可能伴隨設備���、物料、人員的變更���,可能會對生產(chǎn)工藝及控制�、質(zhì)量控制體系、產(chǎn)品質(zhì)量等產(chǎn)生影響���,通常認為變更風險較大�。在《變更指導原則》中�,涉及原液生產(chǎn)場地的變更包括重大變更和中等變更兩個級別;涉及制劑生產(chǎn)場地的變更包括重大變更����、中等變更和微小變更三個級別�。其中,原液和制劑生產(chǎn)場地的中等變更均需要滿足一定的前提條件���。設置相關前提條件的考慮因素主要包括:①變更前后的生產(chǎn)線(含生產(chǎn)用設備����、生產(chǎn)用原材料等)屬于完全復制���,這樣的變更不會引起工藝參數(shù)的變化���、不會因為生產(chǎn)用原材料的改變而引入額外的外源因子風險或新雜質(zhì)殘留、不會因為直接接觸材料的改變而引入新的浸出風險����、不會導致外源因子風險升高(如收獲液中逆轉(zhuǎn)錄顆粒數(shù)量不受影響)或無菌控制風險升高�;②變更前后的生產(chǎn)場地應受控于同一質(zhì)量體系�,無論是自主生產(chǎn)還是委托生產(chǎn),持有人均應承擔產(chǎn)品質(zhì)量控制體系主體責任�,應確保變更前后生產(chǎn)場地在工藝性能和產(chǎn)品質(zhì)量監(jiān)測、糾正和預防措施���、變更管理和管理回顧等方面均按照持有人建立的質(zhì)量體系規(guī)定執(zhí)行����;③對于不同類型生物制品(如血液制品�、傳統(tǒng)疫苗、治療用重組蛋白類產(chǎn)品)���,無論是在GMP 要求����、生產(chǎn)工藝方面����,還是在產(chǎn)品本身質(zhì)量控制方面,均差別較大�,若已有產(chǎn)自新生產(chǎn)場地的同類產(chǎn)品獲批,那么在GMP 執(zhí)行、生產(chǎn)工藝控制及產(chǎn)品質(zhì)量監(jiān)測方面就有可借鑒的經(jīng)驗�,因此相對風險較低。若不能滿足上述條件���,原液或制劑生產(chǎn)廠/ 廠房/ 生產(chǎn)線的變更均應按照重大變更管理�。另外�,雖然在滿足前提條件的情況下,在已獲批的制劑生產(chǎn)場地增加包裝線/ 貼簽線屬于微小變更���,但若涉及批準文件相關地址的修改���,應按照備案管理����。
在《變更指導原則》中,對于不同的變更類別���,生產(chǎn)場地變更研究的技術要求存在差異����。以原液生產(chǎn)場地變更為例����, 重大變更涉及的技術研究內(nèi)容包括1~18�、21 技術要求�,而中等變更涉及的技術研究內(nèi)容包括1~6、8����、10、13���、16�、17 技術要求���。由于中度變更不涉及規(guī)模���、工藝、生產(chǎn)用物料等的變更���,因此無需重新對細胞傳代穩(wěn)定性進行研究���,無需開展病毒去除/ 滅活工藝再驗證,無需重新開展色譜填料循環(huán)次數(shù)的研究�,無需重新對直接接觸材料的相容性進行研究����,無需開展不同設備變更所需的相關研究���。若無特殊規(guī)定����,除非現(xiàn)有藥學研究數(shù)據(jù)對于確定可比性研究而言不充分����,一般情況下,中等變更的技術研究內(nèi)容不涉及非臨床/ 臨床橋接研究���。
4.3 生產(chǎn)工藝的變更
在《變更指導原則》中�,工藝變更主要包括三大模塊:生產(chǎn)規(guī)模�、工藝程序和步驟�、工藝參數(shù)。所有工藝變更都應當證明變更后工藝控制能力不低于變更前工藝控制能力����,否則就不符合《藥品上市后變更管理辦法(試行)》中要求的“藥品上市后變更不得對藥品的安全性、有效性和質(zhì)量可控性產(chǎn)生不良影響”的要求[13]���。此外�,若變更與此前生產(chǎn)中重復發(fā)生的偏差或穩(wěn)定性問題相關,則意味著變更前工藝或產(chǎn)品穩(wěn)定性可能存在風險���,那么即使變更后工藝控制能力不降低�,變更風險也仍較高�。因為若變更沒有從根本上解決引起工藝或穩(wěn)定性研究偏差的問題,那么變更后工藝是否具備持續(xù)���、穩(wěn)健生產(chǎn)具有批間一致性產(chǎn)品的能力就需要全面的可比性研究來確證����。
除了上述工藝變更的風險���,進行工藝變更時還會因變更事項不同���,對風險有不同的考量,具體表現(xiàn)如下�。
對于生產(chǎn)規(guī)模變更,基于調(diào)研和實際審評經(jīng)驗����,與規(guī)模變更風險相關的因素一般包括:①規(guī)模的變更是否屬于線性變更����;②變更是否會增加外源因子風險或無菌控制風險���;③變更是否會對產(chǎn)品本身質(zhì)量及雜質(zhì)的種類和殘留量產(chǎn)生影響���;④變更是否會對病毒去除/ 滅活工藝產(chǎn)生影響。
對于工藝程序和步驟變更���,若在原液和制劑階段出現(xiàn)工藝步驟增加����、刪除或調(diào)換���,均應按照重大變更管理���。對于多組分疫苗、含佐劑疫苗等產(chǎn)品����,制劑配置過程中不同成分添加的先后順序會影響產(chǎn)品關鍵質(zhì)量屬性����,因此針對這些組分加入順序的變化���,也應當按照重大變更管理。
對于生產(chǎn)工藝參數(shù)變更���,相關風險因素的考量包括:①變更是否會影響病毒去除/ 滅活工藝����;②變更是否會對產(chǎn)品質(zhì)量或雜質(zhì)種類及殘留量產(chǎn)生影響�;③變更是否會影響無菌水平/ 微生物限度水平;④對于發(fā)酵工藝的變更����,還應考慮是否會影響傳代代次。一般情況下����,放寬、刪除����、改變關鍵工藝參數(shù)時,變更風險相對較高���,且在發(fā)生相關變更后����,若工藝控制能力降低,則該變更可能不會被批準����。
正常情況下,持有人基于既往工藝開發(fā)對相關知識的積累�,理應對工藝參數(shù)進行分類,并建立工藝參數(shù)與質(zhì)量屬性的相關性���。在此基礎上���,持有人應參考《變更指導原則》確定合理分級,并開展相應的技術研究���。若持有人既往積累的工藝開發(fā)知識不足以用來判斷工藝參數(shù)變化會如何影響相關風險因素�,則提示持有人需要開展更多的研究去全面評價變更的影響����。因此,即使是同樣的變更事項,由于不同持有人對相關知識的積累水平不同���、對風險的識別和控制能力不同,相應的�,確定變更級別及開展技術研究要求也可能存在差異。
4.4 質(zhì)量標準的變更
隨著國家藥品標準的提升�、持有人自身產(chǎn)品生產(chǎn)經(jīng)驗的積累、同類產(chǎn)品質(zhì)量的提升等�,生物制品上市后發(fā)生標準變更較為常見。鼓勵持有人持續(xù)提升藥品質(zhì)量標準�,藥品的注冊標準一般應不低于《中國藥典》標準,且不低于同類產(chǎn)品的標準�,藥品標準的變更不允許降低藥品的質(zhì)量控制能力及質(zhì)量。
一般情況下����,刪除質(zhì)量標準的控制項目、替換分析方法����、放寬標準限度的變更風險較大,若標準變更會導致質(zhì)量控制能力降低���,這類變更就不符合要求���。
如果按照其他關聯(lián)變更的要求����,需要刪除內(nèi)控標準的相關項目����,這類變更可能會符合要求。例如�,當在生產(chǎn)中不再使用牛血清或抗生素時,持有人將標準中相關殘留檢定項目刪除�,這種變更是可以被批準的,或者僅由于方法靈敏度提高���,導致可被檢出的雜質(zhì)含量超出已批準范圍時����,持有人在申請變更檢測方法的同時可要求修訂標準限度����。此外,由于生物制品本身理化性質(zhì)較為復雜���,其產(chǎn)品質(zhì)量是從工藝和放行不同層面進行控制的���,即便增加了標準項目�,但若增加的原因是出現(xiàn)了工藝偏差或產(chǎn)品中出現(xiàn)了新雜質(zhì)等���,也可能未從根本上解決問題����,變更風險仍較大����。
一般情況下����,建議持有人優(yōu)選《中國藥典》收錄的方法進行檢驗。若持有人開發(fā)的方法更具有產(chǎn)品特異性���,為能更好地表征產(chǎn)品質(zhì)量屬性����,在將《中國藥典》的方法向內(nèi)部方法變更時�,不建議按照中等變更管理。對于檢測方法為生物學/ 免疫學/ 免疫化學方法(《中國藥典》中的微生物檢測除外)的變更���,由于這類方法通常用于檢驗與安全性�、有效性相關的關鍵質(zhì)量屬性,且方法變異度較大���,涉及該類方法的變更風險均較大���。當發(fā)生相關變更時,應由中國食品藥品檢定研究院對相關變更標準進行單項標準復核和樣品檢驗���。若持有人內(nèi)部對檢測方法進行了調(diào)整(如調(diào)整樣品檢驗時長)�,且在內(nèi)部質(zhì)量體系中經(jīng)研究����、評估認為相關變更對方法學沒有影響,不涉及方法學實質(zhì)性變更且相關變更風險較小�,那么這種變更就可在內(nèi)部質(zhì)量體系中按照微小變更進行管理。
在變更質(zhì)量標準時�,雖然不涉及工藝變更,不需要開展工藝驗證���,但持有人應對歷史代表性工藝及產(chǎn)品放行����、穩(wěn)定性檢測數(shù)據(jù)進行分析,明確工藝能力和實際產(chǎn)品質(zhì)量屬性變化范圍����。一方面,持有人可以通過回顧為標準變更提供依據(jù)���;另一方面���,持有人應結(jié)合標準變更的內(nèi)容,分析變更對質(zhì)量控制能力的影響���。對于涉及方法學的變更,持有人應證明擬定分析方法與變更前方法等效或者更優(yōu)���。若質(zhì)量標準變化會影響穩(wěn)定性考察���,一方面,持有人應采用處于不同考察點的穩(wěn)定性留樣進行考察�,用修訂后的標準評估穩(wěn)定性研究結(jié)果;另一方面�,持有人應承諾以修訂后的方法和標準繼續(xù)進行長期穩(wěn)定性試驗,確保修訂后的標準和方法適用于監(jiān)測產(chǎn)品在貯藏期間穩(wěn)定性的變化情況�,且產(chǎn)品在貯藏期間的質(zhì)量穩(wěn)定性應符合變更后的標準限度�。
5�、良好的溝通交流有助于上市后藥學變更管理
由于生物制品本身理化性質(zhì)復雜,上市后變更情形更是復雜多樣����,目前我國基于風險的生物制品分類變更經(jīng)驗相對較少,且由于我國實行國家和省級藥品監(jiān)管部門兩級監(jiān)管���,良好的溝通對于上市后藥學變更管理而言十分重要����。
持有人可以根據(jù)需要����,就變更事項的級別及擬開展的變更研究、先進管理工具的使用等����,事先與監(jiān)管部門進行溝通交流,特別是對于重大變更����,持有人應當提前與監(jiān)管部門就變更風險、變更可比性研究等關鍵問題進行有效溝通���,從而更好地使雙方達成共識���,避免持有人走彎路�,進一步提高研發(fā)效率���。
6�、結(jié) 語
生物制品上市后變更較為復雜且廣受關注�。變更的分類是基于變更的風險進行的,持有人是上市后變更管理的責任主體�,需要結(jié)合《變更指導原則》的一般要求開展相關研究,并加強與監(jiān)管部門之間的溝通交流����。本文僅針對一般情況對《變更指導原則》進行了進一步的解釋����、說明,由于變更具有復雜性���,持有人還需要具體問題具體分析���,結(jié)合實際進行變更����。