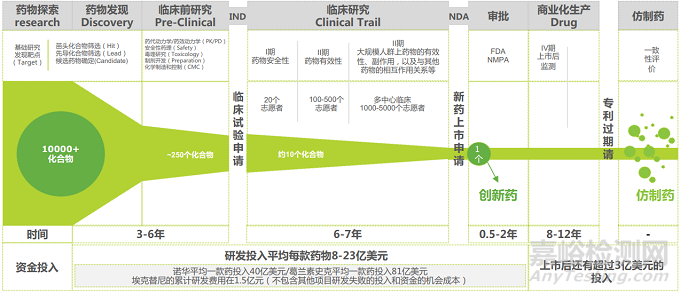
2015年以來(lái)�����,隨著一系列鼓勵(lì)新藥創(chuàng)制�����、提升藥品質(zhì)量��、促進(jìn)產(chǎn)業(yè)升級(jí)的政策出臺(tái),我國(guó)藥物研發(fā)開(kāi)始邁入創(chuàng)新藥階段����。隨著資本的大量涌入�����,創(chuàng)新藥也迎來(lái)了快速發(fā)展的時(shí)代。2018年以來(lái)�����,國(guó)家藥監(jiān)局受理并批準(zhǔn)上市的創(chuàng)新藥(不含中藥和疫苗)共64個(gè),數(shù)量逐年增長(zhǎng)����,適應(yīng)癥以抗腫瘤及免疫用藥�����、神經(jīng)系統(tǒng)用藥��、消化系統(tǒng)用藥為主��。2021年,國(guó)產(chǎn)創(chuàng)新藥獲批上市的品種數(shù)量達(dá)到30個(gè)��,在國(guó)家藥品評(píng)審中心(CDE)登記的創(chuàng)新藥相關(guān)臨床試驗(yàn)共501項(xiàng)�����,其中III期臨床共106個(gè)�����。未來(lái)幾年,我國(guó)創(chuàng)新藥上市將迎來(lái)爆發(fā)階段。
創(chuàng)新藥的研發(fā)從發(fā)現(xiàn)到上市包括臨床前研究��、臨床試驗(yàn)申報(bào)����、臨床試驗(yàn)(又分為臨床I期��、II期��、III期)����、上市申報(bào)、上市后商業(yè)化(IV期臨床)等階段��,是一個(gè)十分漫長(zhǎng)、復(fù)雜又充滿風(fēng)險(xiǎn)的過(guò)程。在上市前的研發(fā)過(guò)程中�����,隨著對(duì)化合物的藥理毒理作用��、藥效等方面研究的不斷深入����,研發(fā)者會(huì)對(duì)目標(biāo)化合物的藥用前景不斷進(jìn)行評(píng)價(jià)和評(píng)估,即是否值得繼續(xù)深入的開(kāi)發(fā),因?yàn)檫M(jìn)行全面的開(kāi)發(fā)費(fèi)用要高的多����,為了減少風(fēng)險(xiǎn),在這個(gè)階段研究隨時(shí)會(huì)停止��,目標(biāo)化合物隨時(shí)會(huì)被放棄����。
藥學(xué)(Chemistry, Manufacturing and Controls�����,化學(xué)����、制造和控制�����,簡(jiǎn)稱CMC)研究,包括藥物生產(chǎn)工藝研究����、雜質(zhì)研究、質(zhì)量研究����、穩(wěn)定性研究��、工藝驗(yàn)證等方面內(nèi)容,是藥物研發(fā)的重要組成部分��,對(duì)非臨床研究試驗(yàn)和臨床研究試驗(yàn)提供技術(shù)和物質(zhì)支持�����,貫穿于藥物研發(fā)及生產(chǎn)的全生命周期�����。
1、創(chuàng)新藥研發(fā)特點(diǎn)
創(chuàng)新藥的研發(fā)路徑漫長(zhǎng)����、投入大、風(fēng)險(xiǎn)高�����,一般而言����,首先要通過(guò)系統(tǒng)��、規(guī)范��、有針對(duì)性的臨床前研究、探索性臨床研究(臨床I期和II期)考察其成藥性��、劑量效應(yīng)以及初步的安全性(I期)�����、有效性(II期)等��,然后再通過(guò)確證性臨床研究(臨床III期)明確患者使用藥物的臨床獲益與安全性風(fēng)險(xiǎn)之間的關(guān)系即利益/風(fēng)險(xiǎn)比����。各個(gè)階段的研究目的不同����,研發(fā)和評(píng)價(jià)的重點(diǎn)也不同�����。對(duì)于I期臨床申請(qǐng),安全性是研發(fā)和評(píng)價(jià)的核心;對(duì)于II�����、III期臨床申請(qǐng)��,安全性和有效性并重��。而對(duì)于生產(chǎn)上市申請(qǐng),藥品的安全�����、有效、質(zhì)量可控����、生產(chǎn)放大可行性、經(jīng)濟(jì)性等均為研究和評(píng)價(jià)的核心��。
2��、創(chuàng)新藥CMC研究及評(píng)價(jià)特點(diǎn)
創(chuàng)新藥的研發(fā)是一個(gè)漸進(jìn)����、逐漸認(rèn)知的過(guò)程�����,創(chuàng)新藥的CMC研究也相應(yīng)地具有同樣的特點(diǎn),具體體現(xiàn)在:①伴隨臨床研究進(jìn)程分階段推進(jìn)�����。在臨床前和早期臨床研究階段,CMC研究主要是為以上研究提供質(zhì)量有保證的研究用樣品;隨著臨床研究的推進(jìn)�����,CMC研究則致力于確定穩(wěn)定、重現(xiàn)����、可工業(yè)化的生產(chǎn)工藝以及構(gòu)建完善的藥品質(zhì)量控制體系����。②結(jié)合臨床研究/治療需要��、放大生產(chǎn)需要以及對(duì)藥物認(rèn)識(shí)的不斷加深�����,對(duì)劑型��、規(guī)格��、處方工藝�����、分析方法�����、質(zhì)量標(biāo)準(zhǔn)等進(jìn)行調(diào)整優(yōu)化��。在創(chuàng)新藥研發(fā)進(jìn)程中,與藥學(xué)相關(guān)的變更幾乎是不可避免的�����,尤其是在早期開(kāi)發(fā)階段��,變更發(fā)生得較為頻繁����。比如對(duì)于口服制劑,I期臨床研究常常會(huì)考慮采用諸如溶液劑或藥物粉末直接填裝膠囊等最簡(jiǎn)單的劑型��,后續(xù)則會(huì)結(jié)合臨床治療的需要以及生產(chǎn)的可行性進(jìn)行劑型優(yōu)化�����。
總體而言�����,創(chuàng)新藥的CMC研究應(yīng)與藥物所處研發(fā)階段相適應(yīng),跨越研發(fā)階段過(guò)早完成過(guò)多的藥學(xué)研究工作可能會(huì)延緩研發(fā)進(jìn)程��,造成研發(fā)資源的浪費(fèi)����。另一方面�����,為了確保受試者的安全,又必須根據(jù)藥物所處研發(fā)階段獲取充分的研發(fā)數(shù)據(jù)支持風(fēng)險(xiǎn)評(píng)估和風(fēng)險(xiǎn)控制��。監(jiān)管機(jī)構(gòu)對(duì)于CMC研究信息的要求主要基于以下因素的考慮:臨床研究的階段、受試者的數(shù)量和研究周期、藥物結(jié)構(gòu)和作用機(jī)制的新穎性、劑型和給藥途徑��、已暴露和潛在的風(fēng)險(xiǎn)等��。
由于藥物研發(fā)的不同階段對(duì)CMC研究的要求不同,為了使CMC研究工作能支持藥物研發(fā)的順利推進(jìn)�����,但又不至于花費(fèi)過(guò)多的時(shí)間和資金����,不同的研發(fā)階段��,CMC研究的側(cè)重點(diǎn)應(yīng)有所不同����。本文以化學(xué)合成藥為例��,對(duì)新藥研發(fā)不同階段CMC研究的重點(diǎn)進(jìn)行簡(jiǎn)要闡述。
3����、不同研究階段的CMC研究重點(diǎn)
3.1 臨床前研究階段
一個(gè)藥物分子經(jīng)過(guò)早期的靶點(diǎn)研究��、分子設(shè)計(jì)、初步評(píng)價(jià)得到候選化合物后����,即進(jìn)入臨床前研究,主要包括藥理����、藥效�����、毒理、藥代����、藥動(dòng)等成藥性的評(píng)價(jià)。這個(gè)階段屬于藥物研發(fā)的初期,CMC主要以提供確切的試驗(yàn)樣品為主����,工藝打通、質(zhì)量初步可控即可�����。
(1)化合物的性質(zhì)
對(duì)化合物的性質(zhì)有初步的了解,為選擇劑型�����、處方提供依據(jù);另一方面了解化合物的穩(wěn)定性�����,選擇合適的包裝方式和儲(chǔ)存條件����,確保藥物在研究過(guò)程中的穩(wěn)定��。
(2)劑型�����、處方和規(guī)格
首選要確定藥物的給藥途徑,對(duì)于需要采用制劑進(jìn)行的試驗(yàn)��,在給藥途徑相同的情況下��,可以選擇比較簡(jiǎn)單的劑型:如口服制劑可以溶液劑或藥物粉末直接填裝膠囊等簡(jiǎn)單的劑型,皮下注射劑可以采用注射液代替注射筆,等等��。根據(jù)原料藥的溶解性����、穩(wěn)定性等性質(zhì)初步確定制劑處方��,如需要添加什么輔料等��。根據(jù)毒理試驗(yàn),初步擬定制劑的規(guī)格�����,可以根據(jù)需要設(shè)計(jì)多個(gè)規(guī)格��。
(3)工藝
此階段以提供滿足試驗(yàn)需要的原料藥和制劑為主要目的�����,確定化合物的合成路線并合成原料藥��,原料藥在實(shí)驗(yàn)室制備即可��。而對(duì)于注射劑��,需要在符合GMP條件下制備����,控制制劑的內(nèi)毒素和微生物限度,確保試驗(yàn)動(dòng)物不會(huì)因非藥物本身原因?qū)е虏涣挤磻?yīng)甚至死亡����。需要指出的�����,臨床前研究結(jié)束準(zhǔn)備提交IND申請(qǐng)時(shí)�����,需要提供注冊(cè)批的生產(chǎn)信息。對(duì)注射劑來(lái)說(shuō)��,美國(guó)IND需要注冊(cè)批的制劑(可用于I期臨床)在符合GMP條件下生產(chǎn)�����,對(duì)原料藥無(wú)硬性規(guī)定�����;而國(guó)內(nèi)IND����,注冊(cè)批原料藥和制劑(可用于I期臨床)均需在符合GMP條件下生產(chǎn)。
此階段無(wú)需對(duì)制備工藝進(jìn)行研究�����,最好能確定化合物的合成路線����。需要注意的是��,供主要毒理試驗(yàn)(安全性評(píng)價(jià))用的樣品,純度不宜過(guò)高����,主要的雜質(zhì)應(yīng)有一定的含量,應(yīng)確保后續(xù)放大后能比較方便地生產(chǎn)出符合質(zhì)量要求的樣品��,避免臨床試驗(yàn)樣品雜質(zhì)含量水平超過(guò)安評(píng)樣品����,或后期為了達(dá)到安評(píng)樣品同等質(zhì)量水平的樣品而使工藝產(chǎn)率低�����、成本高��,難以放大�����。
(4)質(zhì)量控制
此階段無(wú)需開(kāi)展過(guò)多的質(zhì)量研究工作����,但需要對(duì)化合物的結(jié)構(gòu)進(jìn)行基本的確證�����,對(duì)溶解度�����、粒度等可能影響制劑生產(chǎn)的關(guān)鍵質(zhì)量屬性進(jìn)行初步的研究。原料藥需對(duì)高風(fēng)險(xiǎn)的重金屬元素和基因毒雜進(jìn)行適當(dāng)控制����,注射劑需要控制內(nèi)毒素和微生物限度等關(guān)鍵指標(biāo)�����。
(5)穩(wěn)定性
需要進(jìn)行初步的穩(wěn)定性研究,以考察所制備樣品是否能支持藥物的相關(guān)研究����,對(duì)主要的毒理試驗(yàn)批、注冊(cè)批原料藥和制劑需進(jìn)行穩(wěn)定考察。由于長(zhǎng)期穩(wěn)定性研究耗時(shí)長(zhǎng)����,一旦錯(cuò)過(guò)窗口時(shí)間就白白浪費(fèi)了����,而此階段對(duì)候選藥物的長(zhǎng)期穩(wěn)定性不太了解,最有效的策略是����,同時(shí)考察一種以上條件下的穩(wěn)定性��,為將來(lái)選擇合適的條件提供充足的數(shù)據(jù)�����。
3.2 驗(yàn)證性臨床研究階段
包括臨床Ⅰ期和II研究,主要考察藥品的安全性�����、初步考察有效性��。此階段研究時(shí)受試者較少��、周期較短,CMC研究主要確保藥物質(zhì)量的可控性和一致性����。
(1)化合物的性質(zhì)
通過(guò)進(jìn)一步的研究,對(duì)化合物的各項(xiàng)理化性質(zhì)有了進(jìn)一步的理解和認(rèn)識(shí)�����,識(shí)別哪些是關(guān)鍵質(zhì)量屬性�����,在樣品制備時(shí)進(jìn)行合理控制,確保后續(xù)研究藥物質(zhì)量的一致性。
(2)劑型�����、處方和規(guī)格
一般來(lái)說(shuō)��,進(jìn)入臨床研究階段,藥物的劑型和處方應(yīng)基本確定����;而隨著臨床研究的深入�����,藥物的規(guī)格可能有變化��,因此劑型和處方的設(shè)計(jì)在保證安全性的前提下需要保證制劑質(zhì)量的一致,雜質(zhì)的可控�����。
(3)工藝
臨床I期工藝研究的要求與臨床前階段類似,由于臨床樣品均在符合GMP條件下生產(chǎn)����,按GMP的規(guī)定進(jìn)行生產(chǎn)質(zhì)量管理��。在合成路線和處方確定的前提下����,應(yīng)基本確定起始物料�����、中間體、關(guān)鍵輔料��、內(nèi)外包材等關(guān)鍵物料����;對(duì)無(wú)菌制劑�����,應(yīng)根據(jù)滅菌工藝選擇決策樹(shù)基本確定滅菌工藝。
經(jīng)過(guò)臨床I期證明了藥品的安全性后,臨床研究進(jìn)入II期�����,隨著受試者的增加,臨床用藥量也隨之增加��,此時(shí)應(yīng)參考同類化合物的生產(chǎn)工藝,對(duì)藥物的生產(chǎn)工藝進(jìn)行適當(dāng)?shù)膬?yōu)化�����,以適應(yīng)中試和將來(lái)放大生產(chǎn)的需要��。此階段可以對(duì)生產(chǎn)工藝進(jìn)行變更(包括重大變更)����,但需確保變更前后藥物的質(zhì)量(一級(jí)結(jié)構(gòu)、高級(jí)結(jié)構(gòu)��、雜質(zhì)譜�����、雜質(zhì)含量��、活性等)一致。若變更前后有質(zhì)量不一致(如雜質(zhì)譜有差異)的情況�����,應(yīng)進(jìn)行充分的評(píng)估,必要時(shí)進(jìn)行橋接試驗(yàn)�����,證明這種變化不會(huì)影響藥物的安全性����、有效性�����。此階段的生產(chǎn)工藝優(yōu)化����,應(yīng)以進(jìn)入臨床III期后生產(chǎn)工藝不會(huì)發(fā)生重大變更為目標(biāo)��。
(4)質(zhì)量控制
臨床I期質(zhì)量研究可以采用“通用”的方法��,如��,按照藥典對(duì)原料藥和制劑的一般要求進(jìn)行相關(guān)的研究,以保證化合物的質(zhì)量的可控����。對(duì)于原料藥來(lái)說(shuō),根據(jù)所用的起始原料�����、得到的中間體及其雜質(zhì)的信息��,確定檢測(cè)項(xiàng)目、方法和質(zhì)量標(biāo)準(zhǔn)�����。進(jìn)入到臨床II期應(yīng)對(duì)起始物料、關(guān)鍵輔料��、中間體、成品分析方法進(jìn)行開(kāi)發(fā)和優(yōu)化�����,并進(jìn)行基本的驗(yàn)證�����,確保方法的可行性����、有效性和可靠性����。并根據(jù)多批次檢測(cè)結(jié)果��,對(duì)中間體和成品質(zhì)量標(biāo)準(zhǔn)進(jìn)行適當(dāng)?shù)淖兏?jí),以實(shí)行對(duì)藥品質(zhì)量更好的控制�����。
需要注意的是����,用于制備臨床用樣品的原料藥的雜質(zhì)含量水平�����,如基因毒雜、殘留溶劑和重金屬����,應(yīng)當(dāng)完全符合相應(yīng)的法規(guī)和指導(dǎo)原則的要求。同時(shí)��,該階段的研究需要根據(jù)臨床試驗(yàn)或安全性的數(shù)據(jù)提出可以被接受的極限�����,而這種極限需要得到相關(guān)數(shù)據(jù)的支持(比如��,每日攝取溶劑的最大允許水平)。該階段應(yīng)積累批檢測(cè)數(shù)據(jù)����,為最終制定質(zhì)量標(biāo)準(zhǔn)各類雜質(zhì)限度提供依據(jù)��。
(5)穩(wěn)定性
已有穩(wěn)定性批次繼續(xù)進(jìn)行考察以積累數(shù)據(jù)��,新的臨床試驗(yàn)批次均要進(jìn)行穩(wěn)定性考察。根據(jù)影響因素實(shí)驗(yàn)和前期長(zhǎng)期穩(wěn)定性考察數(shù)據(jù)��,若能明確判斷最合適的儲(chǔ)存條件��,新的批次可據(jù)此制訂明確的穩(wěn)定性考察方案�����。同時(shí)��,采用優(yōu)化的分析方法和升級(jí)的質(zhì)量標(biāo)準(zhǔn),對(duì)新增批次進(jìn)行穩(wěn)定性考察。
3.3 關(guān)鍵臨床研究階段
即Ⅲ期臨床研究階段����,通過(guò)擴(kuò)大受試者的規(guī)模��,對(duì)藥物安全性和療效進(jìn)行全面的研究�����,是對(duì)藥物安全性����、有效性的確證階段��。通過(guò)對(duì)CMC的詳細(xì)研究����,為申報(bào)階段準(zhǔn)備相關(guān)的資料�����,以供上市審批用�����。
(1)處方
經(jīng)過(guò)驗(yàn)證性臨床階段,藥物的劑型、規(guī)格應(yīng)已確定��,因此�����,需要對(duì)藥物的處方工藝進(jìn)行詳細(xì)的研究和篩選,確定關(guān)鍵工藝參數(shù),經(jīng)過(guò)此階段的研究����,藥物的處方工藝應(yīng)基本確定��。
(2)工藝
此階段應(yīng)對(duì)生產(chǎn)工藝進(jìn)行全面的研究�����,完善工藝開(kāi)發(fā)研究過(guò)程��、確定起始物料并建立合格供應(yīng)商名單����、確定各工序關(guān)鍵工藝參數(shù)��、明確工藝驗(yàn)證和商業(yè)化初期的生產(chǎn)批量�����。最好確保此階段生產(chǎn)工藝不發(fā)生重大變更、雜質(zhì)譜不發(fā)生明顯變化��、供應(yīng)商和生產(chǎn)場(chǎng)地也不發(fā)生變更����。
對(duì)中美雙報(bào)的項(xiàng)目�����,應(yīng)根據(jù)中美NDA申報(bào)的差異��,合理安排組織此階段的臨床樣品生產(chǎn)。
美國(guó)NDA申報(bào)注冊(cè)批不要求進(jìn)行工藝驗(yàn)證,因此可以根據(jù)臨床試驗(yàn)對(duì)臨床樣品的需求間歇的安排III期臨床樣品的生產(chǎn)��,各注冊(cè)批批量也可以不一致����,累積3批的生產(chǎn)信息�����、穩(wěn)定性數(shù)據(jù)等作為注冊(cè)申報(bào)資料�����。在藥品獲批上市前后需進(jìn)行工藝驗(yàn)證�����,待藥品獲批上市后����,工藝驗(yàn)證批放行后即可上市銷售。
中國(guó)NDA申報(bào)注冊(cè)批必須包含工藝驗(yàn)證批�����,這給工藝驗(yàn)證的生產(chǎn)安排帶來(lái)一定的難度����,過(guò)早進(jìn)行工藝驗(yàn)證擔(dān)心藥物過(guò)效期不能用于后期臨床,安排晚了又擔(dān)心影響臨床進(jìn)展或延誤NDA申報(bào)��。一般的經(jīng)驗(yàn)��,隨著臨床試驗(yàn)的進(jìn)展,根據(jù)擬進(jìn)行NDA申報(bào)的時(shí)間點(diǎn)及生產(chǎn)����、穩(wěn)定性考察時(shí)間倒推��,并結(jié)合臨床試驗(yàn)對(duì)藥品的需求�����,在III期臨床中期前后(或距NDA申報(bào)1.5年左右)進(jìn)行工藝驗(yàn)證。為了滿足III期臨床早期的試驗(yàn)用藥需求��,II期臨床后期生產(chǎn)工藝基本確定后�����,可安排一批GMP生產(chǎn)��。需要指出的是��,國(guó)內(nèi)NDA申報(bào)注冊(cè)的工藝驗(yàn)證批產(chǎn)品在獲批后不能上市銷售,但通過(guò)上市前GMP符合性檢查的商業(yè)規(guī)模批次��,符合放行條件的產(chǎn)品��,在獲得藥品注冊(cè)證書(shū)后可以上市銷售��。
(3)質(zhì)量控制
鑒于原料藥的生產(chǎn)工藝及制劑的處方工藝基本確定����,因此�����,此階段需要進(jìn)行全面的質(zhì)量研究工作����,包括起始物料、關(guān)鍵輔料��、中間體和中控����、成品的分析方法、雜質(zhì)(有關(guān)物質(zhì)��、殘留溶劑、基因毒雜�����、降解雜質(zhì)等)、質(zhì)量標(biāo)準(zhǔn)進(jìn)行全面的研究����,識(shí)別關(guān)鍵質(zhì)量屬性����,對(duì)于藥物中的雜質(zhì)需要進(jìn)行定性和定量����,并根據(jù)相關(guān)的研究結(jié)果確定其限度����。質(zhì)量標(biāo)準(zhǔn)有關(guān)物質(zhì)項(xiàng)下,對(duì)已知結(jié)構(gòu)的雜質(zhì)(包括工藝雜質(zhì)和降解雜質(zhì))應(yīng)按特定單雜進(jìn)行控制,其中穩(wěn)定存在但結(jié)構(gòu)不明確的雜質(zhì)可按相對(duì)保留時(shí)間控制����。
對(duì)有關(guān)物質(zhì)檢查��、含量測(cè)定等方法需要進(jìn)行詳細(xì)的方法學(xué)研究和驗(yàn)證�����,以考察方法的可行性����。同時(shí)要根據(jù)藥物的特性����、處方和工藝的情況制定藥物的質(zhì)量控制標(biāo)準(zhǔn)�����,在工藝驗(yàn)證前應(yīng)在GMP條件下完成方法學(xué)驗(yàn)證(或在工藝驗(yàn)證前完成預(yù)驗(yàn)證��,在工藝驗(yàn)證的同時(shí)完成方法學(xué)驗(yàn)證)��。
(4)穩(wěn)定性
此階段應(yīng)對(duì)藥物的穩(wěn)定性進(jìn)行全面的研究��,包括在GMP條件下完成影響影響因素試驗(yàn)�����,制定合理的穩(wěn)定性研究方案,確選定適宜的包裝和規(guī)格,以確定藥物的貯藏條件和有效期/復(fù)驗(yàn)期����。
(5)包材相容性
原料藥無(wú)包材相容性研究的要求����,采用原輔包登記平臺(tái)上備案的藥包材,通過(guò)穩(wěn)定性研究證明包裝可行�����。
制劑需按CDE頒發(fā)的相關(guān)指導(dǎo)原則開(kāi)展包材相容性研究�����,可以委托具有資質(zhì)的專業(yè)CRO來(lái)開(kāi)展該項(xiàng)研究�����。
3.4 臨床研究階段變更的管理
如前文所述�����,創(chuàng)新藥的CMC研究�����,要根據(jù)藥物開(kāi)發(fā)進(jìn)程逐步推進(jìn)��。隨著臨床的進(jìn)展��,CMC研究的廣度和深度不斷延伸。為了解決創(chuàng)新藥臨床研究期間更新的藥學(xué)研究數(shù)據(jù)滾動(dòng)提交的問(wèn)題,也為建立科學(xué)的創(chuàng)新藥研發(fā)期間變更管理制度奠定基礎(chǔ)��,CDE在調(diào)整創(chuàng)新藥藥學(xué)審評(píng)策略的同時(shí)�����,出臺(tái)了創(chuàng)新藥CMC研究年度報(bào)告制度,并在臨床試驗(yàn)批件中明確要求自創(chuàng)新藥物首次獲準(zhǔn)進(jìn)行臨床研究之日起,申請(qǐng)人按年度提交“化學(xué)藥IND申請(qǐng)CMC研究年度報(bào)告”。年度報(bào)告主要包括基本信息����、本年度變更事項(xiàng)和本年度更新事項(xiàng)三方面的內(nèi)容��,申請(qǐng)人應(yīng)如實(shí)報(bào)告本年度內(nèi)所有的變更和更新事項(xiàng)��。
對(duì)于臨床期間的變更�����,按《創(chuàng)新藥(化學(xué)藥)臨床試驗(yàn)期間藥學(xué)變更技術(shù)指導(dǎo)原則(試行)》(CDE于2021年3月發(fā)布)進(jìn)行管理,申請(qǐng)人評(píng)估認(rèn)為不影響受試者安全的����,可以直接實(shí)施并在研發(fā)期間安全性更新報(bào)告中報(bào)告��;申請(qǐng)人評(píng)估認(rèn)為可能增加受試者安全性風(fēng)險(xiǎn)的變更�����,應(yīng)當(dāng)按《藥品注冊(cè)管理辦法》提出補(bǔ)充申請(qǐng),獲批后才能實(shí)施�����。
年度報(bào)告制度的實(shí)施����,可以使審評(píng)機(jī)構(gòu)動(dòng)態(tài)掌握藥物的研發(fā)進(jìn)展����,及時(shí)發(fā)現(xiàn)潛在的安全風(fēng)險(xiǎn)����,同時(shí)也促使申請(qǐng)人加強(qiáng)研究進(jìn)程中數(shù)據(jù)的積累和總結(jié)、保證創(chuàng)新藥研發(fā)過(guò)程中藥學(xué)數(shù)據(jù)的完整性�����。
3.5 上市申請(qǐng)階段
CMC研究的最終目標(biāo)是要保證上市藥品的質(zhì)量可控,對(duì)于上市申請(qǐng)�����,需在前述研究的基礎(chǔ)上��,基于歷史批次的生產(chǎn)信息和批分析數(shù)據(jù)�����,尤其是III期臨床樣品的生產(chǎn)信息和質(zhì)量特性����,確定穩(wěn)定、重現(xiàn)����、可商業(yè)化生產(chǎn)的工藝,構(gòu)建完善的藥品質(zhì)量控制體系�����。CMC研究信息的核心是要呈現(xiàn)最終確定的質(zhì)量控制體系,提供研究信息說(shuō)明如何構(gòu)建質(zhì)量控制體系以及對(duì)于所確定質(zhì)量控制體系的合理性和全面性的論證��。因此,需提供全套完整的CMC研究信息,研究工作應(yīng)參考已發(fā)布的各項(xiàng)指導(dǎo)原則開(kāi)展��。
經(jīng)過(guò)漫長(zhǎng)的臨床前研究和臨床研究��,對(duì)藥物的價(jià)值有了充分的認(rèn)識(shí)��,經(jīng)過(guò)利弊權(quán)衡����,若持有人作出上市申請(qǐng)的決定�����,需要經(jīng)過(guò)藥品監(jiān)管當(dāng)局的批準(zhǔn)才能實(shí)施��。因此需要根據(jù)相關(guān)的法規(guī)和技術(shù)要求,根據(jù)前期的研究結(jié)果準(zhǔn)備相關(guān)的非臨床研究、CMC研究�����、臨床研究資料及相關(guān)的資質(zhì)資料����,提交新藥上市申請(qǐng)����。
在CDE的藥品技術(shù)審評(píng)實(shí)踐中�����,在CMC審評(píng)中發(fā)現(xiàn)以下方面的研究有一定的欠缺�����,在進(jìn)行研究時(shí)應(yīng)予以關(guān)注:
(1)BCS分類
明確目標(biāo)化合物在BCS分類系統(tǒng)中屬于哪類化合物�����,有助于劑型的選擇和化合物特性的認(rèn)知����,有利于藥物的開(kāi)發(fā)。
(2)晶型����、粒度的選擇
尤其是對(duì)口服固體制劑��,對(duì)于水溶性不好的藥物晶型和粒度對(duì)藥物的毒性和療效有一定的影響��,對(duì)此進(jìn)行深入的研究有助于藥物的開(kāi)發(fā)�����。
(3)滅菌工藝條件
藥物的滅菌工藝對(duì)藥物的安全性影響很大,因此在進(jìn)行藥物工藝研究時(shí)應(yīng)對(duì)滅菌工藝進(jìn)行全面深入的研究,確定關(guān)鍵工藝參數(shù)��,確保藥物的質(zhì)量�����。
(4)穩(wěn)定性研究
應(yīng)關(guān)注影響產(chǎn)品質(zhì)量的包裝密封系統(tǒng)方面的變化�����,這是保證藥物質(zhì)量的重要保障����。
3.6 上市后階段
藥品批準(zhǔn)上市后��,應(yīng)對(duì)生產(chǎn)工藝開(kāi)展持續(xù)工藝驗(yàn)證或再驗(yàn)證����。
此外��,藥品上市后����,由于種種原因��,藥品的處方��、生產(chǎn)工藝、生產(chǎn)批量�����、分析方法或質(zhì)量標(biāo)準(zhǔn)�����、生產(chǎn)廠商或生產(chǎn)場(chǎng)地/車間����、原輔料的來(lái)源��、工藝設(shè)備等諸方面均可能會(huì)發(fā)生相應(yīng)的變更����,應(yīng)按《已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》(CDE于2021年2月發(fā)布)進(jìn)行相關(guān)的研究��,必要時(shí)進(jìn)行工藝驗(yàn)證��,并提交相關(guān)的備案或補(bǔ)充申請(qǐng)。對(duì)重大變更提交補(bǔ)充申請(qǐng)的��,應(yīng)在補(bǔ)充申請(qǐng)獲批后才能實(shí)施�����。
4. 結(jié)語(yǔ)
創(chuàng)新藥不同研發(fā)階段����,CMC研究的目的不同�����,CMC研究進(jìn)程中要充分關(guān)注以下問(wèn)題:CMC研究的廣度和深度要與所處藥物研發(fā)階段相適應(yīng)��,基于科學(xué)和風(fēng)險(xiǎn)原則�����,合理確定各個(gè)階段的CMC研究重點(diǎn)��,制訂適宜的研發(fā)計(jì)劃��,既要保證有充分的研發(fā)數(shù)據(jù)支持風(fēng)險(xiǎn)評(píng)估和風(fēng)險(xiǎn)控制��,又不要跨越研發(fā)階段過(guò)早完成過(guò)多的藥學(xué)工作����;對(duì)于研究進(jìn)程中的變更��,要依據(jù)變更的程度�����、變更的階段�����,開(kāi)展相應(yīng)的驗(yàn)證工作�����,評(píng)估變更前后樣品質(zhì)量的可銜接性��;創(chuàng)新藥研究周期較長(zhǎng)��、研究進(jìn)程中獲得的信息也較多,需加強(qiáng)數(shù)據(jù)信息的積累����、分析及總結(jié),并在研究的關(guān)鍵環(huán)節(jié)��,加強(qiáng)同審評(píng)機(jī)構(gòu)的溝通交流��。
參考資料:
1.何伍��、潘衛(wèi)三�����,創(chuàng)新藥物研發(fā)中的CMC階段性研究��,中國(guó)新藥雜志��,2010����,19(2):95~98。
2.張寧�����、王亞敏��、陳震�����,創(chuàng)新藥CMC研究的階段性考慮,中國(guó)藥學(xué)雜志����,2014,49(17):1565~1568�����。
3. 微信公眾號(hào)�����,風(fēng)禾盡起—中國(guó)創(chuàng)新藥行業(yè)發(fā)展歷程,知識(shí)藥點(diǎn)�����,2022-03-09。