預(yù)灌封注射器是一種既可以儲存藥物又具備給藥功能的新型藥品包裝容器���,主要用于抗血栓藥、疫苗及生物工程藥物的包裝���。其優(yōu)點(diǎn)體現(xiàn)在:與藥物具有良好的相容性���;減少了藥物在存儲和轉(zhuǎn)移過程中因吸附造成的浪費(fèi)���;使用機(jī)器灌裝技術(shù)���,藥物定量更精確;避免因加入稀釋液反復(fù)抽吸造成的二次污染���;操作簡便���,適用于急診患者等[1]。由于預(yù)灌封注射器的臨床應(yīng)用存在與血液���、體液直接接觸的風(fēng)險(xiǎn)���,因此需要重視其生物學(xué)安全性[2]���。本文從制作工藝、材料���、與人體接觸風(fēng)險(xiǎn)以及國內(nèi)外生物學(xué)評價(jià)標(biāo)準(zhǔn)的差異等方面對預(yù)灌封注射器進(jìn)行了系統(tǒng)分析���,探討將預(yù)灌封注射器作為一個(gè)系統(tǒng)進(jìn)行生物相容性試驗(yàn)的可行性。
一���、預(yù)灌封注射器背景
1.1 預(yù)灌封注射器發(fā)展歷程
預(yù)灌封注射器起源于20世紀(jì)80年代[3]���。我國的第一支預(yù)灌封注射器于2005年生產(chǎn)。隨著人們對生命健康越來越重視���,以及預(yù)灌封注射器具有安全可靠���、操作方便等多方面優(yōu)點(diǎn),因此預(yù)灌裝注射器的應(yīng)用前景越來越廣闊。
1.2 預(yù)灌封注射器的分類和組成
預(yù)灌裝注射器按照針筒的材質(zhì)分為塑料和玻璃兩類���,按照是否帶注射針又分為帶注射針和不帶注射針兩類���。不帶針的預(yù)灌封注射器還可細(xì)分為錐頭式和螺旋頭式。錐頭式由玻璃針管���、橡膠活塞���、錐頭護(hù)帽和推桿組成;螺旋頭式由玻璃針管���、橡膠活塞���、螺旋頭護(hù)帽���、螺旋頭和推桿組成[4]���。
二、預(yù)灌封注射器風(fēng)險(xiǎn)點(diǎn)
2.1 不銹鋼注射針
預(yù)灌封注射器上的不銹鋼注射針主要用于人體皮內(nèi)���、皮下���、肌肉���、靜脈等注射用[5]。UV膠多用作預(yù)灌封注射器針頭黏合劑���,通常由甲基丙烯酸類化合物組成���。甲基丙烯酸對眼睛、皮膚���、呼吸道等有較強(qiáng)的刺激性[6-7]���,UV膠會長時(shí)間接觸到藥液,直接影響藥液的質(zhì)量安全[8]���。注射針的潛在危害主要包括生物污染(熱原���、細(xì)菌)和微粒污染。根據(jù)GB/T 16886.1-2022《醫(yī)療器械生物學(xué)評價(jià) 第1部分:風(fēng)險(xiǎn)管理過程中的評價(jià)與試驗(yàn)》中的規(guī)定���,注射針需要進(jìn)行生物學(xué)評價(jià)[9]���。
2.2 橡膠活塞
橡膠活塞分為氯化丁基橡膠活塞和溴化丁基橡膠活塞���,分為扣合式(PSL)或螺紋式(PT)兩種。膠塞的質(zhì)量要求包括:不能含有鉛���、汞���、砷、鋇等有毒的可溶性化合物���;不與所裝藥物起作用���,破壞藥劑的效果和影響藥劑的澄清度;膠塞表面不能有析出物���,如游離硫、蠟等其他一切有機(jī)物質(zhì)���;膠塞表面應(yīng)光滑���,不得有裂縫���、氣泡和其他雜質(zhì)異物存在,表面要有一定的潤滑性���,能在自動(dòng)分裝機(jī)上運(yùn)行���;膠塞應(yīng)具有一定的彈性,按規(guī)定的針刺數(shù)穿刺后不掉屑���,并仍能保持原有的密封性[10-11]���。由于橡膠活塞與藥液(或生理鹽水)直接接觸,因此在生產(chǎn)和貯存過程中不能遷出小分子或有機(jī)物等,以免污染藥品對人體產(chǎn)生危害���,需對橡膠活塞的安全性進(jìn)行生物學(xué)評價(jià)。
2.3 注射器針管
預(yù)灌封注射器所用針管分為玻璃針管(硼硅玻璃)和塑料針管(COP)���,玻璃針管和塑料針管各有優(yōu)勢。玻璃針管使用歷史較久���,針管內(nèi)部涂有用于潤滑作用的硅油���,在給藥時(shí)幫助活塞活動(dòng)。而殘余的硅油長期與藥物接觸可能會產(chǎn)生相容性問題[12-13]���。塑料針管的優(yōu)點(diǎn)主要是輕便���、不易碎,但塑料針管均為高分子材料���,理化性質(zhì)不如玻璃穩(wěn)定���,且部分高分子材料具有潛在的生物學(xué)風(fēng)險(xiǎn)[14]。
2.4 針頭護(hù)帽
針頭護(hù)帽是一種套在針頭外部用于防止使用者被刺傷以及針頭受到污染的保護(hù)性裝置���。我國相關(guān)的標(biāo)準(zhǔn)規(guī)定預(yù)灌封注射器組合件中必須包含針頭護(hù)帽[15-16]���。預(yù)灌封注射器使用的護(hù)帽為橡膠針頭護(hù)帽,以聚異戊二烯為主要原料���,加入填充劑���、硫化劑、增塑劑���、抗堿劑等輔料���,對藥物及人體組織應(yīng)無潛在毒性。
三���、預(yù)灌封注射器生物相容性檢測現(xiàn)狀
3.1 國內(nèi)外標(biāo)準(zhǔn)
自1992年以來���,國內(nèi)外陸續(xù)頒布了關(guān)于預(yù)灌封注射器的檢驗(yàn)標(biāo)準(zhǔn),國家藥包材標(biāo)準(zhǔn)(2015版)中規(guī)定了組合件中的玻璃針管���、橡膠活塞���、不銹鋼注射針和針頭護(hù)帽以及組合件的相關(guān)檢測要求���。ISO11040系列國際標(biāo)準(zhǔn)對各種預(yù)灌封注射器作了比較詳細(xì)的要求,但沒有對預(yù)灌封注射器中的注射針及護(hù)帽進(jìn)行規(guī)定���。美國藥典中只是對預(yù)灌封注射器相應(yīng)的組件進(jìn)行了通用的要求[17]���。
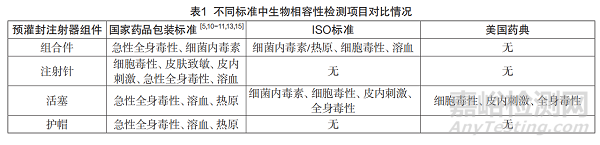
3.2 國內(nèi)外生物相容性檢測項(xiàng)目對比
目前國內(nèi)外關(guān)于預(yù)灌封注射器不同部件所要進(jìn)行的生物相容性檢測項(xiàng)目有所不同。表1列舉出了國家藥品包裝標(biāo)準(zhǔn)���、國際標(biāo)準(zhǔn)���、美國藥典中生物相容性檢測項(xiàng)目的對比情況。
四���、國內(nèi)預(yù)灌封注射器生物相容性試驗(yàn)存在的問題
從表1中可以看出���,從試驗(yàn)項(xiàng)目設(shè)置來看,不銹鋼注射針���、橡膠活塞及針頭護(hù)帽都需要進(jìn)行溶血試驗(yàn)���。根據(jù)相應(yīng)的國家藥品包裝標(biāo)準(zhǔn)���,各部件在進(jìn)行溶血試驗(yàn)時(shí)應(yīng)采用直接法進(jìn)行試驗(yàn)[18]���。但不銹鋼注射針���、針頭護(hù)帽、橡膠活塞和血液一般不存在直接接觸的情況���,因此采用間接法更符合臨床應(yīng)用���。在不銹鋼注射針進(jìn)行的皮膚致敏、細(xì)胞毒性和皮內(nèi)刺激試驗(yàn)中���,供試液的制備方式為取25支加250mL氯化鈉注射液���。該樣品制備方式未考慮活塞和針管直接與藥液接觸可能引起的風(fēng)險(xiǎn),且與臨床應(yīng)用不相符���,不能真實(shí)體現(xiàn)預(yù)灌封注射器的臨床使用風(fēng)險(xiǎn)���。
從試驗(yàn)部件來看���,目前只有不銹鋼注射針進(jìn)行了皮膚致敏、細(xì)胞毒性和皮內(nèi)刺激試驗(yàn)���,但卻未規(guī)定熱原試驗(yàn)或細(xì)菌內(nèi)毒素試驗(yàn)���。橡膠活塞臨床應(yīng)用風(fēng)險(xiǎn)較高且有資料表明有一定的細(xì)胞毒性風(fēng)險(xiǎn)���,但未規(guī)定皮膚致敏���、細(xì)胞毒性和皮內(nèi)刺激試驗(yàn)���,而針頭護(hù)帽僅僅與注射針接觸���,不存在與人體和藥液接觸的風(fēng)險(xiǎn),卻規(guī)定了急性全身毒性、溶血和熱原試驗(yàn)。因此���,目前預(yù)灌封注射器進(jìn)行生物相容性試驗(yàn)的試驗(yàn)部件并不能體現(xiàn)真實(shí)的臨床使用風(fēng)險(xiǎn)。
五���、預(yù)灌封注射器生物相容性試驗(yàn)新方法的建立
通過對比國內(nèi)外相關(guān)法規(guī)和標(biāo)準(zhǔn)���,可見目前制定的標(biāo)準(zhǔn)中大多要求將預(yù)灌封注射器各部件單獨(dú)進(jìn)行試驗(yàn),且不同的法規(guī)和標(biāo)準(zhǔn)要求進(jìn)行試驗(yàn)的部件不同���,如國家藥品包裝標(biāo)準(zhǔn)規(guī)定不銹鋼注射針應(yīng)進(jìn)行細(xì)胞毒性���、皮膚致敏、皮內(nèi)刺激���、急性全身毒性和溶血試驗(yàn)���,但I(xiàn)SO 11040系列標(biāo)準(zhǔn)和美國藥典對不銹鋼注射針并無特殊要求,而ISO 11040系列標(biāo)準(zhǔn)和美國藥典對活塞均要求進(jìn)行皮內(nèi)刺激和細(xì)胞毒性試驗(yàn)���,但國家藥品包裝標(biāo)準(zhǔn)則不要求對活塞進(jìn)行皮內(nèi)刺激和細(xì)胞毒性試驗(yàn)���。目前有資料表明橡膠活塞作為預(yù)灌封注射器的高性能配件���,在生產(chǎn)和貯存過程中會和所包裝的藥品直接接觸,因此應(yīng)當(dāng)對預(yù)灌封注射器活塞的皮內(nèi)刺激和細(xì)胞毒性進(jìn)行檢測[19-21]���。
目前國內(nèi)的藥品包裝標(biāo)準(zhǔn)對整個(gè)預(yù)灌封注射器的生物相容性試驗(yàn)只局限于對其產(chǎn)品部件的檢測���,只考慮了由材料引起的危害,從而忽視了預(yù)灌封注射器組合件的生物學(xué)風(fēng)險(xiǎn)���。因此,應(yīng)依據(jù)預(yù)灌封注射器的臨床用途���,將預(yù)灌封注射器作為一個(gè)整體來評估其潛在的生物學(xué)危害���,可以參考GB/T16886.1-2022中對于一次性使用無菌注射器推薦的生物相容性試驗(yàn)。由于預(yù)灌封注射器在生產(chǎn)過程中大多將藥液充滿公稱容量后貯存���,因此在進(jìn)行樣品制備時(shí)也可選擇將浸提介質(zhì)充滿預(yù)灌封注射器的內(nèi)腔后制備樣品的試驗(yàn)液���,這樣更能模擬預(yù)灌封注射器的臨床應(yīng)用情況���。
六、預(yù)灌封注射器生物相容性試驗(yàn)新方法的可行性分析
從試驗(yàn)項(xiàng)目來看���,在包括溶血試驗(yàn)在內(nèi)的各項(xiàng)生物相容性試驗(yàn)的供試液制備中���,新方法參照GB/T16886.12-2017將浸提介質(zhì)充滿預(yù)灌封注射器內(nèi)腔進(jìn)行整體浸提,取浸提液作為各項(xiàng)試驗(yàn)的供試液���。例如在溶血試驗(yàn)中可以取浸提液10mL加入兔血進(jìn)行后續(xù)的試驗(yàn)[22]���。這種供試液制備方式充分考慮預(yù)灌封注射器各部件與藥液接觸和與人體接觸的風(fēng)險(xiǎn),更符合預(yù)灌封注射器的臨床預(yù)期應(yīng)用���,試驗(yàn)過程更為合理���。
預(yù)灌封注射器的所有部件中,只有不銹鋼注射針與人體直接接觸���,而護(hù)帽���、針管和橡膠活塞均只與藥液直接接觸���,因此生產(chǎn)過程中使用的添加劑、化學(xué)助劑等有可能向藥液遷移���,影響藥液的安全性和穩(wěn)定性���,因此也需要進(jìn)行生物相容性試驗(yàn)[23-27]。我們隨機(jī)選取A和B兩個(gè)廠家檢驗(yàn)合格的預(yù)灌封注射器組合件���,將浸提介質(zhì)充滿預(yù)灌封注射器內(nèi)腔進(jìn)行樣品制備和生物相容性試驗(yàn)���。結(jié)果表明兩批次不同廠家的預(yù)灌封注射器組合件均符合相應(yīng)的標(biāo)準(zhǔn)要求,因此以新方法代替現(xiàn)行的測試方法具有可行性���。
七、討論
現(xiàn)行的預(yù)灌封注射器的國家藥品包裝標(biāo)準(zhǔn)要求對預(yù)灌封注射器的各部件分開進(jìn)行試驗(yàn)���,對于組合件的生物相容性試驗(yàn)項(xiàng)目僅要求進(jìn)行急性全身毒性試驗(yàn)和細(xì)菌內(nèi)毒素試驗(yàn)���,且各部件進(jìn)行的試驗(yàn)項(xiàng)目并不統(tǒng)一���,這樣既會造成不必要的浪費(fèi),也不能真實(shí)反映預(yù)灌封注射器的臨床應(yīng)用風(fēng)險(xiǎn)���。預(yù)灌封注射器和一次性使用無菌注射器在臨床應(yīng)用和加工貯存等方面具有很多的相同點(diǎn)���,而GB 15810-2019《一次性使用無菌注射器》規(guī)定了注射器要進(jìn)行細(xì)胞毒性、皮膚致敏���、皮內(nèi)刺激���、急性全身毒性、溶血���、熱原(細(xì)菌內(nèi)毒素)試驗(yàn)���,同時(shí)該標(biāo)準(zhǔn)在引言中明確提出,如果注射器自身配套注射針���,測試化學(xué)性能和生物性能時(shí)應(yīng)連同注射針制備萃取液[28]���。此外YY/T 0243-2016《一次性使用注射器用活塞》中同樣規(guī)定了細(xì)胞毒性���、皮膚致敏、皮內(nèi)刺激���、急性全身毒性���、溶血、熱原(細(xì)菌內(nèi)毒素)等檢測項(xiàng)目[29]���?��?梢钥闯鰢鴥?nèi)關(guān)于一次性使用無菌注射器的標(biāo)準(zhǔn)中,與藥液存在直接接觸的部件規(guī)定了一致的檢測項(xiàng)目���。同時(shí)本實(shí)驗(yàn)室的對比試驗(yàn)結(jié)果也表明���,將預(yù)灌封注射器各部件分別進(jìn)行試驗(yàn)與整體進(jìn)行試驗(yàn)得出的試驗(yàn)結(jié)果均為合格,無明顯差異���。
綜合以上分析可知,所建立的生物相容性試驗(yàn)方法可以充分考慮預(yù)灌封注射器各部件與人體接觸的風(fēng)險(xiǎn)���,同時(shí)可以提高檢測效率���,降低成本���,符合動(dòng)物福利的3R原則要求,因此���,該方法具有實(shí)際可行性���。