近日���,禮來公司(Eli Lilly)宣布,其開發(fā)的用于治療成人重度斑禿的口服JAK抑制劑巴瑞替尼(商品名:艾樂明)證實(shí)獲得中國國家藥品監(jiān)督管理局(NMPA)批準(zhǔn)���。據(jù)悉,該藥是國內(nèi)首個(gè)�����、且唯一用于系統(tǒng)性治療重度斑禿的創(chuàng)新靶向藥物。
禮來表示�,作為首款用于系統(tǒng)性治療成人重度斑禿的靶向藥物,此次艾樂明新適應(yīng)癥獲批���,填補(bǔ)了中國重度斑禿患者迫在眉睫的疾病治療需求,也為醫(yī)生帶來了新的臨床藥物選擇�。
巴瑞替尼是一種免疫系統(tǒng)用藥�,由禮來和Incyte合作開發(fā),2018年和2019年���,該藥分別在美國和中國獲批���,用于治療一種或多種改善病情抗風(fēng)濕藥療效不佳或不耐受的中重度活動性類風(fēng)濕關(guān)節(jié)炎(RA)成年患者�。目前�����,該藥已進(jìn)入國家醫(yī)保目錄���。
巴瑞替尼自上市后�,一直有著不錯(cuò)的市場表現(xiàn)�,數(shù)據(jù)顯示,巴瑞替尼2021年全球銷售額為11.15億美元�����,同比增長74.5%�,2022年第一季度為2.556 億美元�����,同比增長32%�。
另外�����,米內(nèi)網(wǎng)數(shù)據(jù)顯示���,巴瑞替尼在國內(nèi)樣本醫(yī)院終端的銷售額也大幅增長,2020年銷售額為74萬元���,2021年增長到2268萬元�����。
斑禿(AlopeciaAreata�,AA)是一種常見的炎癥性非瘢痕性脫發(fā)�����,臨床表現(xiàn)為頭皮突然發(fā)生的邊界清晰的圓形斑狀脫發(fā)�����,輕癥患者大部分可自愈���,約半數(shù)患者反復(fù)發(fā)作�����,病情嚴(yán)重者可進(jìn)展至完全脫發(fā)或泛發(fā)性脫發(fā)。國外研究表明人群終生患病率約2%�����。其中約5%的斑禿患者會進(jìn)一步發(fā)展為完全脫發(fā)或泛發(fā)性脫發(fā)�。
相關(guān)流行病學(xué)研究表明我國斑禿患病率為0.27%�,患病率的年復(fù)合增長率為0.46%�����,近20年我國斑禿患病人群規(guī)模趨于穩(wěn)定:每年近400萬人受其困擾���。斑禿對外在形象���、社會交往以及精神壓力等方面造成的影響較大,包括睡眠和生活質(zhì)量明顯較差�、廣泛性焦慮癥和抑郁情緒嚴(yán)重等�����。
斑禿的既往治療基本上為口服和外用激素�����,最常見的即為米諾地爾�����。巴瑞替尼獲批基于BRAVE-AA系列的兩項(xiàng)研究(BRAVE-AA1和BRAVE-AA2)�。該研究于2022年5月發(fā)表在《新英格蘭醫(yī)學(xué)雜志》上。
BRAVE-AA1和BRAVE-AA2為兩項(xiàng)隨機(jī)�����、安慰劑對照Ⅲ期研究�。涉及嚴(yán)重斑禿的成年患者,其嚴(yán)重程度為脫發(fā)評分工具(SALT)評分為50或更高�。該評分范圍為0-100�����,0分為無頭皮脫發(fā)�����,100分為頭皮完全脫發(fā)���。
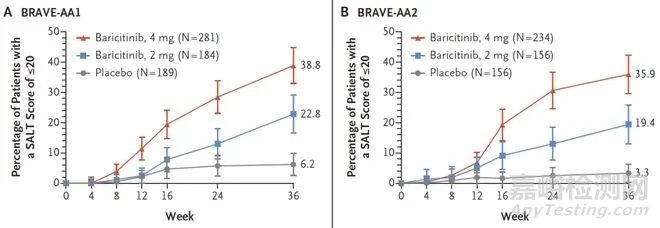
兩個(gè)試驗(yàn)分別招募654名、546名患者�,其中亞洲患者的占比分別約為40%�、30%?��;颊呔?:2:2的比例被隨機(jī)分配接受每天一次的4mg巴瑞替尼、2mg巴瑞替尼或安慰劑治療���。試驗(yàn)的主要終點(diǎn)為第36周時(shí)�,SALT評分為20分或更低�。次要終點(diǎn)包括SALT分?jǐn)?shù)相對于基線的百分比變化�����、SALT分?jǐn)?shù)達(dá)到50的參與者比例等�����。
結(jié)果顯示���,BRAVE-AA1研究中,接受4mg�、2mg巴瑞替尼和安慰劑治療的患者中�,SALT評分達(dá)到20分及以下的比例分別為38.8%、22.8%和6.2%�����。4mg巴瑞替尼和安慰劑治療、2mg巴瑞替尼和安慰劑治療之間的差異分別為32.6%���、16.6%(P均<0.001)���。
BRAVE-AA2研究中,接受4mg�����、2mg巴瑞替尼和安慰劑治療的患者中���,SALT評分達(dá)到20分及以下的比例分別為35.9%���、19.4%和3.3%�����。4mg巴瑞替尼和安慰劑治療�����、2mg巴瑞替尼和安慰劑治療之間的差異分別為32.6%、16.1%(P均<0.001)。
在次要終點(diǎn)方面���,4mg巴瑞替尼而非2mg巴瑞替尼要優(yōu)于安慰劑治療的效果。在安全性方面���,低于2.6%的患者因不良事件而停止治療,大多數(shù)治療相關(guān)不良事件為輕中度�。相比于安慰劑組,痤瘡�����、肌酸激酶水平升高�、低密度和高密度脂蛋白膽固醇水平升高在巴瑞克替尼組中更常見�。此外���,不建議巴瑞替尼與其他JAK抑制劑�����、生物免疫調(diào)節(jié)劑���、環(huán)孢素或其他強(qiáng)效免疫抑制劑聯(lián)合使用�。
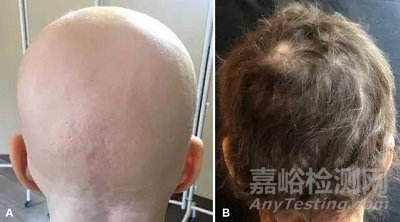
一名幾乎完全脫發(fā)的女性接受每天4mg巴瑞替尼治療�����,8個(gè)月后���,其頭發(fā)幾乎完全恢復(fù)
除巴瑞替尼外,也有其他用于治療AA的JAK抑制劑正在研發(fā)�����、申報(bào)階段�。
根據(jù)Insight數(shù)據(jù)庫���,輝瑞的利特昔替尼(Ritlecitinib)AA適應(yīng)證在中、美�����、歐盟市場均處于上市申請階段。據(jù)了解�����,該藥是一款JAK3/TEC抑制劑���,F(xiàn)DA和歐洲藥品管理局(EMA)分別預(yù)計(jì)將在2023年第二季度�����、第四季度做出決定�����。2022年11月�����,國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)顯示�����,該藥在國內(nèi)的上市申請擬納入優(yōu)先審評���,用于適合接受系統(tǒng)性治療的12歲及以上青少年和成人斑禿患者,包括全禿和普禿���。
此外,恒瑞醫(yī)藥的艾瑪昔替尼(Ivarmacitinib)AA適應(yīng)證也處于臨床Ⅲ期階段���。
“出海”再下一城!這款重磅國產(chǎn)單抗品種殺瘋了
3月28日�����,君實(shí)生物宣布�,已與康哲藥業(yè)東南亞業(yè)務(wù)(康聯(lián)達(dá))公司Rxilient Biotech Pte. Ltd.(康聯(lián)達(dá)生技)及 Excellmab Pte. Ltd.(Excellmab)訂立股東協(xié)議���,君實(shí)生物將以非貨幣方式出資認(rèn)購Excellmab 新發(fā)行的股份以獲得其40%的股權(quán)�����。同時(shí)�,Excellmab將獲得在泰國、文萊�、柬埔寨、印度尼西亞�、老撾�、馬來西亞、緬甸���、菲律賓�、越南合作開發(fā)和商業(yè)化特瑞普利單抗的獨(dú)占許可及其他相關(guān)權(quán)利���。這意味著,繼北美�����、中東�、北非后�,特瑞普利單抗“出海”再下一城。截至目前�,該重磅國產(chǎn)單抗品種的海外業(yè)務(wù)已累計(jì)拓展至超過30個(gè)國家�。
根據(jù)本次許可協(xié)議���,Excellmab將向君實(shí)生物支付合共最高不超過約452萬美元的里程碑費(fèi)款項(xiàng)�����,及產(chǎn)品于區(qū)域內(nèi)凈銷售額一定比例的特許權(quán)使用費(fèi)�����。同時(shí),Excellmab也將獲得許可協(xié)議約定的另外四款在研產(chǎn)品在區(qū)域內(nèi)的商業(yè)化優(yōu)先談判權(quán)�。
特瑞普利單抗是我中國頭個(gè)批準(zhǔn)上市的以PD-1為靶點(diǎn)的國產(chǎn)單抗藥物�����,截至目前�,特瑞普利單抗在中國大陸已有6項(xiàng)適應(yīng)癥獲批�,且有3項(xiàng)適應(yīng)癥納入國家醫(yī)保目錄。在海外���,特瑞普利單抗已獲得FDA授予2項(xiàng)突破性療法認(rèn)定�、1項(xiàng)快速通道認(rèn)定�����、1項(xiàng)優(yōu)先審評認(rèn)定和5項(xiàng)孤兒藥資格認(rèn)定�,適應(yīng)癥涵蓋黏膜黑色素瘤�����、鼻咽癌���、軟組織肉瘤、食管癌及小細(xì)胞肺癌等領(lǐng)域���。
從特瑞普利單抗的“出海”經(jīng)歷來看�,其實(shí)并非一帆風(fēng)順�����。早在2021年3月���,君實(shí)生物便向FDA遞交特瑞普利單抗上市申請,隨后面臨一項(xiàng)質(zhì)控流程變更要求���。2022年7月�,F(xiàn)DA再次受理了特瑞普利單抗的上市申請�,但在目標(biāo)審評日期內(nèi)(2022年12月23日)�,F(xiàn)DA沒有進(jìn)行現(xiàn)場核查。在審評延期3個(gè)月后���,才有消息傳出,F(xiàn)DA將在今年第二季度進(jìn)行現(xiàn)場核查���。截至今年2月27日�,從君實(shí)生物披露的信息來看,特瑞普利單抗的BLA仍在審評中�����。不過���,君實(shí)生物也在2月機(jī)構(gòu)調(diào)研時(shí)表示�����,已做好充分準(zhǔn)備工作以便隨時(shí)接受FDA的現(xiàn)場核查�����,以期能夠盡快推動特瑞普利單抗在美國實(shí)現(xiàn)商業(yè)化。
全面發(fā)力下�,特瑞普利單抗給君實(shí)生物帶來了亮眼的銷售數(shù)據(jù)�����。2021年�,隨著特瑞普利單抗三線后治療鼻咽癌和二線治療尿路上皮癌適應(yīng)癥納入醫(yī)保,其銷售收入也獲得了較大增長�����。2022年���,君實(shí)生物針對特瑞普利單抗完成了商業(yè)化團(tuán)隊(duì)的調(diào)整、營銷地域團(tuán)隊(duì)的組建恢復(fù)工作,并補(bǔ)充了核心市場人員���,2022年前三季度�,該產(chǎn)品銷售額達(dá)5.15億�����,銷售收入環(huán)比不斷提升�。同時(shí)���,放眼整個(gè)2022年度�����,在疫情等因素影響下,特瑞普利單抗仍實(shí)現(xiàn)了銷售收入的同比顯著增長���。
業(yè)內(nèi)認(rèn)為�����,未來隨著特瑞普利單抗包括一線治療食管鱗癌、一線治療非小細(xì)胞肺癌等更多重磅適應(yīng)癥獲批上市�����,該藥的銷售額有望進(jìn)一步增長���。君實(shí)生物方面日前也表示,公司在國內(nèi)市場的銷售情況已逐步進(jìn)入正向循環(huán)�,2023年起�,特瑞普利單抗的銷售有望持續(xù)改善。
而隨著特瑞普利單抗加速出海的進(jìn)程���,未來特瑞普利單抗海外市場收入的潛力也值得期待,有望為公司帶來新的業(yè)績增長動力�����。