今日頭條
上海領(lǐng)泰IRAK4蛋白降解劑報IND�。領(lǐng)泰生物宣布已向FDA遞交IRAK4新型蛋白降解劑的新藥臨床試驗申請,針對適應癥為化膿性汗腺炎(HS)和特異性皮炎(AD)����。IRAK4是人體IRAK激酶家族同工酶之一,在蛋白質(zhì)磷酸化以及細胞信號轉(zhuǎn)導中發(fā)揮重要作用��。領(lǐng)泰生物專有Nano-SPUD平臺開發(fā)的IRAK4蛋白降解劑已在臨床前研究的動物模型中顯示出較強的改善皮膚炎癥癥狀的活性和良好的安全性��。
國內(nèi)藥訊
1.輝瑞JAK3/TEC抑制劑擬納入突破性治療品種�。輝瑞1類化藥JAK3/TEC抑制劑利特昔替尼膠囊(ritlecitinib)獲CDE擬納入突破性治療品種,用于適合系統(tǒng)性治療的非節(jié)段型白癜風患者(≥12歲)��。Ritlecitinib通過不可逆地阻斷ATP結(jié)合位點以抑制JAK3和TEC家族��,從而阻斷相關(guān)信號分子和免疫細胞的活動����。2022年11月��,CDE已將利特昔替尼用于治療12歲以上斑禿患者的上市申請納入優(yōu)先審評��。
2.北海康成膠質(zhì)瘤新藥完成II期臨床入組����。北海康成創(chuàng)新CD95靶向藥CAN008 (asunercept)治療膠質(zhì)母細胞瘤(GBM)的中國II期臨床完成全部患者入組�。該項研究旨在評價CAN008與替莫唑胺在放射治療期間以及放療結(jié)束后合并使用治療新診斷的膠質(zhì)母細胞瘤患者的有效性和安全性。此前����,該新藥已分別獲得FDA和EMA授予用于治療GBM的孤兒藥資格;歐洲藥品管理局已將CAN008納入PRIME(優(yōu)先藥物)計劃�。
3.北京錦籃龐貝病AAV基因療法獲批臨床。北京錦籃基因申報的1類生物藥“GC301腺相關(guān)病毒注射液”獲國家藥監(jiān)局臨床默示許可��,適應癥為:晚發(fā)型龐貝病(LOPD)��。這是一款AAV基因治療藥物����,采用一次性靜脈注射全身廣泛表達的策略,以期直接補償肝臟��、心肌��、骨骼肌�、中樞神經(jīng)系統(tǒng)等組織的GAA酶基因缺陷��。去年12月��,NMPA已批準該新藥開展用于早發(fā)型龐貝?�。↖OPD)治療的臨床研究����。
4.康萬達IL-21溶瘤病毒獲批實體瘤臨床�。杭州康萬達醫(yī)藥“重組人IL-21溶瘤痘病毒注射液(hV01)”獲國家藥監(jiān)局臨床許可��,擬用于治療具有可注射病灶的晚期難治/復發(fā)性惡性實體瘤��。根據(jù)康萬達管線�,此次獲批臨床的應為CVD-1301.V01產(chǎn)品。CVD-1301.V01是基于TK基因和VGF基因功能缺陷型的重組溶瘤痘病毒�,其基因組中整合有外源IL-21基因,并且該IL-21基因能夠在腫瘤細胞中表達��。
5.康諾亞/樂普CLDN18.2-ADC授權(quán)AZ����。阿斯利康宣布已完成與KYM Bioscience達成的Claudin 18.2 ADC新藥CMG901全球獨家授權(quán)協(xié)議����,項目交易總額達11.88億美元��。KYM為康諾亞(70%所有權(quán))和樂普生物(30%所有權(quán))合資公司��。公布于ASCO GI2023年會上的Ia期臨床數(shù)據(jù)顯示����,CMG901在Claudin 18.2陽性胃癌或胃食管結(jié)合部腺癌患者中的客觀緩解率為75%����,疾病控制率為100%。
6.君實PD-1出海東南亞市場��。君實生物宣布將與康聯(lián)達生技設(shè)立合資公司Excellmab�,于東南亞多國合作開發(fā)和商業(yè)化PD-1特瑞普利單抗?�?德?lián)達生技將以4,999,999美元認購Excellmab新發(fā)行的股份��;Excellmab將分別由康聯(lián)達生技及君實擁有60%及40%的股權(quán)��。Excellmab將負責特瑞普利單抗在東南亞地區(qū)9個國家(包括泰國��、文萊、柬埔寨��、印度尼西亞����、老撾、馬來西亞��、緬甸����、菲律賓、越南)的開發(fā)和商業(yè)化�。
國際藥訊
1.FIC選擇性TYK2抑制劑獲批歐盟上市�。百時美施貴寶“first-in-class”口服選擇性TYK2抑制劑Sotyktu(deucravacitinib)獲歐盟委員會批準上市�,用于治療適合系統(tǒng)治療的成人中重度斑塊狀銀屑病患者。在兩項III期臨床中��,Sotyktu較安慰劑和阿普米司特�,顯著提高達到PASI 75(銀屑病面積與嚴重程度指數(shù)評分改善至少75%)應答的患者比例����。去年9月�,該新藥已獲得FDA上市許可,成為全球首款獲批的TYK2抑制劑����。
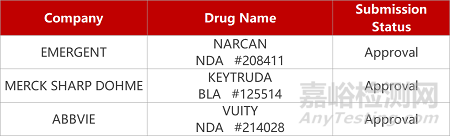
2.納洛酮鼻噴霧劑獲FDA批準上市。Emergent Biosolutions公司納洛酮鼻噴霧劑Narcan(4mg)獲FDA批準為非處方藥(OTC)��,用于緊急治療阿片類藥物過量(患者癥狀通常表現(xiàn)為呼吸或中樞神經(jīng)系統(tǒng)抑制)�。2015年����,Narcan首次被FDA批準為處方藥;后來在該公司提供了額外的數(shù)據(jù)(包括人為因素研究(Human Factors studies)以及超過五年的上市后數(shù)據(jù))后�,成為首款獲準上市的OTC納洛酮產(chǎn)品。
3.雙相抑郁新藥Ⅲ期臨床成功��。Intra-Cellular制藥公司口服5-HT2A受體拮抗劑Caplyta(lumateperone)單藥治療具有混合特征的重度抑郁癥(MDD)與雙相抑郁癥(bipolar depression)患者重度抑郁發(fā)作的Ⅲ期臨床達到主要終點��。與安慰劑相比����,Caplyta(42mg)治療組第43天時患者的MADRS總分降低5.7分(p<0.0001);CGI-S評分也具統(tǒng)計學意義的改善����。Caplyta的安全性與既往研究一致����。此前�,F(xiàn)DA已批準Caplyta用于治療雙相抑郁相關(guān)的精神分裂癥和抑郁發(fā)作。
4.抗體-寡核苷酸偶聯(lián)藥獲DMD孤兒藥認定�。Dyne公司抗體-寡核苷酸偶聯(lián)藥Dyne-251獲得FDA孤兒藥和罕見兒科疾病指定,用于治療51號外顯子跳躍突變的杜氏肌營養(yǎng)不良癥(DMD)患者��。DYNE-251由與片段抗體(Fab)結(jié)合的磷酸二酰胺嗎啉低聚物(PMO)組成��,可靶向結(jié)合目標肌肉組織中高度表達的轉(zhuǎn)鐵蛋白受體1(TfR1)����,通過促進外顯子的跳躍,使肌肉細胞產(chǎn)生短且具有功能的肌肉營養(yǎng)不良蛋白����,從而阻止或逆轉(zhuǎn)疾病的進程。
5.Ionis/渤健ASO療法早期AD臨床積極����。渤健與Ionis公司合作開發(fā)的反義寡核苷酸(ASO)療法BIIB080(IONIS-MAPT)在治療早期阿爾茨海默病(AD)患者的Ⅰb臨床結(jié)果積極。結(jié)果顯示��,BIIB080能夠劑量依賴性降低患者中腦脊液(CSF)中可溶性tau的生物標志物(t-tau和p-tau181)����,患者tau水平較基線降低約60%;PET測量結(jié)果還顯示BIIB080同時降低了患者的病理性tau蛋白水平��。臨床中大多數(shù)不良事件的嚴重程度為輕中度��。
6.ArriVent融資1.55億美元開發(fā)第三代EGFR-TKI����。ArriVent公司宣布完成1.55億美元的B輪融資����,以用于支持其從艾力斯醫(yī)藥引進的第三代EGFR-TKI伏美替尼(furmonertinib)的關(guān)鍵Ⅲ期試驗。伏美替尼已在中國獲批用于EGFR T790M突變陽性的局部晚期或轉(zhuǎn)移性非小細胞肺癌(NSCLC)患者����。ArriVent公司正在探索進一步開發(fā)伏美替尼用于攜帶其他EGFR突變的NSCLC患者,以及其他實體瘤患者��。
7.Bcl-xL抑制劑wAMD的II期臨床失敗�。UNITY公司從亞盛醫(yī)藥引進的細胞凋亡抑制蛋白Bcl-xL抑制劑UBX1325用于治療濕性年齡相關(guān)性黃斑變性(wAMD)患者的II期ENVISION研究未達到主要終點。UBX1325治療組患者24周時BCVA(最佳矯正視力)平均變化為-0.8個ETDRS字母��,而阿柏西普組為+3.1個ETDRS字母,未達到-4.5個字母����、置信區(qū)間為85%的非劣效性閾值。UBX1325的安全性和耐受性良好����,無眼內(nèi)炎癥、視網(wǎng)膜動脈阻塞����、眼內(nèi)炎或血管炎病例。
醫(yī)藥熱點
1.世衛(wèi)組織修訂新冠疫苗接種指南��。世衛(wèi)組織日前修訂了新冠疫苗接種指南����。世衛(wèi)組織表示,考慮到新冠的廣泛感染和疫苗的廣泛接種����,全球人口已獲得較高免疫,所以重點應關(guān)注向感染新冠后面臨較高風險的人群進行疫苗接種��。世衛(wèi)組織建議����,老年人����、高風險人群在上一次接種疫苗后6至12個月內(nèi)應接種加強針��;而健康的兒童和青少年非必需注射新冠疫苗����。
2.CDE:申請人之窗電子證照附件提交格式有調(diào)整����。CDE發(fā)布通知,已開展申請人之窗電子提交優(yōu)化工作��,調(diào)整電子證照附件提交格式�。自4月3日起,申請人通過申請人之窗提交質(zhì)量標準�、生產(chǎn)工藝、包裝標簽�、說明書word(.docx)版本的同時應再提交一份PDF(.pdf)版本,以確保文件版式的準確��。所提交的兩個版本文件內(nèi)容應完整準確且完全一致��。
3.武漢新增一家醫(yī)院。近日�,湖北省衛(wèi)健委網(wǎng)站發(fā)布醫(yī)療機構(gòu)設(shè)置審批公示,公示湖北省婦幼保健院申請設(shè)置“湖北省婦幼保健院漢陽院區(qū)”的相關(guān)情況����。公示信息顯示,湖北省婦幼保健院漢陽院區(qū)是三級婦幼保健院����,選址武漢市漢陽區(qū)漢陽大道639號,為政府辦非營利性醫(yī)療機構(gòu)��,設(shè)置床位500張(5張牙椅)�,建筑面積達4萬余平方米。
評審動態(tài)
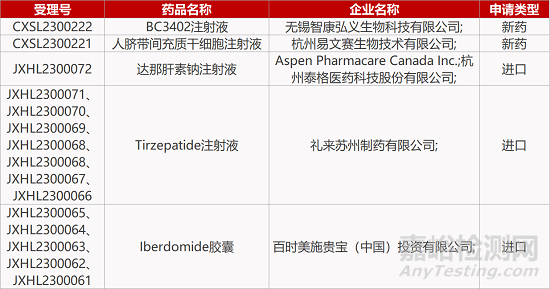
1. CDE新藥受理情況(03月30日)
2. FDA新藥獲批情況(北美03月29日)