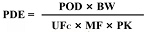引言
在開始注射劑項目研發(fā)生產(chǎn)前�,系統(tǒng)的處方前研究必不可少,詳細而全面的處方前研究會讓大家少走很多彎路��,如(1)參比制劑停產(chǎn)或退市了����,(2)項目進行到一半才知道要做臨床試驗����,(3)原輔料投錯了量,等等����。
今天,咱們就一起來通過(1)藥品基本情況,(2)參比制劑/國內(nèi)上市制劑/原輔料基本情況�,(3)注冊分類、參比制劑及是否需要臨床研究這三方面來系統(tǒng)的了解下處方前研究�。
注射劑項目研發(fā)生產(chǎn)策略全解析是以仿制藥舉例論述的,創(chuàng)新藥在諸多方面亦可參考����。
一、藥品基本概況
1��、國內(nèi)外研發(fā)歷史
1.1國外研發(fā)歷史
YYDS是三菱化學(xué)公司和神戶大學(xué)岡本浩助教授于1978年合成的世界上第一種選擇性抗凝血酶藥物��,在1990 年1月��,用于“慢性動脈閉塞《伯格氏病/阻塞性動脈粥樣硬化》”這一重要性適應(yīng)癥批準后被重視��,于1990 年6月由日本田邊三菱株式會社研發(fā)上市了YYDS注射液����,后續(xù)于2000年獲美國食品藥品管理局(FDA)批準上市, 2001年獲韓國和加拿大批準上市����,2002年獲中國批準進口上市。
2005年3月����,在YYDS注射液(XXml:XXmg)基礎(chǔ)上����,日本田邊三菱株式會社進行小規(guī)格的配方開發(fā)��,成功研發(fā)了(Xml:Xmg)規(guī)格����,該規(guī)格處方比原處方具有更高的濃度,于2005 年 7 月��,以YYDS注射液(Xml:Xmg)獲批上市��。隨后于2006 年3月����,日本田邊三菱株式會社YYDS注射液(XXml:XXmg)規(guī)格非質(zhì)量原因停產(chǎn)��,停產(chǎn)原因不詳��。
1.2國內(nèi)研發(fā)歷史
天津藥物研究院藥業(yè)有限責(zé)任公司于2005年5月在國內(nèi)率先上市YYDS注射液(XXml:XXmg)�,博瑞制藥(蘇州)有限公司于2022年3月在國內(nèi)上市YYDS注射液(Xml:Xmg),隨后國內(nèi)多家制藥企業(yè)開啟了仿制追逐之路�。
2��、銷售情況(統(tǒng)計至少近5年的數(shù)據(jù))
(1)全球銷售情況�;
(2)國內(nèi)醫(yī)院銷售情況����;
(3)社會面銷售情況(非處方藥重點關(guān)注);
(4)各公司銷售占比����;
3、重點關(guān)注
查詢YYDS注射液(XXml:XXmg)及(Xml:Xmg)國內(nèi)外研發(fā)歷史����,是為了了解該品種的研發(fā)上市歷史沿革,重點關(guān)注原研制劑出現(xiàn)停產(chǎn)��、退市等情況��,一定要深究其根本原因����,避免因為原研制劑由于質(zhì)量原因?qū)е碌耐.a(chǎn)、退市使自身的仿制進度中斷��,這樣可以提前避免這種風(fēng)險的出現(xiàn)����。
查詢YYDS注射液(Xml:Xmg)國內(nèi)研發(fā)進度及銷售占比情況�,根據(jù)自身研發(fā)進度及該產(chǎn)品線在市場的占有率����,提前推算出該品種未來的銷售情況,確定是否立項該品種�。
4、資料收集途徑
(1)https://db.yaozh.com/(藥智數(shù)據(jù)庫��,很全面����,90%以上的資料都有)
(2)https://xueshu.baidu.com/(百度學(xué)術(shù),查制劑文獻資料等)
(3)https://www.baidu.com/(百度����,查上市歷史、銷售數(shù)據(jù)等)
(4)https://www.drugfuture.com/pmda/(日本上市藥品數(shù)據(jù)庫����,查處方�、說明書等)
(5)drugfuture 藥物在線-快捷藥物信息平臺-DrugFuture數(shù)據(jù)在線-藥物數(shù)據(jù)
(6)FDA橙皮書www.accessdata.fda.gov/(查詢FDA認可的參比制劑信息)
(7)EMA https://www.ema.europa.eu(查詢歐盟集中審評的藥品資料)
(8)HMA www.drugfuture.com/hma(查詢歐盟成員審評的藥品資料)
二、參比制劑/國內(nèi)上市制劑/原輔料基本情況
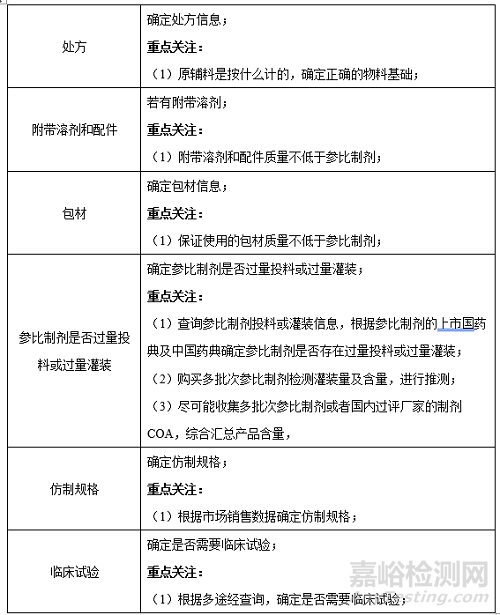
1����、參比制劑
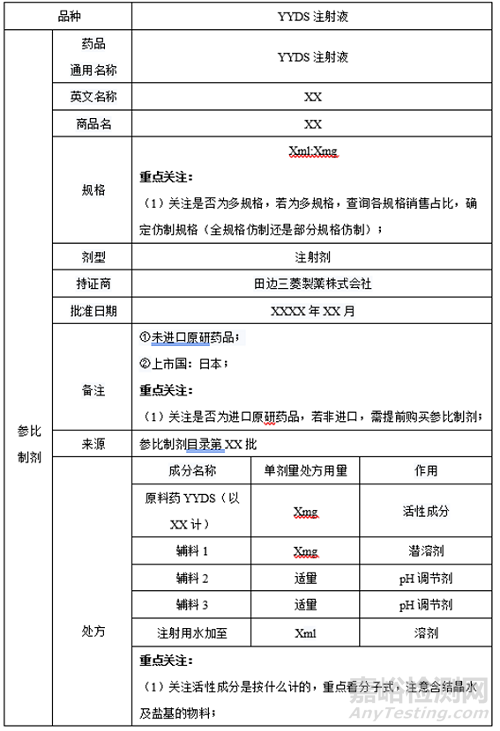

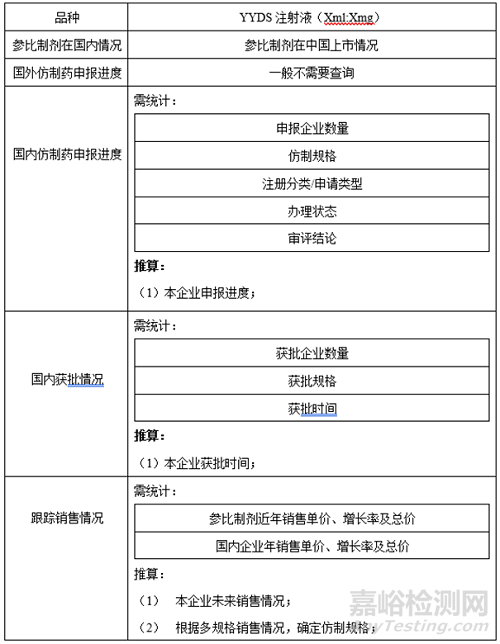
2��、國內(nèi)外上市進度

3����、資料收集途徑
(1)https://db.yaozh.com/(藥智數(shù)據(jù)庫�,很全面,90%以上的資料都有)
(2)https://xueshu.baidu.com/(百度學(xué)術(shù)����,查制劑的文獻資料等)
(3)https://www.baidu.com/(百度,查上市歷史��、銷售數(shù)據(jù)等)
(4)https://www.drugfuture.com/pmda/(日本上市藥品數(shù)據(jù)庫��,查處方����、說明書等)
(5)https://db.ouryao.com/(中國藥典、法規(guī)及標準��,查藥品及檢測標準等)
(6)https://www.cde.org.cn/(國家藥品監(jiān)督管理局藥品審評中心�,查原輔料上市信息及指導(dǎo)原則等)
(7)https://www.canbigou.com/directory.html(參比購,查參比制劑目錄)
(8)https://www.drugfuture.com/fda/(美國FDA藥品數(shù)據(jù)庫(U.S. FDA Drugs Database)�,查處方����、說明書等)
(9)https://www.drugfuture.com/ema/(歐盟EMA藥品數(shù)據(jù)庫����,查處方、說明書等)
(10)https://drugx.cn/(藥研導(dǎo)航�,查各國藥監(jiān)局及藥典等)
三、注冊分類�、參比制劑及是否需要臨床研究
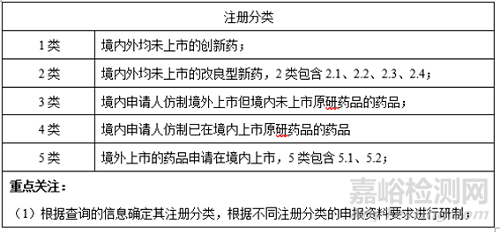
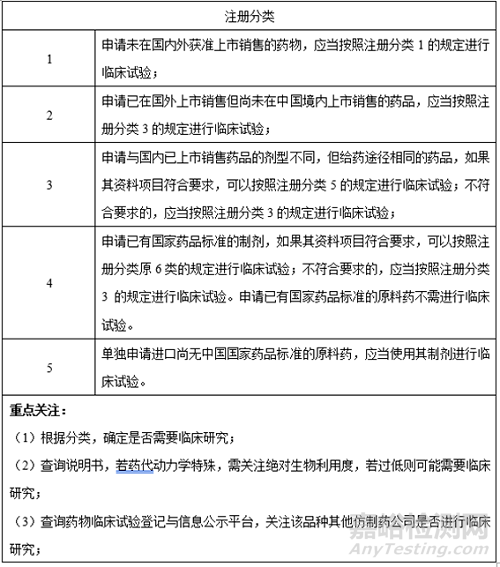
1、注冊分類
2�、原研制劑及參比制劑
3、是否需要臨床研究
4����、資料收集途徑
(1)https://wbca.cde.org.cn/wbca/ (參比制劑備案平臺,備案參比制劑)��;
(2)http://www.chinadrugtrials.org.cn/index.html(藥物臨床試驗登記與信息公示平臺����,查詢臨床試驗登記情況);
(3)https://www.cde.org.cn/zdyz/index(國家藥品監(jiān)督管理局藥品審評中心�,查指導(dǎo)原則,關(guān)注最新注冊分類及臨床試驗要求);
(4)《化學(xué)藥品新注冊分類申報資料要求(試行)》(關(guān)注注冊分類及臨床試驗要求)�;
(5)https://db.yaozh.com/(藥智數(shù)據(jù)庫��,查說明書��,關(guān)注生物利用度)����;
四、總結(jié)
2021年11月����,NMPA發(fā)補《藥品共線生產(chǎn)質(zhì)量管理指南》在行業(yè)內(nèi)引起了廣泛的關(guān)注,其中最重要的思路是相對于傳統(tǒng)方法設(shè)定的限度(千分之一最低日劑量�、10ppm、半數(shù)致死量LD50)來說��,PDE值在評估清潔殘留數(shù)據(jù)時更具科學(xué)性和優(yōu)勢�,改變了大家傳統(tǒng)的認知。
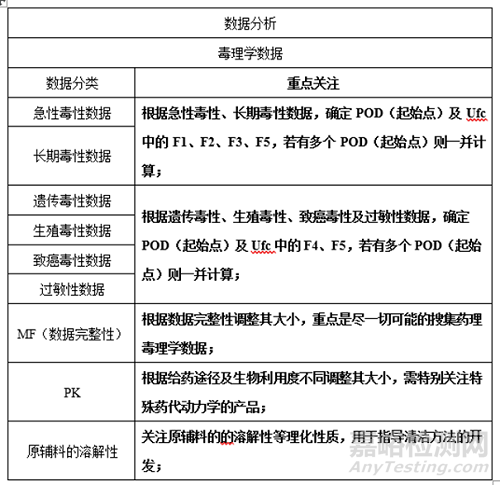
《藥品共線生產(chǎn)質(zhì)量管理指南》中規(guī)定了四類風(fēng)險需要專用設(shè)施或設(shè)備進行生產(chǎn)�,所以,在項目研發(fā)前進行生產(chǎn)線適用性考察是必不可少的�。
五、共線生產(chǎn)法規(guī)
1��、強制專線情況
《藥品共線生產(chǎn)質(zhì)量管理指南》中規(guī)定了持有人和藥品生產(chǎn)企業(yè)應(yīng)當按照法律法規(guī)要求,綜合考慮藥品的特性����、生產(chǎn)過程、預(yù)定用途��、廠房設(shè)施與設(shè)備等因素��,評估多產(chǎn)品共線生產(chǎn)的可行性����,并形成共線生產(chǎn)可行性報告。
當藥品具有如下風(fēng)險時�,需要專用設(shè)施或設(shè)備進行生產(chǎn):
(1)法律法規(guī)、國家標準明確使用專用設(shè)施或設(shè)備的(例如:高致敏藥品��、性激素類避孕藥等)��;
(2)毒理學(xué)評價得出的科學(xué)數(shù)據(jù)不支持交叉污染風(fēng)險可控的�;
(3)毒理學(xué)評價得到的相關(guān)殘留限度不能通過已驗證的分析方法檢出的;
(4)污染和交叉污染風(fēng)險不能通過操作過程和/或技術(shù)措施得到充分控制的����。
2、是否能夠共線情況
(1)化藥與生物藥��、化藥與中藥最好不要共線;
(2)最終滅菌產(chǎn)品和非最終滅菌產(chǎn)品共線��,可以共線����,需要按照非最終滅菌產(chǎn)品共線進行過程管理����;
(3)某些激素類、細胞毒性類����、高活性化學(xué)藥品共線
①生產(chǎn)性激素類避孕藥品,必須使用專用設(shè)施����;
②某些激素類、細胞毒類����、高活性化學(xué)藥品最好階段生產(chǎn);
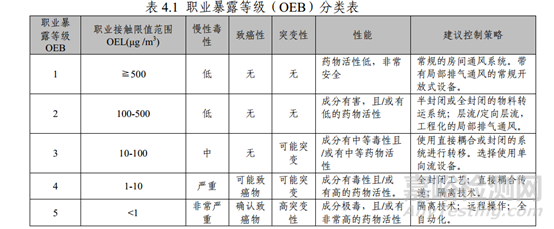
3�、根據(jù)OEL評估能否共線
查詢參比制劑安全說明書,確定產(chǎn)品OEL����,根據(jù)產(chǎn)品OEL評估是否能共線��。
4��、根據(jù)ATC分類評估是否能夠共線
依據(jù)產(chǎn)品ATC分類及上述信息��,確定產(chǎn)品是否能共線生產(chǎn)��,若不能則改用專線或使用一次性技術(shù)進行生產(chǎn)����。
六�、計算產(chǎn)品的基于健康的暴露限度(HBEL)
1、毒理數(shù)據(jù)收集
在藥品研發(fā)前期��,要充分收集產(chǎn)品毒理學(xué)的相關(guān)數(shù)據(jù)��,如急性毒性試驗�、長期毒性試驗、遺傳毒性試驗�、生殖毒性試驗、致癌毒性試驗�、過敏性試驗等的相關(guān)研究數(shù)據(jù),用于計算基于健康的暴露限度(HBEL)�。
收集原輔料的溶解性等理化性質(zhì)��,用于指導(dǎo)清潔方法的開發(fā)�。
2����、HBEL的計算方法
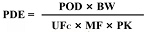
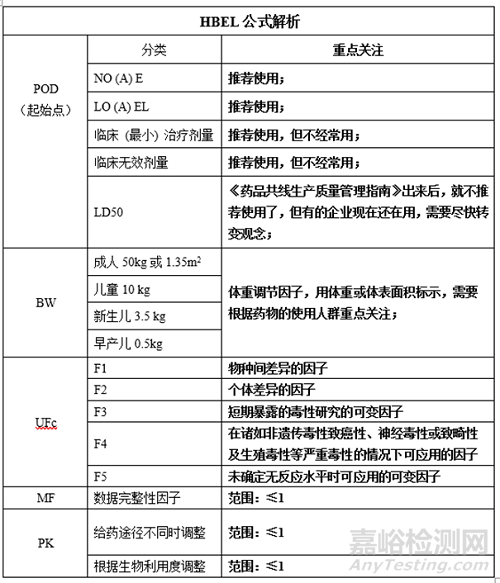
3、數(shù)據(jù)分析
七��、確定生產(chǎn)線
1��、自有產(chǎn)線
根據(jù)上述信息��,確定了不需要專線生產(chǎn)�,可以使用自有產(chǎn)線����,需考察自有產(chǎn)線相關(guān)信息,如:
2����、委托生產(chǎn)
根據(jù)上述信息,確定了不需要專線生產(chǎn)����,自己若沒有相應(yīng)產(chǎn)線�,則需要考慮委托生產(chǎn)��,除考察“1��、 自有產(chǎn)線”相關(guān)信息外�,還需考察,如:(1)該公司倉庫物料管理系統(tǒng)��,(2)QC檢測適用性����,(3)員工專業(yè)性,(4)資料合規(guī)性��,等等�,更需要熟悉產(chǎn)品的制劑、分析�、質(zhì)保等多部門實地考察。
3�、需專用產(chǎn)線
3.1專用產(chǎn)線
根據(jù)上述信息,確定了需要專線生產(chǎn)����,考察項目同 “1、自有產(chǎn)線”相關(guān)信息一致��。
3.2一次性使用技術(shù)
根據(jù)上述信息,確定了需要專線生產(chǎn)��,該產(chǎn)品附加值高����、批次少,公司從成本出發(fā)決定使用一次性使用技術(shù)��。
一次性使用技術(shù)也稱可拋棄型技術(shù)��,是在整個系統(tǒng)中和藥品接觸部分采用了一次性使用的部件��,這些部件在一次或幾次的使用后作拋棄處理����。
使用一次性使用技術(shù)�,需要用戶方、設(shè)計方�、供應(yīng)商多方充分溝通交流,根據(jù)實際廠房布局及要求�,充分考慮工藝風(fēng)險,設(shè)計出符合需求的方案�。
八、總結(jié)
根據(jù)《藥品共線生產(chǎn)質(zhì)量管理指南》中的規(guī)定����,科學(xué)合理的在項目研發(fā)前期考察生產(chǎn)線適用性�,是項目順利推進的基礎(chǔ)�,
隨著共線生產(chǎn)法規(guī)的不斷更新,基于健康的暴露限度(HBEL)的被廣泛認可�,一次性使用技術(shù)的不斷發(fā)展,對我們制藥工作者�,是挑戰(zhàn)也是機遇,只有以患者的臨床收益為核心����,不斷提高水平,將挑戰(zhàn)轉(zhuǎn)變成機遇�,才是吾輩制藥人的追求。
參考文獻及資料收集途徑
1��、《藥品共線生產(chǎn)質(zhì)量管理指南(征求意見稿)》
2��、《關(guān)于在共用設(shè)施生產(chǎn)不同藥品的風(fēng)險識別中使用的基于健康的暴露限度的指南》
3�、《Cross-contamination control and Health Based Exposure Limits (HBEL) Q&As交叉污染控制與基于健康的暴露限(HBEL)問答》
4、ICH Q3C:殘留溶劑的指導(dǎo)原則
5��、ICH Q3D(R2):元素雜質(zhì)指導(dǎo)原則
6����、ICH M7:評估和控制藥物中的DNA活性(致突變)雜質(zhì)以限制潛在的致癌風(fēng)險
7����、《關(guān)于在清潔驗證中引入HBEL的考量》
8����、《APIC原料藥工廠中清潔驗證指南》
9、https://db.yaozh.com/(藥智數(shù)據(jù)庫�,很全面,90%以上的資料都有)
10����、https://www.cde.org.cn/(國家藥品監(jiān)督管理局藥品審評中心,查最新指導(dǎo)原則等)
11�、https://drugx.cn/(藥研導(dǎo)航,查各國藥監(jiān)局及藥典等)