一、可接受與不可接受狀態(tài)
醫(yī)療器械的設計與制造應當使其在預定條件下和為預期目的使用時����,依靠預期使用者的技術知識、經驗��、教育或培訓����,不會損害患者的臨床條件或安全性、或使用者的安全與健康�����,或其他人員的安全與健康�����,在權衡患者受益與高水平的健康與安全保障相一致時�����,任何與器械使用有關的風險都必須是可以接受的��。
(一)可接受的狀態(tài)
1�����、對非關鍵指令和控制功能,只有在兩個以上獨立故障����,或兩個以上獨立人為差錯,或獨立的故障和人為差錯組合發(fā)生�����,醫(yī)療器械才會造成災難或嚴重事故��;
2��、對關鍵的指令和控制功能����,只能在至少三個獨立故障或三次人為差錯�����,或三個獨立故障和人為差錯組合發(fā)生�����,醫(yī)療器械才會造成災難性或嚴重事故;
3��、醫(yī)療器械能有效地防止損壞從一個部件向另一個部件擴散��,或者防止可能造成事故的大量的能量傳輸����;
4、對動作��、相互作用或動作順序規(guī)定的限制可避免事故的發(fā)生��;
5����、采取有效的安全系數或規(guī)定的設計容差����,能把結構故障的可能性或足以造成事故的能量釋放限制在可接受的水平。
6��、控制了可能造成事故的能量聚集(如采用保險��、電氣防爆裝置和安全活門等)
7��、可容許暫時出現(xiàn)部件故障(由于醫(yī)療器械具有剩余強度或備用工作通道),而系統(tǒng)仍能繼續(xù)工作��,致使安全裕度降低到可接受的水平�����。
8��、對危險狀態(tài)能有效地向操作人員發(fā)出警告����,使操作人員有能力對危險狀態(tài)作出反應。
9��、限制或控制了危險材料的應用�����。
(二)不可接受狀態(tài)
下述安全狀態(tài)認為是不可接受的��,制造商應采取有效措施將風險降低到使用方可接受的水平��,并針對所采取的措施的成效進行驗證�����。
1�����、可能造成災難性或嚴重事故的單個部件故障����、單個共模故障、單次人為差錯��。
2��、可能造成災難性或嚴重事故的兩個部件獨立故障�����、兩次人為差錯����、或一個部件故障和一次人為差錯的組合,同時涉及關鍵指令和控制功能的情況����。
3、存在電離或非電離輻射或能量危險�����,而未對人員及敏感設備采取防護措施。
4��、可能造成事故的包裝及搬運�����,而未對人員及敏感設備采取有效防護措施�����。
5����、使用者認為其危險等級不可接受。
二����、安全性評價原則
1��、合法性原則
安全評價必須以國家法律��、法規(guī)����、政策����、標準等為依據�����,針對醫(yī)療器械的研發(fā)�����、生產和應用及管理中存在的問題����,從研發(fā)規(guī)范、安全生產�����、技術與操作培訓�����、使用環(huán)境、管理與維護規(guī)章等方面開展全面�����、細致�����、深入的剖析�����。
2��、科學性原則
安全評價必須依據科學的方法�����、程序����,以嚴謹的態(tài)度全面、準確客觀地工作�����,作出科學的結論����,并提出科學、有效的改進措施��。要根據相關領域的內在規(guī)律��,深入具體分析醫(yī)療器械面臨風險因素的種類�����、程度����、產生原因及可能出現(xiàn)的危害性后果。目前已有評價方法均有局限性�����,因此需要全面����、科學地分析各種評價方法的原理、特點��、適用范圍和條件,必要時還應采用多種評價方法進行綜合評價�����,互為補充�����,互相驗證�����,以提升評價結果的客觀性����。
3、公正性原則
對安全評價工作的每一項工作都需要做到客觀�����、公正�����,既要防止評價人員主觀因素的影響��,也要排除外界因素的干擾,安全評價的結論和建議要明確�����,不能模棱兩可����。
4����、針對性原則
一是要針對被評價醫(yī)療器械的特點,收集有關資料并進行全面分析�����;二是要對多種風險因素進行篩選�����,并針對其中主要的風險因素進行重點分析和評價��;三是要針對性地選擇評價方法��;四是要從醫(yī)療器械研發(fā)��、生產、應用����、管理的實際出發(fā),提出有針對性的操作性強的改進措施和方法�����。
三����、安全性評價依據
醫(yī)療器械安全性評價通常的程序:物理與化學性能評價?生物性能評價?臨床研究與試驗。物理與化學性能評價主要針對醫(yī)療器械的電氣安全性能����、輻射劑量、激光能量����、超聲能量、機械強度�����、耐疲勞性能等指標�����,生物性能評價則主要針對醫(yī)療器械的所用材料(特別是與人體接觸的材料)的生物相容性、毒性����、降解性、局部反應等指標�����。
各類安全標準是醫(yī)療器械安全性評價的關鍵依據����。ISO和接觸(國際電工委員會)制定了一系列切實可行的標準����,廣泛應用于世界各國包括醫(yī)療器械在內的各類儀器的性能評價。以IEC為例�����,其TC62技術委員會專門針對醫(yī)療電子儀器安全�����,該委員會又下屬4個專業(yè)委員會,分別針對:
(1)IEC/SC62A:醫(yī)用電氣設備通用內容
(2)IEC/SC62B:醫(yī)用診斷成像設備
(3)IEC/SC62C:醫(yī)用放射治療����、核醫(yī)學設備和輻射劑量設備
(4)IEC/SC62D:醫(yī)用電子設備
采取安全措施的優(yōu)先順序
為滿足系統(tǒng)安全要求和糾正已判定的危險,應按如下優(yōu)先順序采取糾正措施:
1�����、最小風險設計
首先是在設計上消除危險��,若不能消除已判定的危險��,應通過設計方案的選擇將其風險降低到使用方可接受的水平��。
2��、采用安全裝置
若不能通過設計消除已判定的危險或者通過設計方案選擇不能充分降低其有關風險��,則應通過采用永久的��、自動的或其他裝置����,是風險降至最低到使用方可接受的水平。可能時�����,應規(guī)定對安全裝置做定期的功能檢查����。
3����、采用告警裝置
若設計和安全裝置都不能有效地消除已判定的危險,或者不能充分降低其有關的風險��,則應采取告警裝置來檢測危險狀態(tài)��,并向有關人員發(fā)出適當的告警信號����。告警裝置的設計應使有關人員對警告信號作出錯誤反映的可能性最小����,而且在同類系統(tǒng)內應實現(xiàn)標準化。
4�����、制定專門規(guī)程和進行培訓
若通過設計方案選擇不能消除危險,或采用安全裝置和告警裝置不能充分降低其有關風險�����,則應制定專用規(guī)程和進行培訓�����。對嚴重性等級為I級或II級的危險絕對不能僅采用警告�����、注意事項或其他形式的提醒作為唯一的降低風險的方法�����。專門規(guī)程應包括人員防護設備的使用方法����。
醫(yī)療器械的風險評價
風險評價指的是按照危險嚴重性和危險可能性劃分等級,對危險的風險進行評價�����,并根據有關風險的評價決定對已判定的危險提出處理的方法。由于采取措施的首要優(yōu)先順序是通過設計來消除危險�����,所以在設計階段的早期�����,僅根據危險嚴重性進行風險評價一般是足夠的����。但是,當在設計階段的早期不能消除危險時�����,則應根據危險嚴重性����、危險可能性和風險影響進行風險評價�����,確定對危險采取糾正措施的優(yōu)先順序����。
(一)危險嚴重等級
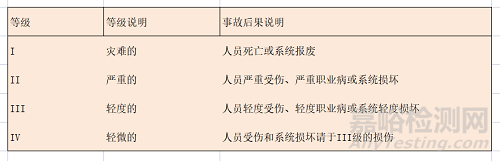
危險嚴重性由人為差錯��、環(huán)境條件�����、設計缺陷����、規(guī)程缺陷�����、系統(tǒng)級分系統(tǒng)或不見故障等引起的事故提供了定性度量�����,通常劃分為災難的(I級)����、嚴重的(II級)�����、輕度的(III級)��、和輕微的(IV級)4個等級��。
(二)危險可能性等級
在醫(yī)療器械壽命周期內造成危險的可能性可用單位(或事件��、活動等)可能發(fā)生的事故來描述����。在設計初期����,定量的危險概率數據不可能獲得����,一般可通過分析、相似系統(tǒng)的安全性信息獲得����。危險可能性通常分為頻繁發(fā)生A級����、很有可能發(fā)生B級、有時發(fā)生C級��、極少發(fā)生D級和不可能發(fā)生E級5個級別����。
(三)風險影響
風險影響包括任務能力和社會����、經濟、政治因素考慮某些風險的費用及影響�����。
1����、風險管理基本要求
風險管理過程
制造商應建立和保持與醫(yī)療器械有關的危害、估計和評價相關的風險��、控制這些風險并監(jiān)視上述控制過程的有效性����。此過程應當形成文件,文件應包括風險分析��、風險評價�����、風險控制和生產后信息�����。
風險管理職責
(1)在考慮相關國際標準、國家和地方法規(guī)的情況下�����,規(guī)定可接受風險的決策方法����;
(2)確保提供適當資源����;
(3)確保給管理����、實施工作和評定活動分配經過培訓的人員����;
(4)定期評審風險管理過程的結果��,以確保風險管理過程的持續(xù)適宜性和有效性����。
(5)確保風險管理工作者應具有與其任務相適宜的經驗和知識�����。適當時����,應包括醫(yī)療器械及其應用的知識和經驗�����,以及風險管理技術����。
風險管理計劃
對于所考慮的特定的醫(yī)療器械和附件,應按照風險管理過程�����,準備一項風險管理計劃����。風險管理計劃應是風險管理文檔的一部分����。此計劃包括:
(1)計劃的范圍,判定和描述適用于計劃的醫(yī)療器械和壽命周期階段�����。
(2)驗證計劃�����。
(3)職責的分配;
(4)風險管理活動的評審要求;
(5)風險的可接受準則����;
風險管理文檔 對醫(yī)療器械和附件的全部風險管理活動計劃�����、職責��、執(zhí)行過程和結果應予以記錄,并保存在風險管理文檔中��。
2��、風險分析
(1)醫(yī)療器械預期用途�����、預期目的和安全性有關的特征判定:對于你評價的醫(yī)療器械�����,制造商應描述預期用途、預期目的以及任何合理可預見的誤用。制造商應將所有可能影響醫(yī)療器械安全性的定性和定量特征列出清單��,適當時����,規(guī)定界限�����。上述文獻應保存在風險管理文檔中����。
(2)判定已知的或可預見的危害:制造商應編寫在正常和故障兩種條件下雨醫(yī)療器械有關的已知或可預見的危害清單����。事先已知的危害應加以識別。上述清單在風險管理文檔中予以保持����。在危害處境中產生事件的可預見的后果應予以考慮和記錄��。
(3)估計每種危害的一個或多個風險:對每一個判定的危害��,都應利用可得的資料或數據估計在正常和故障兩種條件下的一個或多個風險��。對于其損害發(fā)生的概率不能加以估計的危害��,應編寫一個危害的可能那個后果的清單��。風險的估計應在風險管理文檔中加以記錄��。
3����、風險評價
對每個已經判定的危害,制造商應使用風險管理計劃中規(guī)定的準則��,決定其估計的一個或多個風險是否低到不需要再予以降低的程度����。
4、風險控制
(1)降低風險:當需要降低風險時����,制造商應按照規(guī)定的程序控制一個或多個風險����,以便使與每個危害相關的一個或多個剩余風險被判斷為是可接受的;
(2)方案分析:制造商應識別風險控制措施��,以使其把風險降低到可接受的水平�����。
(3)風險控制措施的實施
(4)剩余風險的評價
(5)風險收益分析
(6)產生的其他危害
(7)風險評價的完整性
5、全部剩余風險評價
在所有的風險控制措施實施并驗證后�����,制造商應該利用風險管理計劃中的準則����,決定是否全部由醫(yī)療器械造成的剩余風險是可接受的�����。
6��、風險管理報告
風險管理過程的結果應記入風險管理報告����。風險管理報告應對每個危害提供風險分析��、風險評價�����、風險控制措施的實施與驗證����,以及剩余風險的可接受性評價的全部可追溯性�����。
7、生產后的信息收集與再評價
制造商應建立一個系統(tǒng)的程序����,以便于評審再生產后階段中得到的醫(yī)療器械或類似器械的信息。