OOS/OOT調(diào)查在日常研發(fā)和QC中遇到的可能性很大��,對(duì)此FDA等有指導(dǎo)原則�,國(guó)內(nèi)的企業(yè)也多數(shù)參考其制定了適合本身使用的內(nèi)部規(guī)程來(lái)指導(dǎo)和規(guī)范調(diào)查。一般要求調(diào)查時(shí)要進(jìn)行書面記錄����,以“偏差調(diào)查/CAPA”的形式記錄事件的發(fā)生情況、調(diào)查過(guò)程�、產(chǎn)生原因、CAPA�����。猶如警察斷案一般����,非常考驗(yàn)調(diào)查人員的經(jīng)驗(yàn)和分析能力���,對(duì)萌新更是一個(gè)不小的挑戰(zhàn)��。本文展示實(shí)際研發(fā)中的調(diào)查實(shí)例�,大家開(kāi)展調(diào)查和撰寫調(diào)查報(bào)告提供參考,個(gè)家之言難免有所疏漏����,敬請(qǐng)指正。
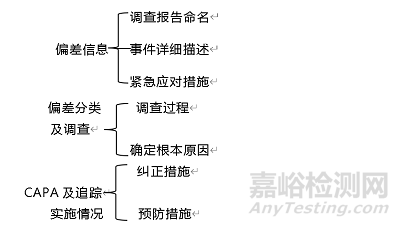
調(diào)查報(bào)告應(yīng)至少包括以下關(guān)鍵點(diǎn)(包括并不限于):
1. 偏差信息
偏差信息通常包括:調(diào)查報(bào)告命名���、事件詳細(xì)描述和緊急應(yīng)對(duì)措施��。
1.1. 調(diào)查報(bào)告命名
主要是把事件進(jìn)行概括����,便于存檔和隨時(shí)調(diào)閱��,查閱的人能夠立即知道事件的概要����。要包括發(fā)生OOS產(chǎn)品的名稱�、批號(hào)、涉及到的檢驗(yàn)項(xiàng)目����,如為穩(wěn)定性,還要包括考察條件和檢測(cè)時(shí)間點(diǎn)�����。
舉例:
泊沙康唑腸溶片(品名)123456批(批號(hào))穩(wěn)定性試驗(yàn)中間條件6個(gè)月(考察條件和時(shí)間)有關(guān)物質(zhì)(涉及到的檢驗(yàn)項(xiàng)目)調(diào)查報(bào)告。
1.2.事件描述
主要是要描述清楚什么人在什么時(shí)候�����、干了什么�����、發(fā)現(xiàn)了什么(具體到序列名稱����、序列中包含了什么等),結(jié)果是什么����?判定標(biāo)準(zhǔn)等,無(wú)論是上報(bào)還是書寫調(diào)查報(bào)告均需要描寫清楚��。如有必要需寫清楚發(fā)生地點(diǎn):要有識(shí)別性和唯一性���,增加房間編號(hào)�,如F13溶出室。
舉例:
2023年03月07日(時(shí)間)����,質(zhì)量研究部(地點(diǎn))王小二(人物)在檢測(cè)XXXX(產(chǎn)品)有關(guān)物質(zhì)定量限(檢驗(yàn)項(xiàng)目)時(shí)發(fā)現(xiàn):雜質(zhì)E的信噪比8.3(檢驗(yàn)結(jié)果要數(shù)字化)不符合標(biāo)準(zhǔn)規(guī)定,標(biāo)準(zhǔn)規(guī)定為≥10(必須寫清楚標(biāo)準(zhǔn)規(guī)定)��。如果數(shù)據(jù)較多�����,請(qǐng)用“表格”來(lái)表達(dá)�,清晰、美觀�、容易分辨。
1.3.緊急處理措施
主要是為了停止偏差繼續(xù)產(chǎn)生的影響�����,一些常用的措施有:停止液相序列進(jìn)行����、封存樣品、封存所用試劑試液等�。
2. 偏差分類及調(diào)查
偏差分類及調(diào)查顧名思義主要是指調(diào)查的過(guò)程及最終確定偏差發(fā)生的根本原因����。
2.1.調(diào)查過(guò)程
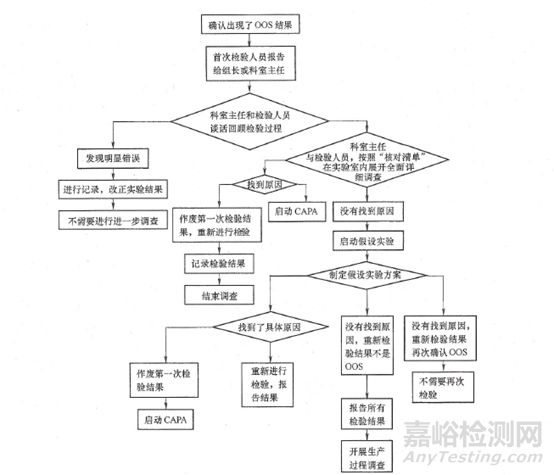
調(diào)查的核心目的是通過(guò)對(duì)實(shí)驗(yàn)室進(jìn)行本次檢驗(yàn)的各個(gè)環(huán)節(jié)(人�、機(jī)��、料�、法、環(huán)等)進(jìn)行詳細(xì)的檢查����,以期發(fā)現(xiàn)實(shí)驗(yàn)室質(zhì)量管理體系方面的缺陷,找出原因�,進(jìn)一步提高實(shí)驗(yàn)室質(zhì)量管理水平和檢驗(yàn)檢測(cè)能力,保證檢驗(yàn)結(jié)果的準(zhǔn)確可靠���。2019版中國(guó)藥品檢驗(yàn)標(biāo)準(zhǔn)操作規(guī)范中對(duì)OOS的調(diào)查過(guò)程也進(jìn)行了詳細(xì)的描述�。
圖1調(diào)查流程圖
實(shí)驗(yàn)室一般從離異常/OOS/OOT結(jié)果或異?���,F(xiàn)象最近的步驟開(kāi)始調(diào)查(積分、計(jì)算�、灌注、濾過(guò)�����、定容、稀釋�、移液、溶解���、崩解���、稱量、取樣等等)����。而且,在確認(rèn)所有的試驗(yàn)操作均與SOP保持一致的基礎(chǔ)上�����,檢驗(yàn)人員一定要仔細(xì)回顧溶液制備時(shí)間��、可疑的所有環(huán)節(jié)�����、操作和檢驗(yàn)過(guò)程中的現(xiàn)象如:是否溶液顏色異常��?渾濁���?沉淀�����?絮狀物�����?溶出度的取樣體積是否正常�����?等等�����。溫度也是一個(gè)值得注意卻常常被忽視的影響因素���,當(dāng)天實(shí)驗(yàn)室溫度如何,有沒(méi)有最近溫度驟降或升溫導(dǎo)致的室內(nèi)溫度變化�?
2.2.確定根本原因
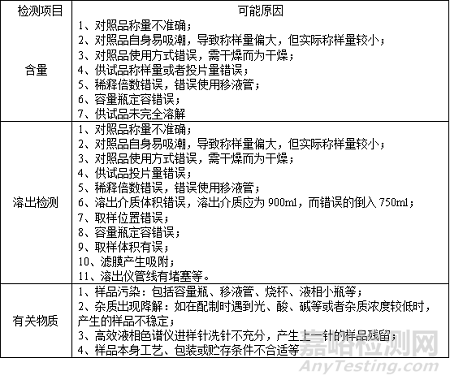
確定根本原因一般是在考慮多種可能原因后,經(jīng)過(guò)調(diào)查試驗(yàn)���,最終得出的產(chǎn)生偏差的最根本的原因�����。以圖表呈現(xiàn)更加清晰簡(jiǎn)潔���,
對(duì)于各個(gè)環(huán)節(jié)可能出現(xiàn)的問(wèn)題進(jìn)行合理的假設(shè)并進(jìn)行重復(fù)檢測(cè)���,通過(guò)調(diào)查最終確定其偏差發(fā)生的根本原因。為此�,對(duì)可能產(chǎn)生偏差的環(huán)節(jié)及其原因進(jìn)行了歸納總結(jié),如下表:
3. CAPA及追蹤實(shí)施情況
CAPA及追蹤實(shí)施情況主要包含兩個(gè)部分:一是確定根本原因后的糾正措施��;而是確定根本原因后的預(yù)防措施�����。
3.1.糾正措施
糾正措施是糾正確定產(chǎn)生偏差的根本原因后�,重新進(jìn)行的樣品或方法檢測(cè)。
例如:在某某項(xiàng)目���,含量分析方法的方法轉(zhuǎn)移試驗(yàn)中���,所測(cè)含量超出95%~105%限度的根本原因?yàn)槎较♂寱r(shí)移液管使用錯(cuò)誤。對(duì)此的糾正措施為:更換正確的移液管后重新配制樣品重新進(jìn)行含量分析方法的方法轉(zhuǎn)移����。
3.2.預(yù)防措施
是在確定偏差產(chǎn)生的根本原因后�����,針對(duì)此原因制定的預(yù)防后期產(chǎn)生相同偏差的措施。制定有針對(duì)性的預(yù)防措施�,才能預(yù)防同樣事件重復(fù)發(fā)生,減少重復(fù)試驗(yàn)�����,從而提高工作效率����。并且制定的預(yù)防措施,如果能加入SOP的一定加入SOP����,不能靠人傳人或者口頭培訓(xùn)。對(duì)于操作性的SOP����,一定要細(xì)化并進(jìn)行詳細(xì)的培訓(xùn)。防止不同人員理解不同����,導(dǎo)致誤操作���。
例如:在某某項(xiàng)目的有關(guān)物質(zhì)定量限檢測(cè)中發(fā)現(xiàn)某一雜質(zhì)的峰面積低于該雜質(zhì)理論定量限溶液峰面積的10倍,后經(jīng)過(guò)調(diào)查發(fā)現(xiàn)其根本原因?yàn)?�,該雜質(zhì)在定量限濃度及其更低濃度時(shí)�����,在溶劑中不穩(wěn)定����,易降解。故針對(duì)此原因制定的預(yù)防措施為���,將“定量限溶液臨用新制和進(jìn)樣盤控溫4℃”定入SOP并在培訓(xùn)時(shí)著重強(qiáng)調(diào)此項(xiàng)注意事宜����。
不管是糾正措施還是預(yù)防措施都必須要有一定的時(shí)限性�,且責(zé)任明確并設(shè)定人員跟蹤確認(rèn)完成情況。
參考文獻(xiàn):
[1]FDA: Investigating Out-of-Specification (OOS) Test Results for Pharmaceutical Production
[2]中國(guó)藥品檢驗(yàn)操作規(guī)范2019年版-異常檢驗(yàn)結(jié)果調(diào)查指導(dǎo)原則