前言
近年來(lái)大家關(guān)注的主流滅菌方案有美國(guó)注射劑協(xié)會(huì)發(fā)布的《濕熱滅菌程序的驗(yàn)證:滅菌程序的設(shè)計(jì)�����、開發(fā)、確認(rèn)及日常監(jiān)控》����、 歐盟推出的《制劑����、原料藥、輔料和內(nèi)包材滅菌指南》��、日本厚生省的《通過最終滅菌方法生產(chǎn)無(wú)菌藥物的準(zhǔn)則》及中國(guó)的《化學(xué)藥品注射劑滅菌和無(wú)菌工藝研究及驗(yàn)證指導(dǎo)原則(試行)》。
針對(duì)如此繁多的滅菌指導(dǎo)原則�����,本文就和大家聊聊如何在符合申報(bào)條件下選擇更具有科學(xué)性和優(yōu)勢(shì)的滅菌方案?以及滅菌到底在滅些什么��?終端滅菌注射劑最終走向何方?
一����、 無(wú)菌藥品
1.1 無(wú)菌藥品的概念
《化學(xué)藥品注射劑滅菌和無(wú)菌工藝研究及驗(yàn)證指導(dǎo)原則(試行)》針對(duì)無(wú)菌藥品給出了準(zhǔn)確的概述,即是指法定藥品標(biāo)準(zhǔn)中列有無(wú)菌檢查項(xiàng)目的制劑和原料藥��,一般包括注射劑�����、無(wú)菌原料藥及滴眼劑等�����。
由于目前無(wú)菌檢驗(yàn)手段的局限性,不存在絕對(duì)意義的無(wú)菌��,現(xiàn)在大家所理解的無(wú)菌只是概率意義上的“無(wú)菌”����,即采用科學(xué)合理的SAL(無(wú)菌保證水平)保證最終產(chǎn)品的PUSN(無(wú)菌保證值)達(dá)到≤10E-6�����。
1.2 兩個(gè)重要概念
先和大家聊聊比較容易混淆兩個(gè)概念��,即SAL和PUSN:
SAL(英文全稱:Sterility Assurance Level):無(wú)菌保證水平�����,通過科學(xué)合理的滅菌/除菌工藝����、良好的無(wú)菌保證體系及嚴(yán)格執(zhí)行藥品生產(chǎn)質(zhì)量管理規(guī)范( GMP )使藥品中活微生物存在的概率低至某個(gè)可接受的水平,SAL的主體是滅菌/除菌工藝��。
PNSU(英文全稱:Probabilityofa Nonsterile Unit):無(wú)菌保證值�����,是指通過科學(xué)合理的滅菌/除菌工藝,制劑產(chǎn)品的無(wú)菌保證值必須≤10-6��,PNSU的主體是產(chǎn)品��。
1.3 本文涉及的范圍
面對(duì)如此紛繁復(fù)雜的無(wú)菌技術(shù)����,本文僅涉及采用終端滅菌工藝的最終滅菌產(chǎn)品,以點(diǎn)破面��,來(lái)了解各國(guó)無(wú)菌策略的異同��。
二����、 主流國(guó)家的滅菌策略
2.1 美國(guó)注射劑協(xié)會(huì)
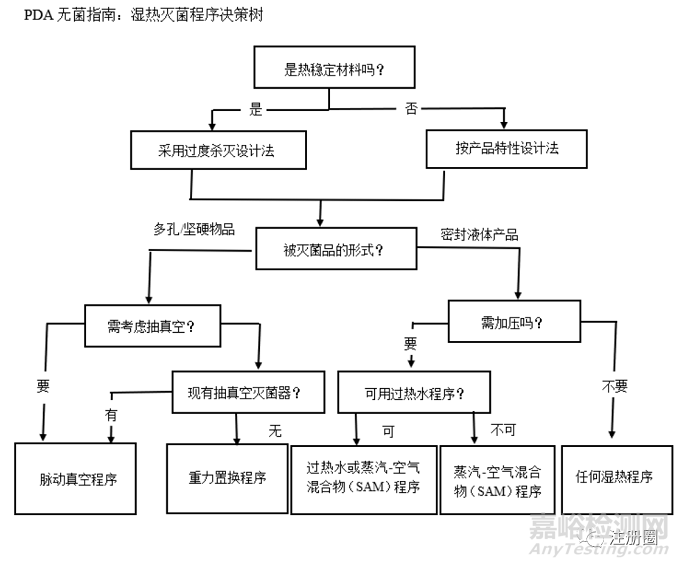
美國(guó)注射劑協(xié)會(huì)(PDA)發(fā)布的《濕熱滅菌程序的驗(yàn)證:滅菌程序的設(shè)計(jì)、開發(fā)�����、確認(rèn)及日常監(jiān)控》��,PDA的理念是根據(jù)滅菌物品熱穩(wěn)定性科學(xué)合理的選擇相適應(yīng)的滅菌程序��。
PDA的無(wú)菌指南分為過度殺滅和根據(jù)產(chǎn)品特性設(shè)計(jì)滅菌這兩大滅菌策略��,過度殺滅程序強(qiáng)調(diào)的是被滅菌產(chǎn)品獲得F0PHY( 物理殺滅時(shí)間) 和F0BIO (生物殺滅時(shí)間)至少為12 min ����,根據(jù)產(chǎn)品特性設(shè)計(jì)滅菌程序強(qiáng)調(diào)的是針對(duì)不同種類產(chǎn)品,科學(xué)合理的選擇不同的滅菌方式����;雖然也有過度殺滅程序,但是不糾結(jié)F0和8min的關(guān)系��。
2.2 歐盟
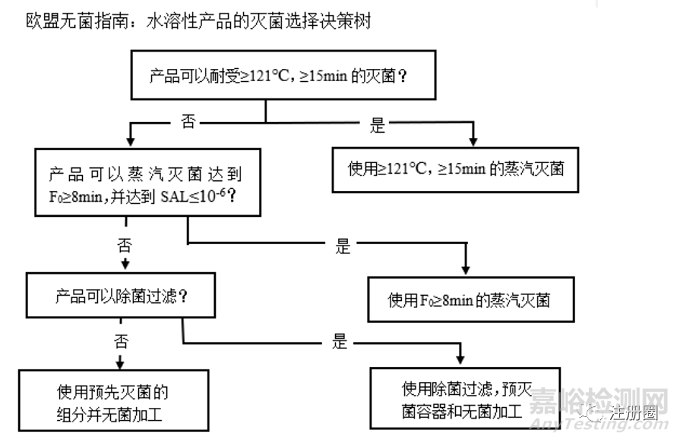
歐盟推出的《制劑����、原料藥、輔料和內(nèi)包材滅菌指南》��,以水溶性產(chǎn)品的滅菌決策樹終端滅菌工藝為例,歐盟的理念是盡可能地提高生產(chǎn)工藝的無(wú)菌保證水平����,用以保證產(chǎn)品的無(wú)菌保證值。
歐盟的無(wú)菌指南強(qiáng)調(diào)的是滅菌條件首選121℃��,15min�����,其次就是選擇F0≥8min�����,SAL≤10-6����,提出了產(chǎn)品各組份可以根據(jù)產(chǎn)品特性分別科學(xué)合理的選擇不同的滅菌方式,盡可能地提高生產(chǎn)工藝的無(wú)菌保證水平����。
2.3 日本
日本厚生省的《通過最終滅菌方法生產(chǎn)無(wú)菌藥物的準(zhǔn)則》,日本的理念是更加注重對(duì)終端熱處理的應(yīng)用�����。
日本的無(wú)菌指南強(qiáng)調(diào)的是F0值<8min,即熱處理工藝的運(yùn)用��,利用生物指示劑和微生物負(fù)載結(jié)合法�����,科學(xué)合理的選擇更高的無(wú)菌保證水平��,此無(wú)菌策略需要進(jìn)行嚴(yán)格的滅菌驗(yàn)證及日常微生物(物料及環(huán)境)負(fù)荷檢測(cè)�����,這個(gè)和沒有滅菌選擇決策樹是日本的無(wú)菌指南的兩大特點(diǎn)��,所以大家現(xiàn)階段在仿制日本注射劑需要特別注意其滅菌方式��,盡量避開不符合國(guó)內(nèi)無(wú)菌指南的產(chǎn)品��。
2.4 中國(guó)
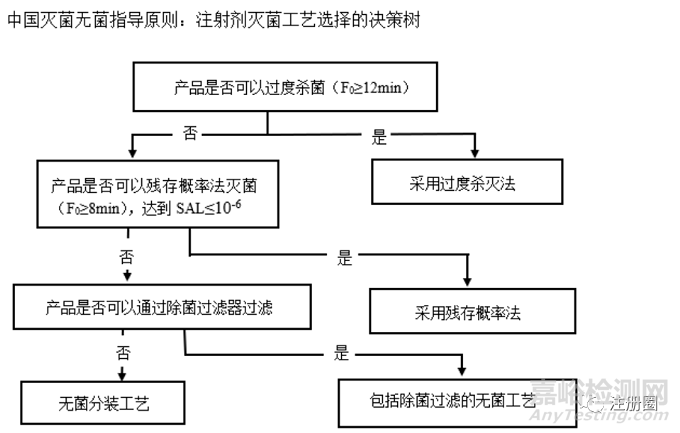
國(guó)內(nèi)的《化學(xué)藥品注射劑滅菌和無(wú)菌工藝研究及驗(yàn)證指導(dǎo)原則(試行)》����,基本上借鑒并簡(jiǎn)化了歐盟的《制劑����、原料藥��、輔料和內(nèi)包材滅菌指南》����。
國(guó)內(nèi)的無(wú)菌指導(dǎo)原則強(qiáng)調(diào)的是過度殺滅法(F0≥12min)和殘存概率法(min 8≤F0)����,這兩種滅菌工藝不合適只能選擇無(wú)菌生產(chǎn)工藝,并沒參照PDA及日本指南��,在F0<8min的熱處理上使無(wú)菌保證水平達(dá)到≤10-6�����,這樣簡(jiǎn)單粗暴的滅菌工藝選擇有好有壞����。
好處:
(1)降低制藥企業(yè)滅菌工藝選擇的難度;
壞處:
(1)相當(dāng)一部分的注射劑無(wú)法仿制,尤其參比制劑是日本廠家的����;
(2)一部分的注射劑一致性評(píng)價(jià)無(wú)法進(jìn)行,F(xiàn)0值<8min的��;
(3)會(huì)降低注射劑的無(wú)菌保證水平,終端熱處理變成無(wú)菌生產(chǎn)工藝��,帶來(lái)臨床安全問題��;
(4)昂貴的生產(chǎn)成本及更低的無(wú)菌保證水平����,不利于國(guó)內(nèi)產(chǎn)品出口�����;
三�����、 如何在符合申報(bào)條件下選擇更具有科學(xué)性和優(yōu)勢(shì)的滅菌方案��?
3.1 仿制藥滅菌方案
查詢參比制劑處方工藝或經(jīng)參比制劑重復(fù)滅菌推測(cè)����,選擇與參比制劑相同且不低于國(guó)內(nèi)無(wú)菌指導(dǎo)原則的滅菌方案,如日本相當(dāng)多的注射劑采用F0<8min的終端熱處理方案����,國(guó)內(nèi)現(xiàn)階段對(duì)于F0<8min的終端熱處理方案不認(rèn)可,若采用殘存概率法(min 8≤F0),產(chǎn)品的理化指標(biāo)容易超參比制劑且不符合質(zhì)量標(biāo)準(zhǔn)�����,采用無(wú)菌生產(chǎn)工藝又難以達(dá)到參比制劑的無(wú)菌保證值��,所以在調(diào)研仿制項(xiàng)目時(shí)需考量參比制劑的無(wú)菌保證水平即滅菌/除菌工藝是否符合國(guó)內(nèi)的無(wú)菌指導(dǎo)原則��。
3.2 創(chuàng)新藥滅菌方案
創(chuàng)新藥的滅菌方案應(yīng)依據(jù)各組分的化學(xué)結(jié)構(gòu)特點(diǎn)�����、處方工藝研究及理化指標(biāo)穩(wěn)定性��,以患者的臨床收益為核心��,現(xiàn)階段按國(guó)內(nèi)無(wú)菌指導(dǎo)原則(注射劑滅菌工藝選擇的決策樹)科學(xué)合理的選擇更具有科學(xué)性和優(yōu)勢(shì)的滅菌方案����。
四、 滅菌到底在滅些什么��?
滅菌通俗的講就是通過科學(xué)合理的滅菌/除菌工藝��、良好的無(wú)菌保證體系及嚴(yán)格執(zhí)行藥品生產(chǎn)質(zhì)量管理規(guī)范( GMP )使藥品中活微生物存在的概率低至某個(gè)可接受的水平��,即這個(gè)可接受的水平必須≤10-6�����。
滅菌的核心是患者的臨床收益����,科學(xué)合理的滅菌是根據(jù)產(chǎn)品特性設(shè)計(jì)滅菌程序,是針對(duì)不同種類產(chǎn)品選擇不同的滅菌方式,在產(chǎn)品的無(wú)菌保證值和質(zhì)量之間尋找一個(gè)平衡點(diǎn)����,即在滿足產(chǎn)品無(wú)菌保證值的前提下使用一切可以使用的滅菌/除菌工藝來(lái)提高產(chǎn)品質(zhì)量��,盡最大可能提高患者的臨床收益����。
滅菌到底在滅些什么?滅菌為患者滅掉了安全風(fēng)險(xiǎn)����,留下了藥品療效。
五��、 終端滅菌注射劑最終走向何方����?
我推測(cè)現(xiàn)階段國(guó)家發(fā)布的《化學(xué)藥品注射劑滅菌和無(wú)菌工藝研究及驗(yàn)證指導(dǎo)原則(試行)》是基于當(dāng)前的認(rèn)知的過渡性指導(dǎo)原則��。
我們身處技術(shù)大爆炸時(shí)代����,隨著國(guó)內(nèi)科技水平的提高����,對(duì)滅菌和無(wú)菌工藝研究更加的深入�����,以前的滅菌/無(wú)菌策略經(jīng)驗(yàn)在以后不再全盤適用�����,不再拘泥于簡(jiǎn)單的滅菌決策樹,更多基于患者臨床收益為核心的滅菌/無(wú)菌策略必將涌現(xiàn)����。
終端滅菌注射劑最終走向何方�����?
當(dāng)前:采用國(guó)內(nèi)無(wú)菌指導(dǎo)原則的滅菌方案;
以后:會(huì)綜合采用基于產(chǎn)品特性的滅菌方案��,即對(duì)不同種類產(chǎn)品,科學(xué)合理的選擇不同的滅菌方式����,模糊F0和8min的關(guān)系��,終端熱處理工藝也將會(huì)被考慮使用;
未來(lái):隨著對(duì)滅菌和無(wú)菌工藝研究的深入(盡最大可能提高患者臨床收益)�����,全套設(shè)備系統(tǒng)性能的提升(更高的無(wú)菌保證水平�����,可以全程即時(shí)的微生物負(fù)荷水平監(jiān)測(cè)),自動(dòng)化邁入新的階段(消除人為的干擾)��,會(huì)更加科學(xué)合理的設(shè)計(jì)滅菌/無(wú)菌工藝(針對(duì)性的設(shè)計(jì)產(chǎn)品獨(dú)有的滅菌/無(wú)菌工藝)��。
六、 總結(jié)
以患者的臨床收益為核心是我們制藥工作者的出發(fā)點(diǎn)和落腳點(diǎn),現(xiàn)行的滅菌/無(wú)菌工藝帶來(lái)的臨床安全問題會(huì)隨著時(shí)間的推移逐漸顯現(xiàn)����,這可能也是國(guó)家基于當(dāng)前的認(rèn)知做出的無(wú)奈之舉�����。
相信隨著國(guó)內(nèi)科技水平的提高����,我國(guó)的無(wú)菌指南會(huì)綜合學(xué)習(xí)并改進(jìn)發(fā)達(dá)國(guó)家的無(wú)菌策略��,更加科學(xué)合理的選擇產(chǎn)品的無(wú)菌工藝����,保障患者的臨床收益。
參考文獻(xiàn)
[1] 《化學(xué)藥品注射劑滅菌和無(wú)菌工藝研究及驗(yàn)證指導(dǎo)原則(試行)》
[2] 《中國(guó)藥典》(2020 年版)
[3] 國(guó)家藥品監(jiān)督管理局.關(guān)于發(fā)布除菌過濾技術(shù)及應(yīng)用指南等3 個(gè)指南的通告 (2018 年第 85 號(hào))
[4] 謝紀(jì)珍, 馮巧巧, 劉軍田,等. 化學(xué)藥品注射劑滅菌工藝選擇及工藝驗(yàn)證常見問題探討[J]. 藥學(xué)研究, 2018, 37(6):3.
[5]鄒萍. 化學(xué)藥品注射劑滅菌工藝選擇和工藝驗(yàn)證常見問題分析[J]. 神州, 2019(18):1.
[6]楊森森, 李永豐, 魏俊卿,等. 化學(xué)藥品注射劑滅菌工藝選擇及工藝驗(yàn)證中注意事項(xiàng)[J]. 益壽寶典, 2020(028):000.
[7] 《通過最終滅菌方法生產(chǎn)無(wú)菌藥物的準(zhǔn)則》
[8]PDA Sterilizing Filtration of Liquids Report No. 26 (2008Revision) of PDA.
[9] PDA Process Simulation Testing for Aseptically Filled Productsechnical Report No. 22 (2011 Revision) of PDA.
[10] PDA technical Report No. 44 Quality risk management foraseptic processes(2008).
[11] EU.GMP Annex 1 : Manufacture of Sterile Products(2020).
[12] EMA. Guideline on the sterilisation of the medicinal product,active substance, excipient and primary container(2019).