目的
通過中國臨床試驗注冊中心(ChiCTR)的臨床試驗注冊信息����,分析已注冊的真實世界研究(RWS)現(xiàn)狀���。
方法
以“真實世界”為檢索詞檢索ChiCTR網(wǎng)站����,搜集真實世界研究相關(guān)注冊項目�����,檢索時限從建庫至2022年5月4日�,采用描述性分析方法進行匯總。
結(jié)果
共納入642個研究注冊項目���。單個研究樣本量中位數(shù)為482例����;RWS以觀察性研究為主,干預(yù)性研究數(shù)量逐年增加����。研究所處階段為上市后藥物監(jiān)測或Ⅳ期臨床試驗階段的研究共267項(41.59%)。主要測量指標以臨床結(jié)局指標居多(56.23%)����,其中使用最多的為總生存期/總生存率(15.79%)。62.15%的注冊項目符合注冊最低要求���。
結(jié)論
ChiCTR注冊RWS數(shù)量呈遞增趨勢�,但目前存在RWS概念不清����、注冊內(nèi)容填寫不規(guī)范、數(shù)據(jù)共享方式混亂的問題�,注冊研究完整度和內(nèi)容質(zhì)量有待提升。
真實世界研究(real world study����,RWS)是指在真實臨床、社區(qū)或家庭環(huán)境下獲取多種數(shù)據(jù)��,評價某種治療措施對患者健康的影響,是當前醫(yī)藥領(lǐng)域的研究熱點��。2018 年中國首個 RWS 指南問世�,次年中國真實世界數(shù)據(jù)與研究聯(lián)盟發(fā)表了 RWS 系列技術(shù)規(guī)范��。隨著 RWS 方法學(xué)和技術(shù)規(guī)范的制定���,RWS 的可靠性和可行性大幅提升��,也為促進真實世界證據(jù)的生產(chǎn)和使用提供更多參考依據(jù)�。相比于傳統(tǒng)臨床試驗���,RWS 更適用于在普通人群中評價上市后藥物和療法的安全性與有效性����。RWS 具有外部效度強�����、樣本量大�����、研究過程中可調(diào)整方案、數(shù)據(jù)來源多樣�����、結(jié)局指標臨床意義明確等優(yōu)點�, 但同時存在概念混淆、注冊信息缺失等問題��。
臨床試驗注冊作為促進臨床研究透明化的重大舉措���,已被研究者熟知并接受�����。中國臨床試驗注冊中心(Chinese clinical trial registry�,ChiCTR)由四川大學(xué)華西醫(yī)院建立�����,是世界衛(wèi)生組織(world health organization��,WHO)國際臨床試驗注冊平臺一級注冊機構(gòu)��。其目的在于公開臨床試驗信息、追溯試驗結(jié)果����、避免不必要的重復(fù)研究。ChiCTR 是國內(nèi)唯一被 WHO 認證的臨床試驗一級注冊平臺�。臨床試驗注冊不僅可推動臨床試驗透明化,更可減少設(shè)計和實施過程中潛在的偏倚風(fēng)險��,節(jié)約研究資源�,WHO 推薦所有的臨床試驗都應(yīng)進行注冊���。為分析 RWS 注冊現(xiàn)狀�����,改善 RWS 注冊中的不規(guī)范行為���,本研究基于 ChiCTR 網(wǎng)站,對涉及真實世界研究的注冊臨床試驗進行特征分析��,以此了解 RWS 注冊現(xiàn)狀��,探討相應(yīng)問題�。
1、資料與方法
1.1 納入與排除標準
納入標準:所有題目中帶有“真實世界”的臨床試驗項目,無論采用何種研究類型和研究設(shè)計��。排除標準:重復(fù)注冊項目和研究者撤消項目��。
1.2 項目檢索策略
以“真實世界”為檢索詞��,在 ChiCTR 網(wǎng)站 (http://www.chictr.org.cn/)的注冊題目中檢索�,檢索時限從建庫至 2022 年 5 月 4 日。
1.3 項目篩選與資料提取
2名研究者對納入的臨床試驗注冊項目進行獨立篩選���、提取資料后交叉核對�,如有分歧��,則通過討論或與第三方共同協(xié)商解決�����。
資料提取內(nèi)容包括:
① 注冊研究的基本信息:注冊題目����、研究課題的正式學(xué)科名稱、注冊時間��、申請人所在單位���;
② 研究的設(shè)計信息:研究目的��、研究疾病���、研究所處階段�����、研究類型�、研究設(shè)計����、干預(yù)措施����、樣本量、主要測量指標����、研究實施負責單位、研究實施地點��。其中本研究將主要測量指標分為臨床結(jié)局指標和替代指標�����。在研究所處階段、研究類型�����、研究設(shè)計方面�����,均采用 ChiCTR 注冊時相應(yīng)條目下拉框中的內(nèi)容����,不做其它分類;
③ 其他內(nèi)容:注冊號狀態(tài)�����、倫理審查����、數(shù)據(jù)采集和管理、原始數(shù)據(jù)共享等��。
根據(jù) WHO 國際臨床試驗注冊協(xié)作網(wǎng)(international clinical trials registry platform�����,ICTRP)的最低注冊條目判定注冊項目的完整度。最低注冊條目共 20 條�����,均在 ChiCTR 中體現(xiàn)��。未提取數(shù)據(jù)的條目直接在提取數(shù)據(jù)過程中判定是否符合完整度要求��。
1.4 統(tǒng)計分析
定量數(shù)據(jù)如樣本量采用中位數(shù)與四分位數(shù)進行描述分析����,定性數(shù)據(jù)采用頻數(shù)和百分比描述分析。采用 Excel 軟件錄入����、整理數(shù)據(jù)��,采用 GraphPad Prism 8 分析數(shù)據(jù)����。
2、 結(jié)果
2.1 項目篩選結(jié)果
共檢索“真實世界”注冊項目 643 項�,排除 1 項研究者撤消項目����,共納入 642 項注冊項目����。
2.2 納入項目的基本特征
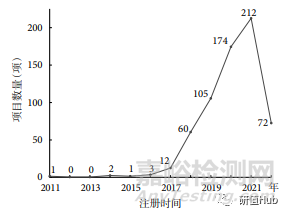
注冊項目數(shù)量 從 2015 年開始,RWS 注冊項目數(shù)量逐年遞增����,2021 年達到 212 項,2022 年截至 5 月 4 日注冊數(shù)量達到 72 項����。結(jié)果見圖1。
圖 1 2011~2022 年 ChiCTR 注冊 RWS 臨床試驗
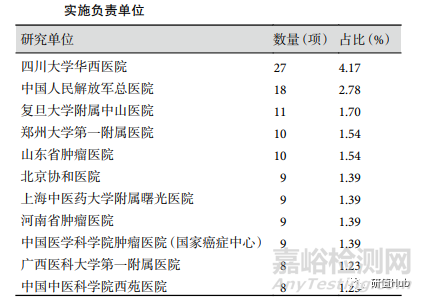
研究實施負責單位和實施地點 所有項目涉及的研究實施負責單位共 269 家�,注冊項目數(shù)量最多的 11 家單位見表 1,注冊項目數(shù)量≥5 項的單位共 34 家����。199 項注冊項目為兩個及以上醫(yī)院合作, 其中與韓國進行國際合作的項目 2 項��,省內(nèi)醫(yī)院合作項目 97 項���,跨?��。ㄊ校┽t(yī)院合作的項目 99 項��。研究實施地點數(shù)量前 3 位的?���。ㄊ校┓謩e為北京(65 項)�����、 江蘇(51 項)和河南(48 項)����。實施地點最多的項目為華中科技大學(xué)附屬協(xié)和醫(yī)院作為主辦單位實施負責的一項促動力藥維持治療功能性消化不良的臨床療效與安全性研究,由 98 家醫(yī)院共同合作�。
表 1 ChiCTR 注冊RWS臨床試驗項目數(shù)量
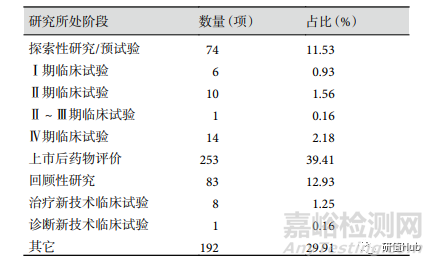
研究所處階段 注冊信息中明確研究所處階段的項目有 450 項(70.09%),最多的為上市后藥物評價 253 項(39.41%)�,其次為回顧性研究 83 項(12.93%),Ⅱ�����、Ⅲ期臨床試驗共有 11 項(1.72%)�����。各階段研究項目數(shù)量見表2����。
表 2 ChiCTR 注冊RWS臨床試驗研究所處階段
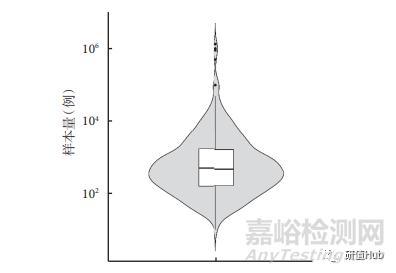
注冊項目樣本量 642 項注冊項目的總樣本量為 7,815,542 例,其中樣本量超過 1 萬例的共 53 項�����,小于 50 例的共 59 項���;除樣本量為 0 的注冊項目外�,樣本量最小的為 10 例�����,最大的為 133 萬 例���;所有項目樣本量的中位數(shù)及四分位數(shù)為 482(150,1500)例���,樣本量分布見圖2����。
圖 2 ChiCTR注冊RWS臨床試驗樣本量分布
研究類型與研究設(shè)計 根據(jù) ChiCTR 設(shè)置的研究類型分類,RWS 以觀察性研究為主����,共 481 項 (74.92%),其次為干預(yù)性研究127 項(19.78%)�����,診斷試驗 9 項(1.40%)�����,治療新技術(shù)臨床研究 8 項(1.25%)����,其他類型如流行病學(xué)研究、病因?qū)W/相關(guān)因素研究����、預(yù)后研究、預(yù)防性研究��、基礎(chǔ)科學(xué)研究和衛(wèi)生服務(wù)研究等共 17 項(2.65%)�。
研究設(shè)計數(shù)量排名前五位的分別是單臂 178 項 (27.73%),連續(xù)入組 154 項(23.99%)��,非隨機對照試驗 107 項(16.67%)����,隊列研究 79 項(12.31%)和析因分組 49 項(7.63%)。干預(yù)性研究中��,實效性隨機對照試驗(pragmatic randomized controlled trial�, pRCT)共 38 項(29.92%),其對照組采取陽性對照措施居多(84.21%)��,且樣本量除一項研究外均大于 50 例��。
主要測量指標 將主要測量指標分為臨床結(jié)局指標和替代指標兩類�,分別有 361 項和 278 項, 另外 3 項注冊項目無測量指標����。臨床結(jié)局指標使用最多的為總生存期/總生存率(15.79%),其次為不良反應(yīng)/不良事件/不良事件發(fā)生率(13.57%)��;替代指標使用最多的為無進展生存期/中位無進展生存期(37.77%)�����。
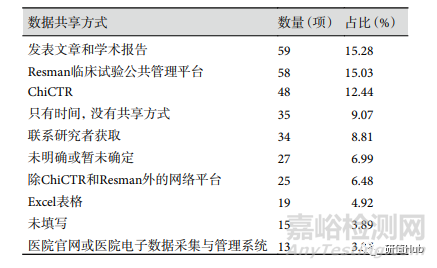
原始數(shù)據(jù)共享 納入研究中,256 項(39.88%) 注冊項目未進行數(shù)據(jù)共享�,其中不進行數(shù)據(jù)共享但卻填入共享方式的項目共 162 項;386 項(60.12%) 注冊項目同意數(shù)據(jù)共享����,但共享方式為不公開的項目有 7 項。同意數(shù)據(jù)共享的項目中��,共享方式以采用發(fā)表文章和學(xué)術(shù)報告進行數(shù)據(jù)共享最多��,其次為通過 Resman 臨床試驗公共管理平臺和 ChiCTR�����, 數(shù)據(jù)共享方式見表3��。
表 3 ChiCTR注冊RWS臨床試驗同意數(shù)據(jù)共享項目共享方式排名前10位
研究疾病分布 在 642 項研究中����,除 5 項藥物評價和 7 項器械或技術(shù)作用效果研究外,630 項研究共涉及 19 個疾病類型和 8 個中醫(yī)證候�����。其中�,腫瘤(261 項)�、心腦血管疾?。?7 項)和消化系 統(tǒng)疾病(46 項)研究相對較多����,各研究疾病類型詳見表 4����。研究最多的疾病為肺癌(共 56 項研究,其 中非小細胞肺癌占 43 項)�����,其次為乳腺癌(50 項) 和肝癌(39 項��,其中肝癌為 22 項�,肝細胞癌為 15 項,肝內(nèi)膽管細胞癌為 2 項)��。
2.3 納入項目整體分析
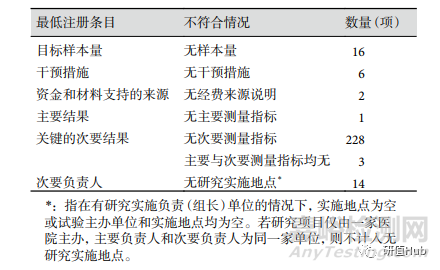
注冊項目完整度 642 項研究中����,共 399 項 (62.15%)注冊項目符合最低要求條目。自 2019 年開始��,臨床試驗注冊項目完整度逐年增加,從 19 年 58.33% 增加到 2022 年 65.28%����。不符合的條目集中在樣本量為 0(16 項)、無干預(yù)措施(6 項)����、 無主要測量指標(4 項)和無研究實施地點(14 項), 見表5�����。
表 5 ChiCTR注冊RWS臨床試驗項目不符合最低注冊要求情況
注冊項目內(nèi)容質(zhì)量評估 在最低注冊條目中���,干預(yù)措施�、患者入選情況��、主要結(jié)果和關(guān)鍵次要結(jié)果四個條目的內(nèi)容不完善是導(dǎo)致注冊項目內(nèi)容質(zhì)量較低的主要原因��。干預(yù)措施要求標明其持續(xù)時間����,而干預(yù)性研究中僅有 10 項(7.81%)研究標明;患者入選情況應(yīng)該包括該信息是否可得�����,若可得,則點擊具體鏈接�,而 ChiCTR 注冊條目中僅有征募研究對象的時間及征募進展,且通常未得到及時更新�����;主要和關(guān)鍵次要結(jié)果描述內(nèi)容應(yīng)包括測量該結(jié)果的時間�����,僅有 69 項(10.75%)研究描述了主要測量指標的測量時間點����。
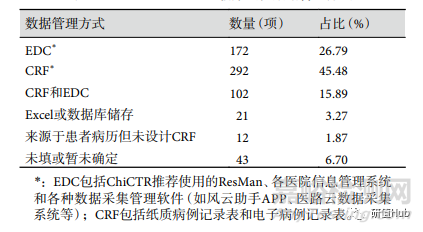
除最低注冊條目外��,數(shù)據(jù)管理系統(tǒng)同樣存在內(nèi)容不符合要求的問題�����。注冊結(jié)果中僅有 102 項(15.89%)同時包含病例記錄表 (case record form����, CRF) 和電子數(shù)據(jù)采集與管理系統(tǒng) (electronic data capture�����,EDC)�,其余為僅使用 CRF 或 EDC��, Excel 或數(shù)據(jù)庫儲存���,來源于患者病歷但沒有設(shè)計 CRF��,暫未確定或未填�����。結(jié)果見表6���。
表 6 ChiCTR注冊RWS臨床試驗數(shù)據(jù)管理方式
3、討論
本研究通過對 ChiCTR 注冊的 RWS 臨床試驗特征進行分析����,發(fā)現(xiàn)目前 RWS 熱點聚焦在腫瘤治療領(lǐng)域,尤其是針對非小細胞肺癌和乳腺癌的治療���,并且該類研究在實施地點����、樣本量、研究類型和主要測量指標方面均符合 RWS 的特點�����。目前 RWS 與其他研究的區(qū)別在于獲取數(shù)據(jù)的環(huán)境����,而非研究方法和試驗設(shè)計。RWS 數(shù)據(jù)來源于真實醫(yī)療環(huán)境且醫(yī)院間合作項目數(shù)量較多����,樣本量常為千例左右�;RWS 以觀察性研究為主,但干預(yù)性研究的數(shù)量逐年增加����;不同于傳統(tǒng)臨床試驗中因隨訪時間短而無法觀察到終點結(jié)局,RWS 通常強調(diào)以患者為導(dǎo)向的臨床結(jié)局指標�����。同時本研究發(fā)現(xiàn) RWS 在注冊中存在概念不清����、數(shù)據(jù)共享方式混亂��、 注冊內(nèi)容填寫不規(guī)范的問題����。
RWS 在研究目的方面注重在真實環(huán)境下是否有效��,即效果(effectiveness)����,通常處于上市后藥物監(jiān)測或Ⅳ期臨床試驗階段。但本研究中 RWS 注冊項目處于上市后藥物監(jiān)測或Ⅳ期臨床試驗階段的項目僅占 41.59%�����,更有注重效能的Ⅱ����、Ⅲ期臨床試驗出現(xiàn)。將 11 項Ⅱ���、Ⅲ期臨床試驗項目再度核對后發(fā)現(xiàn)其均屬于 RWS���,但因研究類型��、研究設(shè)計的選擇和評價藥物安全性與有效性的目的��,導(dǎo)致研究者無法正確選擇試驗分期��。這反映出研究者將 RWS 與傳統(tǒng)臨床試驗的概念混淆�����,在理解 RWS 的 真實含義方面存在不足��。
數(shù)據(jù)共享是實現(xiàn)臨床試驗透明化的關(guān)鍵點�,更是 RWS 的關(guān)鍵問題之一�����。ChiCTR 和國際醫(yī)學(xué)雜志編輯委員會均要求臨床試驗在注冊時必須包含數(shù)據(jù)共享聲明�����。本研究中僅 379 項(59.03%)研究愿意共享數(shù)據(jù)��,明顯低于 2018 年公布的數(shù)據(jù)結(jié)果�����。不完全理解原始數(shù)據(jù)共享的定義及過程阻礙了注冊者選擇數(shù)據(jù)共享��。ChiCTR 推薦使用 ResMan 并共享試驗數(shù)據(jù)���,但同意數(shù)據(jù)共享的項目中僅 58 項(15.30%)研究使用 ResMan�����,更多的注冊項目填寫了不正確的共享方式�����,如發(fā)表文章和學(xué)術(shù)報告����,利用 Excel 表及標明時間卻沒有具體方式等����。此處,169 項研究在是否共享原始數(shù)據(jù)與共享方式中填入相反的選擇��。缺乏共享數(shù)據(jù)的知情同意����,也缺少防止數(shù)據(jù)用于誤導(dǎo)性的二次分析等都導(dǎo)致研究者最終放棄數(shù)據(jù)共享����。
項目注冊時�,除題目中標明真實世界外,部分項目在研究目的��、藥物成份和治療方案詳述中進行說明��,但更多項目未做任何 RWS 說明����,無法分辨出該注冊項目是否真的屬于 RWS。另外���,臨床試驗注冊項目存在樣本量填 0�����;試驗實施地點為空或不適用����;已明確超過研究實施時間和招募觀察對象時間��,但招募研究對象情況為正在進行或尚未開始等填寫不規(guī)范的情況�����。ChiCTR 注冊指南明確標識完整的數(shù)據(jù)管理系統(tǒng)組成部分后���,注冊結(jié)果僅 15.89% 符合網(wǎng)站要求���,這一數(shù)據(jù)明顯低于全部臨床試驗注冊調(diào)查中的數(shù)據(jù)采集與管理結(jié)果。這都顯示了 RWS 大部分研究者在注冊項目時未仔細閱讀 ChiCTR 注冊指南���。
由于 RWS 可隨訪到臨床結(jié)局指標�����,替代指標的使用已逐漸減少����,而本文使用的 WHO ICTRP 最低注冊條目里包含關(guān)鍵的次要結(jié)果條目�����,因此其并不完全適用于 RWS���,是否要求 RWS 具有次要測量指標還有待商討�����,故 RWS 注冊項目的完整度應(yīng)高于本研究統(tǒng)計結(jié)果����。
綜上所述,基于 ChiCTR 注冊項目提取的信息��,RWS 注冊項目整體完整度較好����,但臨床試驗注冊質(zhì)量仍有待進一步完善。研究者在設(shè)計 RWS 時要清晰認識和理解 RWS 的概念與實質(zhì)��,在研究的相應(yīng)時間截點后及時更新注冊內(nèi)容�����。注冊平臺可針對 RWS 規(guī)定填寫位置或設(shè)計填寫條目���,使 RWS 更加清晰明確���。由于 RWS 的特點為獲取真實醫(yī)療環(huán)境下的數(shù)據(jù)����,在不更改網(wǎng)站現(xiàn)有注冊條目的情況下�����,注冊平臺可規(guī)定注冊者在研究目的條目填寫時標明真實世界數(shù)據(jù)來源�,建議重點增加數(shù)據(jù)獲取環(huán)境(數(shù)據(jù)來源)條目����,填寫如電子檔案,疾病登記表����,健康設(shè)備收集信息等內(nèi)容;將網(wǎng)站提供的注冊指南放在醒目的位置將更有利于注冊者獲取標準的注冊過程促進注冊內(nèi)容的規(guī)范化��,同時建議提供專門的 RWS 注冊指南��。