自2015年藥品審評審批制度改革啟動以來,我國藥品在上市數(shù)量與上市速度上均顯著提升�����,進(jìn)一步助推我國創(chuàng)新藥實現(xiàn)快速發(fā)展����。在第六屆中國藥品監(jiān)管科學(xué)大會上,CDE副主任楊志敏介紹了近年藥品審評總體情況與加快藥品審評工作的相關(guān)舉措����。透過近5年相關(guān)藥審數(shù)據(jù)的變化,可以看到我國藥品在申報審批上呈現(xiàn)出的一些新特點(diǎn)��?�! ?/span>
中藥注冊申請翻倍最多
2018-2022年����,藥品注冊申請受理量與審結(jié)量逐年增加����,且保持了10%以上的高增速�����。其中�����,受理量由2018年的7338件增長到2022年的12368件�����,年均增長13.9%����;審結(jié)量由2018年的7611件增長到2022年的11365件,年均增長10.5%��?�! ?/span>
從藥品類型來看����,中藥增速最快,增加的倍數(shù)最多��。在受理量上����,中藥年均增長39.4%,2022年為2018年的3.8倍����;在審結(jié)量上,中藥年均增長41.1%����,2022年是2018年的4.0倍?���! ?/span>
創(chuàng)新生物制品增速領(lǐng)銜
在審評審批制度改革的助推下,創(chuàng)新藥更是快速步入“收獲期”��。2018-2022年����,我國累計有109個創(chuàng)新藥品種獲批上市����,其中包含12個同類首創(chuàng)新藥(first-in-class)����。創(chuàng)新藥的申報與審批也跑出了不一樣的“加速度”,除了NDA受理量年均增長(2.6%)略微平穩(wěn)��,創(chuàng)新藥其他方面的增速都十分顯著����。具體來看,2018-2022年��,創(chuàng)新藥IND申請受理量與批準(zhǔn)量年均增長分別達(dá)到35.5%與28.5%��;創(chuàng)新藥NDA批準(zhǔn)量年均增長26.4%����。
從藥品類型來看��,生物制品在創(chuàng)新藥中“獨(dú)領(lǐng)風(fēng)騷”��,尤其是在IND的受理量與批準(zhǔn)量增速上遙遙領(lǐng)先�����。2018-2022年�����,創(chuàng)新生物制品IND受理量年均增長55.1%��,2022年為2018年的5.8倍����;創(chuàng)新生物制品IND批準(zhǔn)量年均增長53.4%,2022年為2018年的5.5倍��?���! ?/span>
兒藥/罕見病藥上市提速
此外,備受關(guān)注的兒童用藥����、罕見病藥與臨床急需境外新藥也在各項鼓勵政策的推動下加速上市。兒童藥與罕見病藥在臨床研究等方面存在不少難題��,為構(gòu)建和持續(xù)推進(jìn)技術(shù)評價體系建設(shè)�����,CDE發(fā)布了一系列指導(dǎo)原則。隨著相關(guān)政策的推進(jìn)和完善�����,近年兒童藥與罕見病藥的獲批數(shù)量逐步增加����。
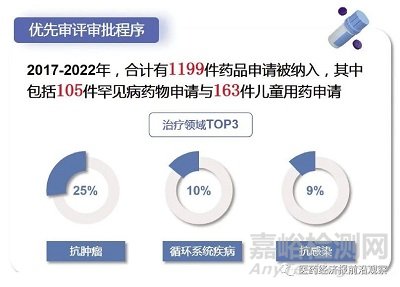
例如�����,兒童用藥批準(zhǔn)由以前的個位數(shù)����,從2019年開始快速增加,2022年獲批品種數(shù)達(dá)到66個�����,比2021年增長40%����。在罕見病藥方面����,《第一批罕見病目錄》的121個病種中��,77種疾病在國內(nèi)已有治療藥物��。罕見病用藥的注冊申請(臨床和上市)受理量��,從2017年的46個����,增加到近兩年的140個左右����。在臨床急需境外新藥方面,已發(fā)布的3批名單共涉及81個品種�����,目前已有54個獲批�����,占總數(shù)的67%�����。
四大加速程序要點(diǎn)解讀
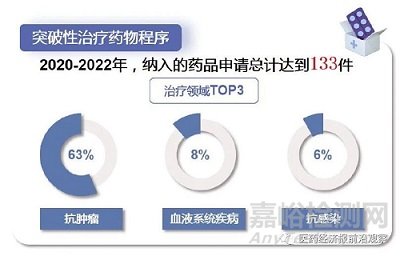
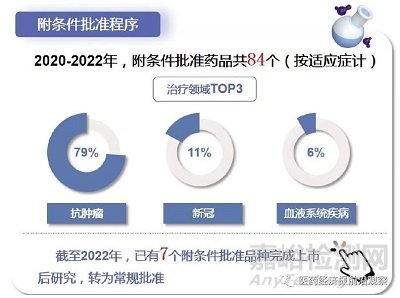
為了使真正的好藥盡早盡快上市��,真正地實施以患者為中心的藥物研發(fā)��,2020年7月1日起實施的新版《藥品注冊管理辦法》提出了四大加快上市注冊程序:突破性治療藥物程序����、附條件批準(zhǔn)程序、優(yōu)先審評審批程序與特別審批程序�����?�! ?/span>
楊志敏強(qiáng)調(diào)����,要保證新藥越快越好地上市,基于全生命周期的風(fēng)險管理變得異常重要��。不僅是藥品的臨床試驗�����、質(zhì)控、工藝��,還要關(guān)注臨床試驗中的風(fēng)險管控及上市后的風(fēng)險管控����,加強(qiáng)創(chuàng)新藥上市后的全生命周期管理工作?���!?/span>
據(jù)其介紹��,特別審批程序主要針對發(fā)生突發(fā)公共衛(wèi)生事件的威脅����,在突發(fā)公共衛(wèi)生事件后應(yīng)急所需防治藥品,如新冠這樣的突發(fā)公共衛(wèi)生事件就屬于特別審批程序��。除此之外�����,絕大多數(shù)患者特別急需的藥品或數(shù)據(jù)具備顯著優(yōu)勢的藥品����,往往適用于其他三種程序��?���! ?/span>
具體來看��,一個藥物的早期數(shù)據(jù)若能顯示出比現(xiàn)有療法具備顯著優(yōu)勢��,就有機(jī)會獲得突破性治療藥物的資格�����,其評價標(biāo)準(zhǔn)關(guān)鍵在于患者的獲益�����。一旦得到該資格����,就能獲得審評資源的傾斜,如溝通交流�����、后續(xù)的優(yōu)先審評等。因此�����,突破性治療藥物程序類似于一個資格認(rèn)證����。
附條件批準(zhǔn)程序的目的在于縮短藥物臨床試驗的研發(fā)時間�����,使其盡早應(yīng)用于無法繼續(xù)等待的危重疾病或公共衛(wèi)生方面急需的患者����。比如采取單臂試驗�����、替代終點(diǎn)等�����,力求在非常早期就看到獲益指標(biāo)�����,其更類似于一種技術(shù)標(biāo)準(zhǔn)。但楊志敏強(qiáng)調(diào)����,不能把附條件批準(zhǔn)當(dāng)成簡化上市的一個標(biāo)準(zhǔn),而是把這種標(biāo)準(zhǔn)轉(zhuǎn)化為提前讓患者有可獲得性的一種以患者為中心的方式��。附條件不是降低標(biāo)準(zhǔn)����,而是更高標(biāo)準(zhǔn)��。
早期被列入突破性治療藥物程序和附條件批準(zhǔn)程序的品種��,后續(xù)就可以列入優(yōu)先審評審批程序�����,這才是真正縮短時限的一個審評程序��,類似程序VIP。在審評時間不斷縮短的情況下�����,優(yōu)先審評的時間仍顯著低于普通品種。以2022年為例�����,普通品種與優(yōu)先審評審批品種的審評用時分別為234日與144日����。
(數(shù)據(jù)來源:CDE�����;制圖:連瑩瑩)
在藥品審評審批制度改革的催化下����,我國創(chuàng)新藥行業(yè)實現(xiàn)了高速增長。隨著改革持續(xù)深化�����,藥品審評標(biāo)準(zhǔn)體系建設(shè)進(jìn)一步完善��,醫(yī)藥行業(yè)的高質(zhì)量發(fā)展將得到更大助力����。