摘要
目的 :梳理我國(guó)藥品進(jìn)口備案法規(guī)體系及相關(guān)管理�,研究我國(guó)現(xiàn)行藥品進(jìn)口備案制度及存在的問(wèn)題,為今后政策制定和優(yōu)化提供文獻(xiàn)參考����。
方法 :運(yùn)用文獻(xiàn)研究和統(tǒng)計(jì)分析等方法,對(duì)現(xiàn)有藥品進(jìn)口備案管理制度進(jìn)行深入研究�,梳理藥品進(jìn)口備案中不同進(jìn)口情形的法規(guī)文件及管理要求,找出存在的突出問(wèn)題及爭(zhēng)議點(diǎn)���。
結(jié)果與結(jié)論 :當(dāng)前藥品進(jìn)口備案工作中存在法規(guī)制度略顯滯后����、覆蓋面相對(duì)較窄、種類繁雜����、部分規(guī)定尚不夠明確具體,首次進(jìn)口品種的認(rèn)定���、準(zhǔn)許證進(jìn)口且無(wú)需口岸檢驗(yàn)的藥品是否需要備案存在爭(zhēng)議���,證件核驗(yàn)程序滯后����、信息共享渠道不暢等問(wèn)題。以上問(wèn)題使得行政主體和相對(duì)人很難全面了解和正確把握相關(guān)法規(guī)制度����,各口岸執(zhí)行標(biāo)準(zhǔn)不統(tǒng)一,易影響進(jìn)口藥品市場(chǎng)供應(yīng)����,不利于建立統(tǒng)一、規(guī)范���、高效的進(jìn)口備案監(jiān)管體系和營(yíng)造良好的營(yíng)商環(huán)境���。針對(duì)存在的突出問(wèn)題及爭(zhēng)議點(diǎn)���,提出完善規(guī)章制度、加強(qiáng)進(jìn)口備案信息化建設(shè)等針對(duì)性建議�。完善藥品進(jìn)口備案制度,能夠提高藥品進(jìn)口備案工作的質(zhì)量和效率����,更好地為行政決策提供信息支撐、為政府服務(wù)提供信息指引���、為事后監(jiān)管提供管理線索�。
背景
從行政主體角度而言����,藥品進(jìn)口備案是口岸藥品監(jiān)管部門按程序向藥品進(jìn)口單位發(fā)放《進(jìn)口藥品通關(guān)單》[1] 和通知口岸藥品檢驗(yàn)機(jī)構(gòu)對(duì)進(jìn)口藥品進(jìn)行抽查檢驗(yàn)的過(guò)程 [2]。海關(guān)憑藥品監(jiān)管部門出具的《進(jìn)口藥品通關(guān)單》辦理通關(guān)手續(xù)����。無(wú)《進(jìn)口藥品通關(guān)單》的,海關(guān)不得放行 [2]�。因此,藥品進(jìn)口備案工作關(guān)系到國(guó)民能否用上正規(guī)的進(jìn)口藥品。而未經(jīng)備案�,相對(duì)人就不能從事藥品進(jìn)口活動(dòng),可見(jiàn)進(jìn)口備案直接影響相對(duì)人的權(quán)利義務(wù) [3]�。從法律意義上看,進(jìn)口備案兼具行政許可的特性���。此外���,收集和管理進(jìn)口藥品信息可為行政決策提供信息支撐、為政府服務(wù)提供信息指引���、為事后監(jiān)管提供信息線索 [3]���。因此���,藥品進(jìn)口備案具有十分重要的意義���。
本文對(duì)藥品進(jìn)口備案法規(guī)體系(包括相關(guān)的法律、法規(guī)���、規(guī)章����、規(guī)范性文件等)進(jìn)行研究,對(duì)不同進(jìn)口情況進(jìn)行梳理�,同時(shí)對(duì)藥品進(jìn)口備案工作中存在的突出問(wèn)題進(jìn)行分析并為此提出針對(duì)性建議。期望給進(jìn)口單位提供業(yè)務(wù)幫助����,并為進(jìn)一步提高我國(guó)藥品進(jìn)口備案工作的質(zhì)量和效率提供參考。
一����、藥品進(jìn)口備案法規(guī)體系及管理
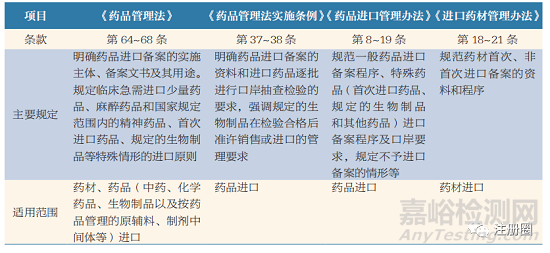
規(guī)定藥品進(jìn)口備案工作涉及的法規(guī)文件主要包括《藥品管理法》[2]、《藥品管理法實(shí)施條例》[4]���、《藥品進(jìn)口管理辦法》[1]�、《進(jìn)口藥材管理辦法》[5] 等���。前兩部法律法規(guī)規(guī)范了藥品進(jìn)口備案工作的基本原則和形式���。后兩部國(guó)家藥品監(jiān)管部門的規(guī)章是開(kāi)展進(jìn)口備案工作的主要依據(jù)。經(jīng)提煉�,具體內(nèi)容見(jiàn)表 1。
▲ 表1-法律���、法規(guī)���、規(guī)章對(duì)藥品進(jìn)口備案的管理規(guī)定
除以上法律法規(guī)�、部門規(guī)章外���,為保證藥品進(jìn)口備案工作的質(zhì)量和效率�,國(guó)家藥品監(jiān)管部門制定了《藥品進(jìn)口備案工作指南》[6]�,進(jìn)一步細(xì)化了備案受理的基本原則、備案工作的基本程序���、申請(qǐng)表的審查規(guī)范����、備案審查要點(diǎn)及注意事項(xiàng)等����。此外���,為應(yīng)對(duì)進(jìn)口藥品備案工作中的現(xiàn)實(shí)問(wèn)題�,國(guó)家藥品監(jiān)管部門陸續(xù)出臺(tái)一系列通知�、公告以及政策解讀等規(guī)范性文件,共同組成了藥品進(jìn)口備案的法規(guī)體系。在日常工作中�,從備案程序及藥品屬性可分為藥材、藥品���、非藥用物品進(jìn)口備案���。
1.1 藥材進(jìn)口備案
除前文提到的《進(jìn)口藥材管理辦法》外,藥材進(jìn)口備案還主要依據(jù)《國(guó)家藥監(jiān)局 海關(guān)總署 市場(chǎng)監(jiān)管總局關(guān)于實(shí)施〈進(jìn)口藥材管理辦法〉有關(guān)事項(xiàng)的公告》[7]�。該公告中公布了《非首次進(jìn)口藥材品種目錄》,凡申請(qǐng)進(jìn)口列入目錄中的藥材品種���,申請(qǐng)人無(wú)須取得《進(jìn)口藥材批件》�,直接按非首次進(jìn)口藥材備案���。
1.2 藥品進(jìn)口備案
藥品進(jìn)口的備案范圍不僅包括中藥�、化學(xué)藥品����、生物制品,還包括化學(xué)原料藥�、輔料和制劑中間體的進(jìn)口。這類進(jìn)口占比較大�,規(guī)定較細(xì)�,按具體用途可細(xì)分為上市藥品進(jìn)口備案和注冊(cè)用樣品進(jìn)口備案����。
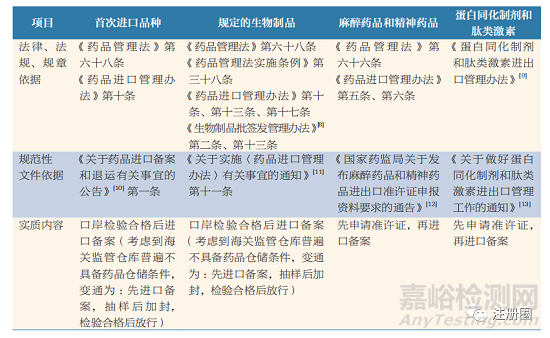
除常規(guī)藥品外,上市藥品進(jìn)口備案還涉及特殊情形����,包含首次在中國(guó)境內(nèi)銷售的藥品(以下簡(jiǎn)稱首次進(jìn)口品種)、規(guī)定的生物制品���、麻醉藥品和精神藥品�、蛋白同化制劑和肽類激素���,相應(yīng)的法律����、法規(guī)����、規(guī)章及規(guī)范性文件對(duì)上述特殊進(jìn)口情形做了具體要求,相關(guān)法規(guī)梳理見(jiàn)表 2���。
▲ 表2-上市藥品進(jìn)口備案中特殊情形的制度梳理
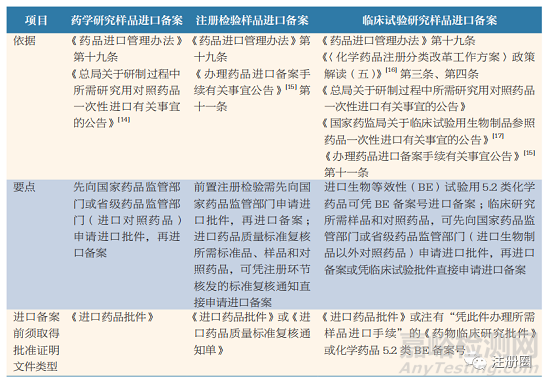
注冊(cè)用樣品進(jìn)口備案包括藥學(xué)研究����、注冊(cè)檢驗(yàn)����、臨床試驗(yàn)研究三類不同研究類型的備案,在進(jìn)口前需取得相應(yīng)的批準(zhǔn)證明性文件方可進(jìn)口�。按照《藥品進(jìn)口管理辦法》的規(guī)定,這類進(jìn)口須經(jīng)國(guó)家藥品監(jiān)管部門批準(zhǔn)����,憑《進(jìn)口藥品批件》辦理進(jìn)口備案 [1]。為與進(jìn)口藥品注冊(cè)制度銜接���,國(guó)家藥品監(jiān)管部門陸續(xù)發(fā)布了相應(yīng)的通知����、公告等規(guī)范性文件以簡(jiǎn)化注冊(cè)用樣品進(jìn)口程序���,具體制度文件梳理見(jiàn)表 3����。
▲ 表 3-注冊(cè)用樣品進(jìn)口備案的制度文件梳理
1.3 非藥用物品進(jìn)口備案
根據(jù)《藥品進(jìn)口管理辦法》的規(guī)定���,列入《進(jìn)口藥品目錄》的物品必須辦理《進(jìn)口藥品通關(guān)單》���。由于該目錄是按照商品稅則的分類和編制方式制定的�,致使有些非藥用物品(食用原����、輔料和藥品合成前體)也按照藥品管理。因此該類物品進(jìn)口時(shí)�,需要進(jìn)口備案并取得《進(jìn)口藥品通關(guān)單》[18]。非藥用物品的進(jìn)口實(shí)行目錄管理和審批管理���,目錄內(nèi)物品可以直接按程序辦理進(jìn)口備案����,目錄外物品需先取得國(guó)家藥品監(jiān)管部門的批準(zhǔn)文件�,再辦理進(jìn)口備案。今����,國(guó)家藥品監(jiān)管部門先后共發(fā)布三批非藥用物品目錄 [18-20]。
二�、藥品進(jìn)口備案工作尚存在的問(wèn)題與爭(zhēng)議
2.1 法規(guī)體系建設(shè)方面的問(wèn)題
2.1.1 法規(guī)制度略顯滯后
藥品進(jìn)口備案工作中具有指導(dǎo)意義的《藥品進(jìn)口管理辦法》《藥品進(jìn)口備案工作指南》是 2003 年由原國(guó)家食品藥品監(jiān)督管理局制定的,并于 2004 年 1 月 1 日起實(shí)施至今�,僅在 2012 年���,將《藥品進(jìn)口管理辦法》第十七條和第二十五條中“其他不符合我國(guó)藥品管理有關(guān)規(guī)定的”和“其他不符合國(guó)家藥品監(jiān)督管理法律����、法規(guī)和規(guī)章規(guī)定的”修正為“藥品監(jiān)督管理部門有其他證據(jù)證明進(jìn)口藥品可能危害人體健康的”。期間近 20 年����,并未做出實(shí)質(zhì)性修訂。但是�,近年來(lái)不論是醫(yī)藥產(chǎn)業(yè)的發(fā)展,還是藥品監(jiān)管理念和監(jiān)管方式方法都發(fā)生了很大的變化�,這部法規(guī)的內(nèi)容相對(duì)滯后,不能適應(yīng)時(shí)代的發(fā)展需要���。為彌補(bǔ)法規(guī)的缺陷以順應(yīng)時(shí)代����,國(guó)家藥品監(jiān)管部門陸續(xù)發(fā)布一系列公告和通知����,有些公告、通知要求與實(shí)際執(zhí)行并不完全一致���。隨著藥品注冊(cè)審批制度的改革���,相關(guān)注冊(cè)文書的類型及內(nèi)容發(fā)生了很大變化����,但涉及進(jìn)口備案的法規(guī)并未隨之修改�。如在臨床試驗(yàn)樣品進(jìn)口備案中,《辦理藥品進(jìn)口備案手續(xù)有關(guān)事宜公告》明確規(guī)定�,申請(qǐng)人持注有“憑此件辦理所需樣品進(jìn)口手續(xù)”的《藥物臨床研究批件》辦理進(jìn)口備案手續(xù)。而如今批件已變更了多個(gè)版本����,名稱先后為《藥物臨床試驗(yàn)批件》《藥物臨床試驗(yàn)通知書》《藥物臨床試驗(yàn)批準(zhǔn)通知書》等,“憑此件辦理所需樣品進(jìn)口手續(xù)”的文字備注后來(lái)也予取消�。
2.1.2 法規(guī)制度覆蓋面相對(duì)較窄
現(xiàn)有法規(guī)制度對(duì)藥品進(jìn)口的實(shí)際情況并未完全涵蓋,對(duì)注冊(cè)用樣品進(jìn)口備案沒(méi)有做單獨(dú)細(xì)致的規(guī)定����,各口岸藥品監(jiān)管部門也只能參照《藥品進(jìn)口管理辦法》及《藥品進(jìn)口備案工作指南》執(zhí)行。對(duì)參照標(biāo)準(zhǔn)中有些政策理解不同����,如藥品剩余有效期必須大于 12 個(gè)月的適用性,各口岸執(zhí)行尺度不統(tǒng)一。臨床試驗(yàn)研究中經(jīng)常會(huì)用到聯(lián)合用藥�、病例篩選用藥、背景用藥����、訓(xùn)練指導(dǎo)用藥、急救用藥���、安慰劑等,但對(duì)此類藥品進(jìn)口備案法規(guī)依據(jù)���、具體申報(bào)程序及要求并沒(méi)有做詳細(xì)規(guī)定�。用于申請(qǐng)進(jìn)口藥材批件的注冊(cè)檢驗(yàn)����、基原鑒定的藥材如何入境,同樣在《進(jìn)口藥材管理辦法》中并沒(méi)有涉及����,通過(guò)隨身行李攜帶等方式入境,也面臨藥品是否合法入境的爭(zhēng)議���。
2.1.3 法規(guī)制度種類繁雜�,部分規(guī)定尚不夠明確具
體據(jù)筆者統(tǒng)計(jì),各類藥品進(jìn)口備案相關(guān)的法律����、法規(guī)、規(guī)章����、規(guī)范性文件近 40 項(xiàng)之多,有些規(guī)定重復(fù)����,有些規(guī)定尚不夠明確。如化學(xué)藥品5.2 類 BE 試驗(yàn)備案樣品和對(duì)照品的進(jìn)口備案規(guī)定在《〈化學(xué)藥品注冊(cè)分類改革工作方案〉政策解讀(五)》中����,規(guī)定可以憑備案號(hào)辦理進(jìn)口備案,但具體備案程序���、備案資料的要求并未提及���。眾多種類繁雜、內(nèi)容不明確的規(guī)定使得行政主體和相對(duì)人很難全面了解和正確把握���,不易提高進(jìn)口備案工作的質(zhì)量����。
2.2 進(jìn)口備案工作中的爭(zhēng)議點(diǎn)
2.2.1 首次進(jìn)口品種的認(rèn)定存在爭(zhēng)議
《國(guó)家藥品監(jiān)督管理局關(guān)于進(jìn)口化學(xué)藥品通關(guān)檢驗(yàn)有關(guān)事項(xiàng)的公告》[21] 規(guī)定,取消進(jìn)口化學(xué)藥品的口岸檢驗(yàn)�,但首次進(jìn)口品種情形除外,辦理該情形通關(guān)備案時(shí)�,仍需口岸所在地藥品監(jiān)管部門通知口岸藥品檢驗(yàn)所抽查檢驗(yàn)。但對(duì)首次進(jìn)口品種相關(guān)法規(guī)沒(méi)有給出明確的認(rèn)定標(biāo)準(zhǔn)����,各口岸執(zhí)行尺度也不統(tǒng)一。目前大致有 3 種觀點(diǎn)����,一是所進(jìn)口藥品符合《已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》[22] 中藥學(xué)變更的情形����,認(rèn)定為首次進(jìn)口品種。二是所進(jìn)口藥品只有涉及《已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》中重大變更的�,按首次進(jìn)口品種辦理。三是不考慮所進(jìn)口藥品的藥學(xué)變更情況�,僅依據(jù)申請(qǐng)單位是否能提供該藥品之前的進(jìn)口記錄來(lái)做判定。各口岸執(zhí)行標(biāo)準(zhǔn)的不一致�,同一藥品從不同口岸進(jìn)口時(shí),是否被要求強(qiáng)制檢驗(yàn)����,有截然不同的結(jié)果����。而口岸檢驗(yàn)需要數(shù)周時(shí)間����,期間藥品不得銷售,會(huì)影響藥品持續(xù)供應(yīng)���。
2.2.2 準(zhǔn)許證進(jìn)口且無(wú)需口岸檢驗(yàn)的藥品是否需要備案存在爭(zhēng)議
按照《蛋白同化制劑和肽類激素進(jìn)出口管理辦法》規(guī)定���,進(jìn)口科研教學(xué)用途的蛋白同化制劑和肽類激素,無(wú)需口岸檢驗(yàn)����,無(wú)需辦理《進(jìn)口藥品通關(guān)單》,申報(bào)單位可憑準(zhǔn)許證向海關(guān)申請(qǐng)報(bào)關(guān)���,進(jìn)口備案不再具有進(jìn)口程序上的強(qiáng)制性���,同時(shí)也無(wú)相關(guān)法規(guī)提及這類備案的備案憑證。在《國(guó)家藥品監(jiān)督管理局關(guān)于進(jìn)口化學(xué)藥品通關(guān)檢驗(yàn)有關(guān)事項(xiàng)的公告》發(fā)布后���,非首次進(jìn)口麻醉藥品�、精神藥品的進(jìn)口備案也面臨同樣的問(wèn)題。很多口岸認(rèn)為申請(qǐng)進(jìn)口準(zhǔn)許證便是進(jìn)口備案���,因此取消對(duì)該類藥品備案���。然而,進(jìn)口準(zhǔn)許證審批與進(jìn)口備案所采集信息的口徑和內(nèi)容完全不同�,造成對(duì)這類本該加強(qiáng)管制的特殊情形藥品的進(jìn)口底數(shù)不清,對(duì)事后監(jiān)管不利����。
2.3 證件核驗(yàn)程序滯后
2020 年1月1日起,藥品進(jìn)口備案正式實(shí)行“單一窗口”系統(tǒng)網(wǎng)上申請(qǐng)����。備案通過(guò)后���,申請(qǐng)單位仍需到現(xiàn)場(chǎng)領(lǐng)取紙質(zhì)《進(jìn)口藥品通關(guān)單》����,攜帶《進(jìn)口藥品注冊(cè)證》等批準(zhǔn)證明文件原件進(jìn)行現(xiàn)場(chǎng)核驗(yàn)�,未能從真正意義上實(shí)現(xiàn)全程網(wǎng)上辦理����。按照《藥品進(jìn)口備案工作指南》的要求�,《進(jìn)口藥品注冊(cè)證》應(yīng)每次查驗(yàn),為減少經(jīng)營(yíng)環(huán)節(jié)的運(yùn)輸成本���,一種藥品通常需要在全國(guó)多個(gè)口岸進(jìn)口����,申報(bào)單位往往需要持注冊(cè)證原件在全國(guó)各地奔波���。這樣網(wǎng)上辦理快捷便利的優(yōu)勢(shì)不能完全體現(xiàn)����,不利于國(guó)內(nèi)營(yíng)商環(huán)境�。
2.4 信息共享渠道不暢
藥品進(jìn)口備案與藥品注冊(cè)聯(lián)系緊密,全面掌握藥品的注冊(cè)信息����,有助于更好地開(kāi)展進(jìn)口備案工作?���?诎侗O(jiān)管人員獲取藥品注冊(cè)信息的渠道往往局限于申報(bào)單位提交的藥品批準(zhǔn)證明文件���,而藥品的注冊(cè)信息是以補(bǔ)充申請(qǐng)的形式在不斷更新的,所進(jìn)口的藥品是否符合最新的注冊(cè)要求���,沒(méi)有暢通的信息共享渠道做支撐���,很難做出精準(zhǔn)判斷。原輔料登記號(hào)�、檢驗(yàn)通知單、臨床試驗(yàn)通知書���、BE 備案號(hào)等文件不同程度地缺少生產(chǎn)廠商����、質(zhì)量標(biāo)準(zhǔn)等進(jìn)口備案所需的關(guān)鍵信息�。由于從法定申報(bào)資料中所能獲取注冊(cè)信息量有限,又無(wú)其他獲取注冊(cè)信息便捷渠道���,易引起備案信息偏差���,藥品進(jìn)口備案的工作質(zhì)量和工作效率很難提高����。
三、討論建議
3.1 完善藥品進(jìn)口備案的法規(guī)制度
藥品進(jìn)口備案的法規(guī)�,是有效保障合規(guī)藥品入境的先決條件和基礎(chǔ)。建議以《藥品管理法》為支撐���,在把握基本原則的基礎(chǔ)上設(shè)立合理的監(jiān)管制度�,合理規(guī)劃具體的操作規(guī)則����。注意法規(guī)體系的縱向連貫,重點(diǎn)完善修訂《藥品進(jìn)口管理辦法》《進(jìn)口藥材管理辦法》����,整合陸續(xù)出臺(tái)的以彌補(bǔ)這兩個(gè)辦法不足的一系列通知、公告���,吸收實(shí)踐中好的經(jīng)驗(yàn)做法����,及時(shí)廢除過(guò)時(shí)�、內(nèi)容重復(fù)、與兩個(gè)辦法矛盾的文件�,同時(shí)與藥品注冊(cè)改革中相關(guān)的法規(guī)制度相銜接�,進(jìn)一步修訂《藥品進(jìn)口備案工作指南》����。在完善原有法規(guī)的同時(shí),整合一系列繁雜����、不明確的通知和公告,針對(duì)注冊(cè)用樣品進(jìn)口管理���,出臺(tái)專門的規(guī)章制度�。同時(shí)���,在完善法規(guī)的過(guò)程中���,要暢通大眾的信息來(lái)源和表達(dá)渠道,做到公開(kāi)透明�。
3.2 加強(qiáng)指導(dǎo),消除備案中的問(wèn)題與爭(zhēng)議
建議加強(qiáng)對(duì)口岸藥品監(jiān)管部門的監(jiān)督和指導(dǎo)�,推出口岸藥品監(jiān)管部門的年度報(bào)告制度,及時(shí)了解各口岸的工作情況和問(wèn)題����,掌握進(jìn)口藥品監(jiān)管部門和檢驗(yàn)機(jī)構(gòu)年度工作情況,了解各口岸藥品監(jiān)管部門存在的問(wèn)題���,聽(tīng)取對(duì)藥品進(jìn)口管理的意見(jiàn)建議���,督促各口岸藥品監(jiān)管部門更好地履職盡責(zé)。同時(shí)建立日常問(wèn)題收集和反饋機(jī)制���,及時(shí)消除進(jìn)口備案中的問(wèn)題及爭(zhēng)議�。明確首次進(jìn)口品種認(rèn)定的標(biāo)準(zhǔn)�,在藥品發(fā)生產(chǎn)地、處方�、工藝等重大變更時(shí),仍需按首次進(jìn)口程序開(kāi)展法定檢驗(yàn)���,嚴(yán)把質(zhì)量關(guān)�。對(duì)研究用蛋白同化制劑和肽類激素及非首次進(jìn)口麻醉藥品���、精神藥品這類進(jìn)口備案沒(méi)有程序約束的特殊情形�,通過(guò)完善相應(yīng)法規(guī)����,建立強(qiáng)制進(jìn)口備案制度���,規(guī)范備案憑證等方式加強(qiáng)監(jiān)管。
3.3 推行電子證照�,建立信息共享平臺(tái)
建議推出《進(jìn)口藥品注冊(cè)證》《進(jìn)口藥品通關(guān)單》等進(jìn)口備案工作相關(guān)的電子證照,為進(jìn)口藥品上市許可持有人發(fā)放與注冊(cè)證一一對(duì)應(yīng)的密鑰設(shè)備����,在進(jìn)口備案審核系統(tǒng)(中國(guó)國(guó)際貿(mào)易單一窗口)中,通過(guò)計(jì)算機(jī)技術(shù)對(duì)密鑰的識(shí)別����,實(shí)現(xiàn)注冊(cè)證的遠(yuǎn)程核驗(yàn),既符合現(xiàn)有法規(guī)對(duì)注冊(cè)證核驗(yàn)的規(guī)定���,又可以讓信息流動(dòng)代替人工跑動(dòng)�,實(shí)現(xiàn)真正意義的全程網(wǎng)上辦理����,進(jìn)一步優(yōu)化營(yíng)商環(huán)境。加快建立注冊(cè)信息共享平臺(tái)���,該平臺(tái)與進(jìn)口備案系統(tǒng)互聯(lián)����,通過(guò)開(kāi)發(fā)信息自動(dòng)核查功能,實(shí)現(xiàn)進(jìn)口藥品報(bào)驗(yàn)單內(nèi)容與注冊(cè)信息自動(dòng)比對(duì)����,有爭(zhēng)議時(shí)�,口岸藥品監(jiān)管部門可通過(guò)賬號(hào)登錄平臺(tái)查詢所需進(jìn)口藥品的注冊(cè)信息,對(duì)電子審單結(jié)果進(jìn)行必要的人工干預(yù)�,從而降低單純?nèi)斯弳蔚牟铄e(cuò)率,提高效率����,監(jiān)管人員把注意力重點(diǎn)集中在具體申報(bào)材料和產(chǎn)品本身的查驗(yàn)上,有效提高進(jìn)口備案工作的質(zhì)量和效率����。