據(jù)《醫(yī)療器械監(jiān)督管理條例》規(guī)定,第Ⅱ���、Ⅲ類醫(yī)療器械采用產(chǎn)品注冊管理方式����。
境內(nèi)第二類醫(yī)療器械由省、自治區(qū)���、直轄市藥監(jiān)局審查���,批準后發(fā)給醫(yī)療器械注冊證。
境內(nèi)第三類醫(yī)療器械由國家藥監(jiān)局審查�,批準后發(fā)給醫(yī)療器械注冊證。
進口第二類����、第三類醫(yī)療器械由國家藥監(jiān)局審查,批準后發(fā)給醫(yī)療器械注冊證���。香港�、澳門���、臺灣地區(qū)醫(yī)療器械的注冊�、備案����,參照進口醫(yī)療器械辦理����。
2023年3月注冊備案信息匯總統(tǒng)計:
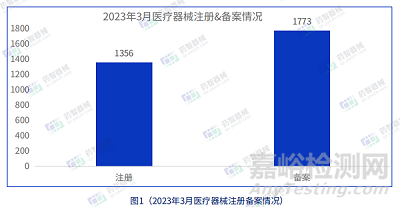
3月注冊批準醫(yī)療器械數(shù)量1356項
3月備案批準醫(yī)療器械數(shù)量1773項
3月優(yōu)先審批注冊醫(yī)療器械產(chǎn)品4項
3月創(chuàng)新審批注冊醫(yī)療器械產(chǎn)品13項
據(jù)統(tǒng)計�,2023年3月NMPA共批準注冊醫(yī)療器械1356項,同比增加77.9%���,其中優(yōu)先審批注冊4項�,創(chuàng)新審批注冊13項����;審批備案醫(yī)療器械數(shù)量1773項,同比增加44.6%�;2023年3月醫(yī)療器械注冊&備案情況詳見圖1。
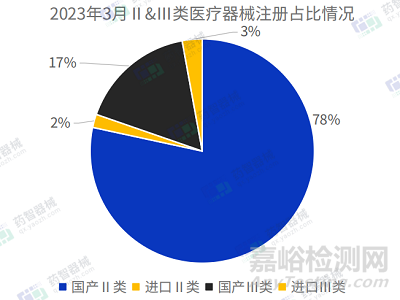
2023年3月�,國家藥監(jiān)局共批準注冊醫(yī)療器械產(chǎn)品1356項����。其中,國產(chǎn)第Ⅱ類醫(yī)療器械產(chǎn)品1063項����,國產(chǎn)第Ⅲ類醫(yī)療器械產(chǎn)品228項,進口第Ⅱ類醫(yī)療器械產(chǎn)品26項,進口第Ⅲ類醫(yī)療器械產(chǎn)品39項���,國產(chǎn)占比95.2%���。
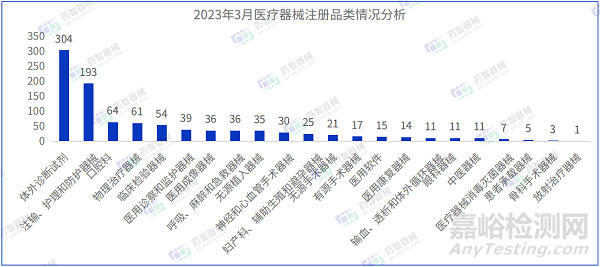
從產(chǎn)品類別來看,2023年3月中注冊醫(yī)療器械中�,體外診斷試劑(304件),注輸����、護理和防護器械(193件)、及口腔科器械(64件)注冊數(shù)量排名前三���。3月體外診斷試劑產(chǎn)品注冊數(shù)較2月增多���,超過了注輸、護理和防護器械注冊數(shù)量����。
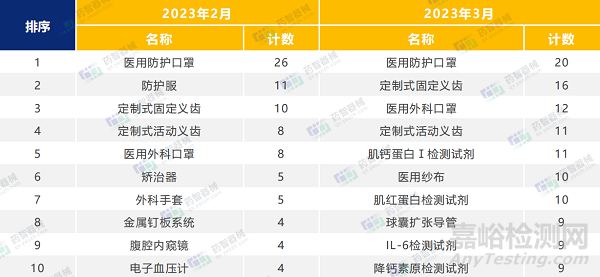
2023年2月-3月,醫(yī)用口罩等最重要的防護類醫(yī)療器械依舊是占據(jù)了醫(yī)療器械注冊產(chǎn)品數(shù)量排名第一的位置���。此外���,3月口腔科器械和體外診斷試劑注冊數(shù)量較前兩月明顯增加���。
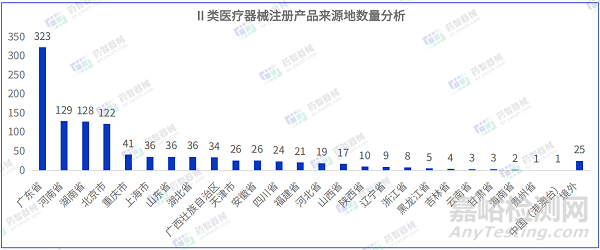
從Ⅱ類醫(yī)療器械注冊產(chǎn)品來源地分布來看,國內(nèi)3月共有25個省市(包括中國港澳臺)注冊Ⅱ類醫(yī)療器械����,其中廣東省注冊醫(yī)療器械數(shù)量最多,占全部Ⅱ類醫(yī)療器械數(shù)量的29.6%���。
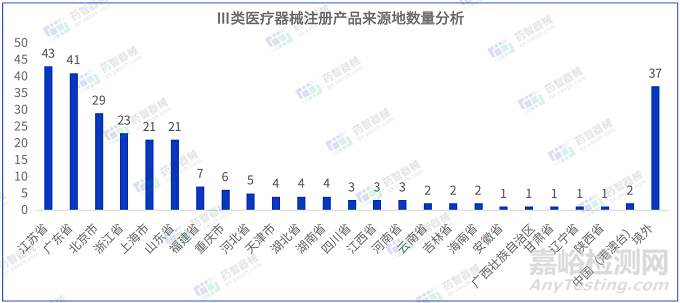
從Ⅲ類醫(yī)療器械注冊產(chǎn)品來源地分布來看���,國內(nèi)3月共有124省市(包括中國港澳臺)注冊Ⅲ類醫(yī)療器械,其中江蘇省注冊醫(yī)療器械數(shù)量最多����,占全部Ⅲ類醫(yī)療器械數(shù)量的16.1%。
據(jù)《醫(yī)療器械監(jiān)督管理條例》規(guī)定����,第一類醫(yī)療器械采用產(chǎn)品備案管理方式�。
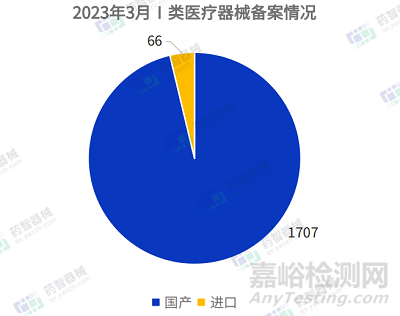
2023年3月國產(chǎn)Ⅰ類醫(yī)療器械備案批準數(shù)量1707項,同比增加46.3%���。同時�,進口第一類醫(yī)療器械備案批準數(shù)量66項,同比增加10.0%���。
3月醫(yī)療器械創(chuàng)新及優(yōu)先審批
根據(jù)《創(chuàng)新醫(yī)療器械特別審批程序(試行)》���,我國醫(yī)療器械創(chuàng)新審批是為了保障醫(yī)療器械的安全、有效����,鼓勵醫(yī)療器械的研究與創(chuàng)新,促進醫(yī)療器械新技術的推廣和應用���,推動醫(yī)療器械產(chǎn)業(yè)發(fā)展的特殊審批通道�。
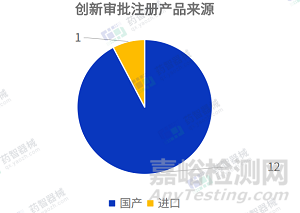
2023年3月�,全國創(chuàng)新審批注冊產(chǎn)品共計13項,其中����,國產(chǎn)創(chuàng)新醫(yī)療器械產(chǎn)品12項,進口創(chuàng)新醫(yī)療器械產(chǎn)品1項�。
從產(chǎn)品類別來看:13項均為器械產(chǎn)品,無試劑產(chǎn)品���。
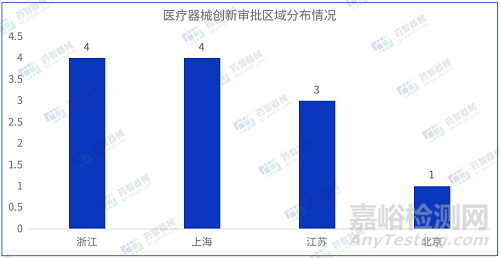
2023年3月共有四個省市注冊創(chuàng)新審批醫(yī)療器械���,其中浙江省和上海市注冊數(shù)量排名并列第一�。
2016年10月25日�,國家藥監(jiān)局發(fā)布《醫(yī)療器械優(yōu)先審批程序》,于2017年1月1日起施行。根據(jù)《醫(yī)療器械優(yōu)先審批程序》,對下列醫(yī)療器械實施優(yōu)先審批:
一是診斷或治療罕見病�、惡性腫瘤且具有明顯臨床優(yōu)勢的醫(yī)療器械,診斷或治療老年人特有和多發(fā)疾病且尚無有效診斷或治療手段的醫(yī)療器械�,專用于兒童且具有明顯臨床優(yōu)勢的醫(yī)療器械;
二是列入國家科技重大專項或國家重點研發(fā)計劃的醫(yī)療器械�。
此外,將根據(jù)各方面情況和意見���,組織專家審查后�,確定對“其他應當優(yōu)先審批的醫(yī)療器械”予以優(yōu)先審批����。
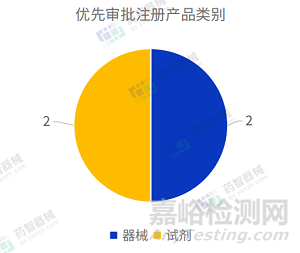
2023年3月,全國優(yōu)先審批注冊產(chǎn)品共計4項����,均為國產(chǎn)醫(yī)療器械產(chǎn)品。從產(chǎn)品類別來看:器械產(chǎn)品2項���,試劑產(chǎn)品2項����。
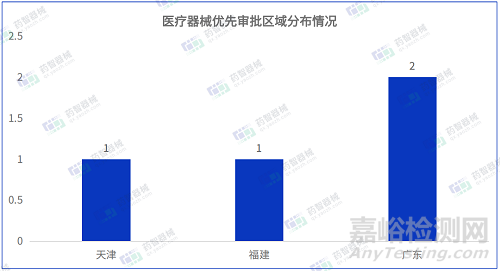
2023年3月共有三個省市注冊醫(yī)療器械進入優(yōu)先審批����,其中廣東省注冊數(shù)量最多排名第一。
3月醫(yī)療器械注冊企業(yè)分析
2023年3月國內(nèi)注冊醫(yī)療器械企業(yè)達718家����。排行前十的企業(yè)中,排名前三的分別是:北京貝爾生物工程股份有限公司����、深圳市錦瑞生物科技股份有限公司、深圳市國賽生物技術有限公司����,其中北京貝爾生物工程股份有限公司的注冊數(shù)量排名第一,排行前十的企業(yè)情況如下圖所示���。
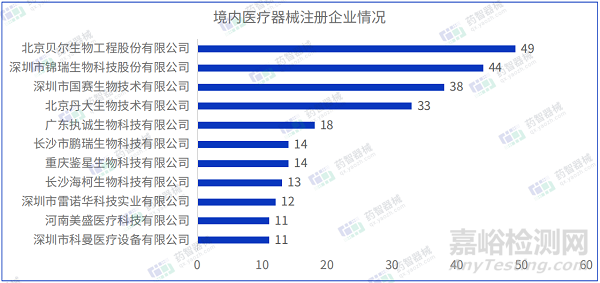
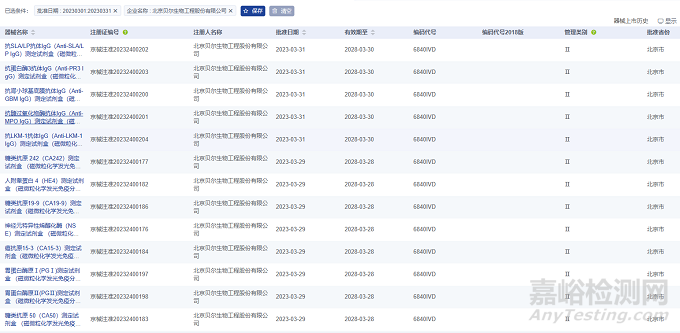
2023年3月����,北京貝爾生物工程股份有限公司在北京市藥監(jiān)局完成了49項醫(yī)療器械,注冊產(chǎn)品數(shù)量排名第一����,均為Ⅱ類IVD診斷試劑產(chǎn)品。
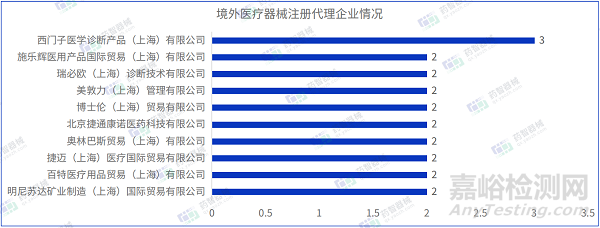
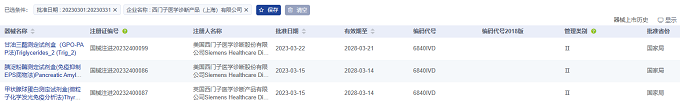
從進口醫(yī)療器械代理人企業(yè)情況看����,2023年3月進口醫(yī)療器械注冊代理人企業(yè)達54家。排行前十的企業(yè)中�,排名前三的分別是:西門子醫(yī)學診斷產(chǎn)品(上海)有限公司、施樂輝醫(yī)用產(chǎn)品國際貿(mào)易(上海)有限公司�、瑞必歐(上海)診斷技術有限公司,其中西門子醫(yī)學診斷產(chǎn)品(上海)有限公司的注冊數(shù)量排名第一����,排行前十的企業(yè)情況如下圖所示。
西門子醫(yī)學診斷產(chǎn)品(上海)有限公司代理三項進口醫(yī)療器械����,均為Ⅱ類體外診斷試劑產(chǎn)品。