一�、簡介
新冠肺炎NMR聯(lián)合會是一個由NMR專家組成的國際合作組織�。目前�,該組織正在積極開展研究,通過利用NMR波譜來確定SARS-CoV-2及其蛋白質(zhì)的核糖核酸(RNA)結(jié)構(gòu)��。在疫情初期��,聯(lián)合會的首批成果之一是發(fā)現(xiàn)SARS-CoV-2中的一種蛋白質(zhì)會與病毒RNA形成微滴����。在隨后的幾個月里,這一發(fā)現(xiàn)使科學(xué)家能夠創(chuàng)建實驗來研究RNA與蛋白質(zhì)(稱為核衣殼蛋白或N蛋白)之間的相互作用��。
二����、新冠肺炎NMR聯(lián)合會簡介
新冠肺炎NMR聯(lián)合會由Harald Schwalbe教授于2020年3月在德國法蘭克福的歌德大學(xué)發(fā)起,并迅速發(fā)展成為一個國際性的合作組織��。今天��,來自世界各地的科學(xué)家正基于開放的科學(xué)原則進(jìn)行合作����,以獨特的方式利用NMR波譜對SARS-CoV-2展開研究。由歌德大學(xué)的Schwalbe教授及其團(tuán)隊負(fù)責(zé)協(xié)調(diào)該項目的宗旨與共同的科學(xué)目標(biāo)��。核心團(tuán)隊包括來自達(dá)姆施塔特和法蘭克福的五位教授和初級小組負(fù)責(zé)人�,以及來自法蘭克福生物磁共振中心(BMRZ)的九位高級科學(xué)家。該聯(lián)合會的總體目標(biāo)是通過聯(lián)合各方力量�,盡快在新冠肺炎研究中取得有意義的科學(xué)成果。
應(yīng)Schwalbe教授的邀請��,Markus Zweckstetter教授于2020年底在發(fā)表SARS-CoV-2研究成果之后加入了該聯(lián)合會�。作為由50多位NMR專家構(gòu)成的國際合作的一員,德國哥廷根的馬克斯·普朗克多學(xué)科科學(xué)研究所的Zweckstetter教授及其團(tuán)隊一直在探索Covid-19隱藏的作用機(jī)制�。這些研究人員借助于世界上僅有的幾臺1.2 GHzNMR儀器之一,試圖闡明SARS-CoV-2病毒中核衣殼蛋白的結(jié)構(gòu)和相互作用��,并以此確定有前景的候選藥物靶點�。
三、Covid-19的致病機(jī)理
Covid-19疫情的病原體是嚴(yán)重急性呼吸綜合征2型冠狀病毒(SARS-CoV-2)�。對SARS-CoV-2的許多早期研究都集中于所謂的“刺突蛋白”,因為它參與同宿主細(xì)胞的通訊��。但隨著對SARS-CoV-2的理解不斷深入����,核衣殼蛋白(又稱N蛋白)所起的關(guān)鍵作用逐漸變得清晰,因為它不僅保護(hù)RNA不被降解�,而且使轉(zhuǎn)錄機(jī)制能夠聚集,從而增強(qiáng)其復(fù)制能力。
SARS-CoV-2的病毒膜圍繞著螺旋狀核衣殼�,其中病毒基因組被核衣殼蛋白包裹。SARS-CoV-2的核衣殼蛋白在感染細(xì)胞內(nèi)以很高的水平表達(dá)����,提高了病毒RNA轉(zhuǎn)錄的效率,這對病毒復(fù)制至關(guān)重要��。德國神經(jīng)退行性疾病中心(DZNE)和馬克斯·普朗克研究所的科學(xué)家們現(xiàn)在已經(jīng)揭示�,當(dāng)病毒將其內(nèi)部釋放到宿主細(xì)胞中時,這種蛋白質(zhì)和RNA可以共同凝結(jié)成微小的液滴����。
繼續(xù)的研究表明,RNA誘導(dǎo)SARS-CoV-2核衣殼蛋白的協(xié)同液-液相分離�,其中病毒液滴漂浮在細(xì)胞內(nèi)的液體培養(yǎng)基中。然而�,這種液滴的形成并非為冠狀病毒所特有。這種由蛋白質(zhì)和其它分子組成的動態(tài)隔室自然存在于細(xì)胞內(nèi)部����,它們被用作儲存場所和反應(yīng)室。Zweckstetter教授及其團(tuán)隊的研究表明�,新冠病毒也利用了這些可能性,而其它病原體同樣可能發(fā)生這種情況��。
與其體外的相分離能力一致,蛋白質(zhì)在細(xì)胞中與應(yīng)激顆粒(通過液-液相分離形成的細(xì)胞質(zhì)RNA/蛋白質(zhì)顆粒)相關(guān)聯(lián)����,并由病毒調(diào)節(jié)以使復(fù)制效率最大化�。這一過程產(chǎn)生高密度蛋白質(zhì)/RNA縮合物,并通過吸收SARS-CoV-2的RNA依賴性RNA聚合酶復(fù)合物�,為病毒RNA提供有效的轉(zhuǎn)錄機(jī)制。因此����,由小分子或生物制劑對RNA誘導(dǎo)的核衣殼蛋白相分離的抑制,可以對SARS-CoV-2復(fù)制循環(huán)中的關(guān)鍵步驟形成干擾��。
四����、確定潛在的藥物靶點
Zweckstetter教授及其團(tuán)隊認(rèn)為,這些發(fā)現(xiàn)可能為藥物開發(fā)提供了起點�。得益于合作,世界各地的許多團(tuán)體現(xiàn)在都在研究N蛋白��,以評估其作為新冠肺炎治療靶點的潛力��。例如����,通過干擾N蛋白微滴的形成��,病毒RNA可能變得更易受到外部損傷����,其復(fù)制的可靠性也更低����。
N蛋白研究的另一個方面是探索激酶在磷酸化N蛋白的某些殘基中的作用,因為這些酶可能是小分子抑制劑的潛在靶點�。Zweckstetter教授的團(tuán)隊還發(fā)現(xiàn),在人體中自然存在的SRPK1激酶�,會化學(xué)修飾核衣殼蛋白并影響病毒液滴的形成。
五��、NMR 波譜帶來的認(rèn)識
聯(lián)合會的科學(xué)家們使用NMR波譜和其它方法研究該項目�,以檢測分子的結(jié)構(gòu)和動力學(xué)特性。Zweckstetter小組的研究涉及了多臺從600 MHz到950 MHz的高場NMR波譜儀����,這些儀器是對蛋白質(zhì)進(jìn)行高靈敏度研究的核心。現(xiàn)在��,該小組可以使用哥廷根的1.2 GHzNMR儀器��,他們認(rèn)為,與現(xiàn)有的950 MHz儀器相比��,該儀器將三維和更高維度NMR實驗的分辨率提高了至少兩倍��。這將有助于在大的時間和長度尺度上進(jìn)一步研究生物分子標(biāo)記的結(jié)構(gòu)動力學(xué)特性��。1.2 GHzNMR儀器使用高溫超導(dǎo)體作為內(nèi)部線圈��,使用常規(guī)低溫超導(dǎo)體作為外部線圈�,從而有可能打造出28.2特斯拉的均勻磁場����。
憑借哥廷根NMR科學(xué)手段的助力,Zweckstetter教授將NMR與其它結(jié)構(gòu)生物學(xué)技術(shù)相結(jié)合�,從而獲得SARS-CoV-2病毒內(nèi)部工作機(jī)制的更完整的視圖。例如��,使用高分辨率NMR��、分子動力學(xué)模擬和相分離實驗進(jìn)行進(jìn)一步表征��,有助于查明潛在藥物如何與N蛋白相互作用����,以及RNA復(fù)制是否會受到影響����。
NMR為研究生物分子在溶液中的運動方式����,以及其執(zhí)行不同活動時采取的不同構(gòu)象提供了基礎(chǔ)。它也有助于實時可視化分子�,獲得關(guān)于它們?nèi)绾伟l(fā)揮功能及被酶修飾的關(guān)鍵洞察。高場NMR的能力與冷凍電子顯微鏡等技術(shù)形成對比�,冷凍電子顯微鏡需要冷凍樣品,因此只能提供分子作用的快照��。
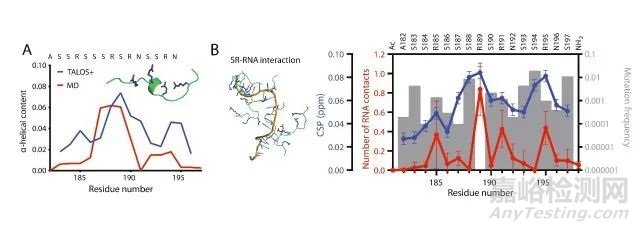
該團(tuán)隊將分子動力學(xué)模擬與1H��、13C和15N核的NMR波譜相結(jié)合��,利用NOESY��、HSQC和全相關(guān)譜(TOCSY)技術(shù)�,對SARS-CoV-2展開了研究。圖1所示為所獲得的深度認(rèn)識����。
圖1:使用NMR研究SARS-CoV-2中核衣殼(NCP)蛋白A182–S197區(qū)域的特性,該區(qū)域含有高比例的絲氨酸和精氨酸(已知可結(jié)合RNA和蛋白質(zhì))�。(A)化學(xué)位移分析(藍(lán))與分子動力學(xué)模擬(紅)一致����,即該區(qū)域中的殘基非常靈活��,在R189旁具有小型α-螺旋結(jié)構(gòu)傾向����。(B)在多糖醛酸(一種簡化的RNA)存在的條件下重新運行模擬表明,精氨酸殘基和RNA磷酸基團(tuán)之間存在大量的分子間接觸�,其中以R189最大。這與R189是A182–S197區(qū)域中唯一未在大多數(shù)已知SARS-CoV-2菌株中突變的殘基的觀察結(jié)果一致(灰條)�。
依據(jù)Creative Commons許可(CC BY 4.0,http://creativecommons.org/licenses/by/4.0/)����,轉(zhuǎn)載自參考文獻(xiàn)[1]�。
六、未來的步驟
本項研究工作的目標(biāo)是改善對新冠肺炎患者的治療��。由于病毒的不斷適應(yīng)和進(jìn)化����,產(chǎn)生了再次感染的風(fēng)險。為了應(yīng)對其帶來的威脅����,聯(lián)合體計劃繼續(xù)提供數(shù)據(jù)�,以探明病毒的內(nèi)部工作原理����,并致力于開發(fā)新的更好的藥物來治療新冠肺炎。
新冠肺炎NMR項目有著超出病毒范圍的進(jìn)一步影響����。盡管合作在科學(xué)中是非常重要的,但研究小組之間的固有競爭限制了合作的范圍����。通常而言,科學(xué)家可能會與一��、兩個其他團(tuán)隊合作�,但新冠肺炎聯(lián)合體表明,數(shù)十個研究團(tuán)隊可以在全球范圍內(nèi)展開合作的潛力��。匯集專業(yè)知識�、設(shè)備和試劑的能力可以加快研究進(jìn)展。建立大型科學(xué)合作以應(yīng)對重大挑戰(zhàn)可能是取得快速進(jìn)展的一種補(bǔ)充方式�,甚至可能是更有力的方式。
參考文獻(xiàn)
Savastano A, Ibanez de Opakua A, Rankovic M and Zweckstetter M, Nucleocapsid protein of SARS-CoV-2 phase separates into RNA-rich polymerase-containing condensates, Nature Communications, 2020, 11: 6041, https://doi.org/10.1038/s41467-020-19843-1