今日頭條
國產(chǎn)首個帶狀皰疹疫苗獲批簽發(fā)��。4月11日��,長春百克生物開發(fā)的帶狀皰疹減毒活疫苗獲得國家藥監(jiān)局生物制品批簽發(fā)證明���。該產(chǎn)品是首個國產(chǎn)帶狀皰疹疫苗產(chǎn)品��,也是全球首個適用于40歲以上人群的帶狀皰疹減毒活疫苗�����,免疫程序為1針��。我國帶狀皰疹發(fā)病率目前是12.6/1000人年�����,每年帶狀皰疹的發(fā)病人數(shù)為266萬���,而且呈現(xiàn)出年輕化趨勢�����。
國內(nèi)藥訊
1.君實PD-1單抗肺癌新適應(yīng)癥報產(chǎn)�����。君實生物PD-1抑制劑特瑞普利單抗的新適應(yīng)癥上市申請獲國家藥監(jiān)局受理,聯(lián)合化療用于可切除III期非小細胞肺癌(NSCLC)的圍手術(shù)期治療和單藥用于輔助治療后鞏固治療��。在III期臨床(Neotorch)中�����,與單純化療相比�����,特瑞普利單抗聯(lián)合化療用于III期可手術(shù)NSCLC患者圍手術(shù)期治療并在后續(xù)進行特瑞普利單抗單藥鞏固治療可顯著延長患者的無事件生存期�����。這是特瑞普利單抗在中國遞交的第七項上市申請���。
2.復(fù)星長效肽制劑神經(jīng)調(diào)節(jié)劑報產(chǎn)���。復(fù)星醫(yī)藥與Revance公司合作開發(fā)的注射用A型肉毒毒素(RT002,DaxibotulinumtoxinA-lanm)上市申請獲國家藥監(jiān)局受理�����,申報的適應(yīng)癥推測為中重度眉間紋患者的治療���。RT002是首款也是唯一一款長效肽制劑神經(jīng)調(diào)節(jié)劑,不含人血清白蛋白和動物成分��,除皺效果的中位持續(xù)時間為6個月��,最長可達9個月�����。復(fù)星醫(yī)藥擁有該產(chǎn)品在中國大陸��、香港��、澳門地區(qū)的獨家授權(quán)��。
3.羅氏FIC眼科雙抗新適應(yīng)癥在華報產(chǎn)�����。羅氏制藥2.2類生物制品法瑞西單抗注射液(faricimab)的上市申請獲國家藥監(jiān)局受理,推測此次申報的適應(yīng)癥為視網(wǎng)膜靜脈阻塞繼發(fā)黃斑水腫���。Faricimab(Vabysmo)是首個針對眼科疾病開發(fā)的VEGF-A/ANG-2雙抗���,已于去年1月獲FDA批準(zhǔn)上市��,用于治療濕性年齡相關(guān)黃斑變性(nAMD)和糖尿病黃斑水腫(DME)�����。2022年8月,羅氏也在中國提交該產(chǎn)品用于治療DME和wAMD的上市申請���。
4.蘇州天辰C5/C3補體抑制劑報IND。天辰生物1類創(chuàng)新藥LP-005臨床試驗申請(IND)獲CDE受理。這是一款可同時抑制補體C5與C3的雙功能融合蛋白���,通過與C5特異性結(jié)合,阻止其裂解為C5a和C5b��,從而不能形成膜攻擊復(fù)合物���,減少血栓并發(fā)癥發(fā)生風(fēng)險,防止突破性溶血事件的發(fā)生���,并通過抑制C3來避免血管外溶血的發(fā)生。該產(chǎn)品擬用于多種補體相關(guān)罕見病和常見病的治療�����。
5.蘇州鑫康合B7-H4抗體報IND�����。鑫康合生物1類生物制品XKH002注射液的臨床試驗申請獲CDE受理���。XKH002是一款I(lǐng)gG4亞型的B7S1(又名B7-H4)抗體,可以有效阻斷B7S1介導(dǎo)的對T細胞增殖和免疫反應(yīng)的抑制作用���。目前針對B7-H4的在研療法多為抗體和ADC藥物��,且均是針對腫瘤的治療,其中乳腺癌和卵巢癌居多�����。在即將到來的AACR年會上���,阿斯利康將首次公開其B7H4 ADC的藥物進展。
6.至善唯新A型血友病基因療法報IND�����。四川至善唯新1類生物制品“ZS802注射液”臨床試驗申請獲CDE受理。ZS802是一款擬開發(fā)用于A型血友病治療的rAAV基因藥物�����,也是至善唯新第二款進入臨床的rAAV基因藥物��。與Biomarin公司同類產(chǎn)品valoctocogene roxaparvovec相比�����,ZS802采用自主研發(fā)的全球最小的肝臟特異啟動子��,解決了病毒載體包裝難題�����,顯著提高藥物質(zhì)量��。
7.安可康雙矛溶瘤病毒報IND。四川安可康生物1類生物制品“注射用重組WNV-HCD86”新適應(yīng)癥臨床試驗申請獲CDE受理���。這是該公司的第一個雙矛1型H2-1溶瘤病毒產(chǎn)品DS1-H2-1���,由西尼羅河病毒(WNV)和人T細胞共刺激基因組成���。自2023年2月至今��,安可康已提交該產(chǎn)品三個適應(yīng)癥的臨床試驗申請。該產(chǎn)品擬開發(fā)用于治療復(fù)發(fā)和難治性神經(jīng)母細胞瘤�����、膠質(zhì)母細胞瘤和結(jié)腸癌��。
國際藥訊
1.莫德納RSV疫苗將在美國報產(chǎn)��。Moderna公司日前透露���,預(yù)計將在本季度遞交其編碼RSV融合前F糖蛋白的mRNA疫苗mRNA-1345的上市申請�����,用以預(yù)防60歲以上成人罹患呼吸道合胞病毒相關(guān)下呼吸道疾病(RSV-LRTD)���。在Ⅲ期臨床ConquerRSV中��,mRNA-1345治療組較安慰劑組出現(xiàn)兩種或兩種以上RSV-LRTD癥狀的病例數(shù)目更少,疫苗預(yù)防效力達到83.7%���。此前��,F(xiàn)DA已授予mRNA-1345突破性療法認(rèn)定和快速通道資格���。
2.CD38抗體兩項腎病Ⅱ期臨床積極�����。Hi-Bio公司CD38抗體felzartamab在治療aPLA2R陽性�����、原發(fā)性膜性腎病(PMN)的Ⅰb/Ⅱa期概念驗證M-PLACE研究以及Ⅱ期NewPLACE研究中均獲得積極結(jié)果���。M-PLACE研究顯示�����,大多數(shù)患者在治療后六個月時其aPLA2R抗體水平減少>50%�����,療效持續(xù)長達12個月���。與NewPLACE中的兩劑和五劑治療方案相比,在M-PLACE中的九劑治療方案觀察到aPLA2R抗體水平呈現(xiàn)最持久的降低���。felzartamab在兩項試驗中總體耐受性良好。
3.同種異體γδT細胞療法最新臨床數(shù)據(jù)積極�����。IN8bio公司同種異體γδ T細胞療法INB-100用于治療接受造血干細胞移植(HSCT)的急性白血病患者的最新臨床積極結(jié)果將在4月23日EBMT年會上發(fā)表��。數(shù)據(jù)截止到2022年12月18日,1x 106劑量組的4例患者在骨髓移植(BMT)后32.2��、29.8���、18.1和3.8個月均處于完全緩解(CR);臨床中���,沒有劑量限制性毒性(DLTs)、治療相關(guān)的≥Gr3不良事件�����、神經(jīng)毒性或細胞因子釋放綜合征的報告���。
4.抗凝血GalNAc-siRNA藥物上I期臨床���。Sirnaomics公司宣布啟動其首款GalNAc-siRNA治療藥物STP122G的I期臨床試驗��。STP122G旨在通過靶向肝細胞產(chǎn)生的酶(十一因子),用以治療抗凝血�����,如心房顫動、肺栓塞��、深層靜脈血栓(DVT)及預(yù)防因手術(shù)而導(dǎo)致的深層靜脈血栓��。該項試驗將在健康受試者中開展��,評估皮下注射給藥的安全性、耐受性和藥代動力學(xué)特征�����。
5.Discovery公司收購ReachBio研究實驗室��。Discovery公司宣布增加對創(chuàng)新臨床前開發(fā)服務(wù)的戰(zhàn)略投資��,收購總部位于西雅圖的ReachBio研究實驗室���。ReachBio成立于2007年�����,是一家專門從事基于細胞的檢測、預(yù)測性血液毒性和藥物篩選服務(wù)的公司�����。此次收購將擴大Discovery的綜合藥物發(fā)現(xiàn)和臨床前開發(fā)產(chǎn)品的規(guī)模,將加速Discovery在其細胞生物學(xué)和毒理學(xué)服務(wù)的持續(xù)增長��。
6.美國超50億美元開發(fā)下一代新冠疫苗���。4月10日,白宮宣布終止與新冠疫情有關(guān)的國家緊急狀態(tài)��,并同時啟動一項下一代項目(Project NextGen)��,擬投資至少50億美元用于開發(fā)下一代新冠疫苗�����。NextGen項目有三個主要目標(biāo):1.開發(fā)一種有望預(yù)防感染和重癥的鼻腔疫苗;2.開發(fā)更持久的疫苗;3.創(chuàng)造“提供更廣泛保護”的疫苗���,預(yù)防所有變體和多種不同的冠狀病毒�����。
醫(yī)藥熱點
1.國家發(fā)布新冠疫苗接種新任務(wù)�����。4月10日�����, 國務(wù)院聯(lián)防聯(lián)機制發(fā)布 《應(yīng)對近期新冠病毒感染疫情疫苗接種工作方案》��?��!斗桨浮诽岬?��,符合條件人群可在感染3個月后接種新冠疫苗��。在此前疫情中���,未感染且尚未完成既定免疫程序的人群�����,未來仍存在感染并發(fā)展成重癥的風(fēng)險;已感染且未完成基礎(chǔ)免疫的人群���,由于疫苗或病毒誘導(dǎo)的抗原刺激不足,免疫保護效果也明顯弱于完成基礎(chǔ)免疫后再感染獲得的混合免疫��?����!斗桨浮窂娬{(diào),現(xiàn)階段我國疫苗接種的重點是針對不同目標(biāo)人群補齊免疫水平差距��,進一步降低重癥和死亡風(fēng)險��。
2.天津市第一中心醫(yī)院水西院區(qū)正式啟用��。近日��,天津市第一中心醫(yī)院新址擴建項目(水西院區(qū))建設(shè)工程完成并投入使用���。水西院區(qū)坐落于天津市西青區(qū)侯臺風(fēng)景區(qū)東南側(cè),東側(cè)臨春明路���,西側(cè)臨文正路��,南側(cè)臨保山西道,北側(cè)臨保澤西道��?�?偨ㄖ娣e41萬平方米��,設(shè)計床位2000張�����,日門診量7000人次�����,日急診量1200人次��,落實了優(yōu)質(zhì)醫(yī)療資源擴容目標(biāo)并一定程度上緩解群眾對優(yōu)質(zhì)醫(yī)療資源需求的矛盾�����。
3.清華大學(xué)成立器官移植與仿生醫(yī)學(xué)研究院�����。4月8日,清華大學(xué)揭牌成立“器官移植與仿生醫(yī)學(xué)研究院”(簡稱“移植仿生院”)�����,由著名肝膽外科和肝臟移植專家董家鴻院士擔(dān)任院長�����,將推動器官移植臨床醫(yī)學(xué)與清華優(yōu)勢學(xué)科深度交叉融合��,建設(shè)臨床驅(qū)動型與超學(xué)科融合式卓越器官移植中心�����。
評審動態(tài)
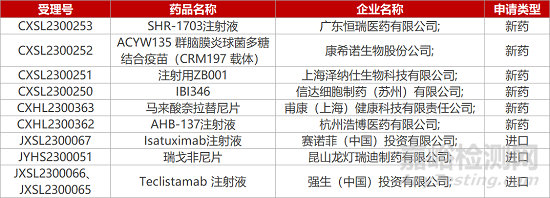
1. CDE新藥受理情況(04月12日)
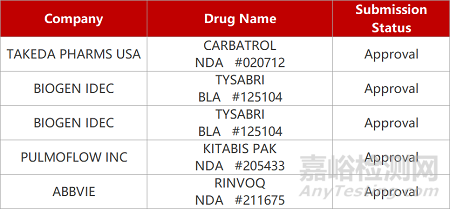
2. FDA新藥獲批情況(北美04月11日)