摘 要 Abstract
近年來��,隨著各種病原體全基因組測序工作的完成以及生物信息學在疫苗方面的革命性進展�����,反向疫苗學技術成為一種新興的疫苗開發(fā)方式���。該技術省時經(jīng)濟��,為傳統(tǒng)疫苗學無法研制的疫苗領域提供一種新的思路����。迄今為止����,研究者已經(jīng)多次運用反向疫苗學技術研究多種細菌或病毒類疾病,本文主要對反向疫苗學技術在細菌����、病毒和寄生蟲疫苗研發(fā)中的應用進展進行全面概述。
In recent years, with the completion of whole genome sequencing of various pathogens and revolutionary advances in bioinformatics for vaccines, reverse vaccinology technology has emerged as a new approach to vaccine development.The technology is time-saving and economical and offers a novel idea in the field of vaccines that cannot be developed by conventional vaccinology. To date, researchers have repeatedly used reverse vaccinology techniques to study a variety of bacterial or viral diseases. This paper provides a comprehensive overview of the progress of reverse vaccinology techniques in the development of bacterial, viral and parasitic vaccines.
病原體持續(xù)變異和新型突發(fā)傳染病的出現(xiàn)使疫苗的需求日益增長��,隨著測序技術和生物信息學技術的快速發(fā)展��,反向疫苗學技術擴大了病原體抗原篩選范圍�����,提高了抗原識別效率,加快了疫苗的研發(fā)進程�����。因此��,相較傳統(tǒng)疫苗學而言����,反向疫苗學技術彌補了其不足之處,在細菌���、病毒和寄生蟲疫苗研發(fā)中逐漸得到更加廣泛的運用���。
1、 在細菌疫苗研發(fā)中的應用
1.1 腦膜炎奈瑟菌
腦膜炎奈瑟菌(Neisseria meningitidis) 又稱為腦膜炎球菌�����,是流行性腦脊髓膜炎的病原菌��,腦膜炎球菌是引起兒童和青少年急性化膿性腦膜炎的主要病因���,致死率高���,嚴重威脅人類健康。腦膜炎球菌菌株有多個血清型����,但多數(shù)病例常由A、B���、C���、W135、Y 群血清型引起[1]��。通過傳統(tǒng)疫苗學已成功開發(fā)出針對A����、C、W135�����、Y 血清型的傳統(tǒng)多糖疫苗,有效降低了相應血清群的流行性腦脊髓膜炎發(fā)病率和死亡率�,但是無有效的B 血清型疫苗。原因主要有兩點:一是由于B 群腦膜炎球菌(group Bmeningococcus)的莢膜多糖與其他幾個血清型的菌株不同���,免疫原性較低��,與人體神經(jīng)組織存在交叉反應����,易產(chǎn)生自身免疫�,阻礙B 群腦膜炎球菌疫苗的開發(fā)。二是B 群腦膜炎球菌菌體表面蛋白容易突變�����,利用該蛋白做疫苗只對同源菌株提供保護作用�����,而對異源菌株則沒有明顯的保護效果[2]���。
皮扎(Pizza) 團隊[3] 首次將反向疫苗學技術的研究思路和技術應用到B 群腦膜炎球菌疫苗的研究�,發(fā)現(xiàn)該疫苗具有很好的保護效果[4-5]����。該團隊研發(fā)的具體技術路線是:利用基因組數(shù)據(jù)庫和生物信息學軟件對B 群腦膜炎球菌的MC58 這一菌株進行全基因組分析[6],從2158 個開放閱讀框(Open Reading Frames��,ORFs)中篩選出600 個潛在的候選抗原基因��。這些候選抗原多為分泌蛋白�����、外膜蛋白��、脂蛋白和毒力因子等[7]�����。通過聚合酶鏈反應(PCR)技術擴增候選基因并分別克隆到表達載體中����,其中有350 個編碼基因在大腸桿菌中成功表達,表達產(chǎn)物是與組氨酸(His)或谷胱甘肽硫轉(zhuǎn)移酶(GST)標簽的融合蛋白[8]�����。將表達產(chǎn)物純化后免疫小鼠����,應用多種免疫學檢測技術來評價抗原的免疫原性和免疫保護性����。在所表達的91 種候選蛋白中��,有29 種蛋白能誘導產(chǎn)生殺菌抗體[9]��。研究者進一步研究發(fā)現(xiàn)��,其中2 個蛋白所產(chǎn)生的血清殺菌抗體滴度與外膜囊泡(OMV)誘導的B 群腦膜炎球菌相似���,已知OMV 只對人類的同源菌株提供保護�����。為了測試這些蛋白質(zhì)作為候選抗原是否適合于其他B 群腦膜炎球菌菌株�����,應用生物信息學軟件對另外31 株B 群腦膜炎球菌的基因組序列進行保守性分析�����,篩選出有代表性的血清型B 群腦膜炎球菌候選抗原����, 發(fā)現(xiàn)5 個候選蛋白抗原在序列上是保守的,分別是GNA33��、GNA1162�����、GNA1220 �����、GNA1946 和GNA2001��,它們誘導產(chǎn)生的殺菌抗體能抵抗大多數(shù)B 群腦膜炎球菌菌株的感染[10]���。因此,該研究團隊證明利用基因組信息篩選鑒定有效的保護性抗原是可行的�����,從而推動反向疫苗學技術的發(fā)展����。
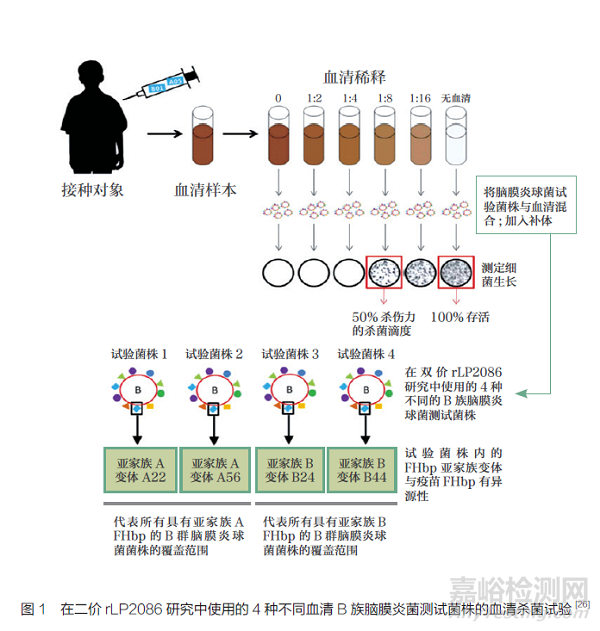
OMV 疫苗已被有效地用于應對古巴�����、挪威和新西蘭的特定流行性B 群腦膜炎球菌菌株引起的疾病暴發(fā)[11]����。OMV 疫苗的免疫原成分主要是針對B 群腦膜炎球菌菌株所表達的PorA 蛋白��,由于PorA 蛋白保守性低���,不具備普遍保護力����,OMV 疫苗預防感染B 群腦膜炎球菌的能力僅限于表達相同PorA 蛋白變體的菌株[12]�����。為了應對不同菌株之間的廣泛變異性�����,人們一直在尋求新的候選疫苗�����。近些年,有研究者根據(jù)所選蛋白在腦膜炎球菌自然群體中的變異程度以及它們對不同菌株誘導殺菌活性的能力�,選擇了3種最有潛力的抗原,分別是H 因子結(jié)合蛋白(factor H-bindingprotein��,F(xiàn)Hbp)[13]��、奈瑟菌肝素結(jié)合抗原(Neisseria heparin binding antigen,NHBA )��、奈瑟菌黏附素A(Neisseriaadhesion A�����,NadA)[14-15]��, 與OMV 聯(lián)合制成B 群腦膜炎球菌四價疫苗4CMenB(Bexsero®)[16-18]���。此外,還有一款含有2 種FHbp的B 群腦膜炎球菌疫苗���, 即二價rLP2086(Trumenba®)��。通過加速批準��, 二價rLP2086 和4CMenB 在美國獲得許可��, 其中二價rLP2086 被批準用于10~25 歲個體[19]��。
已證明三劑量的4CMenB疫苗接種程序和額外加強劑量對嬰兒具有免疫原性��, 而兩劑量的4CMenB 疫苗接種計劃對1~10 歲兒童����、青少年和成人均具有免疫原性[20]。2015 年�����,4CMenB 首次納入英國的國家免疫計劃(National Immunization Program��,NIP)����,在嬰兒中使用減少劑量的2+1(2、4 和12個月)計劃[3]�。繼英國之后,其他一些國家包括安道爾[21]���、愛爾蘭[22]��、意大利[23] 和立陶宛[24]也批準了4CMenB���。二價rLP2086 由應用反向疫苗學技術篩選出的FHbp 重組而成�����,能夠刺激強烈的抗體反應�,殺死各種血清B 型菌株[25]��。更重要的是����,在16~23 歲人群中進行的兩項Ⅲ期臨床研究表明����,對4 個主要的(圖1)和額外10 個異源的B 群腦膜炎球菌測試菌株進行人體血清殺菌抗體檢測,在2 次或3 次免疫后引起機體保護性免疫反應[26]��。盡管嬰兒是美國侵襲性腦膜炎球菌?����。↖MD)發(fā)病率最高的人群之一��,且大部分病例是由B群腦膜炎球菌引起的[27]����,但是二價rLP2086 和4CMenB 目前在美國都沒有獲得用于嬰兒的許可�。
1.2 肺炎鏈球菌
肺炎鏈球菌(Streptococcus pneumoniae)在免疫力低下的人群中可引起肺炎�����、鼻竇炎���、中耳炎�����,甚至導致敗血癥和化膿性腦膜炎等嚴重疾病[28-29]�����,主要影響5 歲以下兒童和老年人���,多重耐藥臨床分離株的出現(xiàn)以及高致死率引起了研究者對該疫苗開發(fā)的關注。目前的疫苗是基于選定的莢膜類型與載體蛋白結(jié)合�,以實現(xiàn)對兒童和成人的保護。然而����,這類疫苗有幾個局限性:首先����,已報道的莢膜多糖有100 多種����,疫苗所包含的血清型只占現(xiàn)有血清型的一小部分[29] ;其次��,結(jié)合疫苗的成本高�,在低收入家庭或國家中難以推廣。為解決這些問題�����,研究者們正在利用反向疫苗學技術著力尋找以表面保守的蛋白質(zhì)為基礎的候選抗原[30-31]����。
自2001 年以來�����,通過測序技術已經(jīng)獲得幾株肺炎鏈球菌的全基因組數(shù)據(jù)�,并且對其表面毒力因子有了豐富的認識。為了確定潛在的候選疫苗抗原, 維茨曼(Wizemann) 等[32] 利用生物信息學技術分析了肺炎鏈球菌的全基因組數(shù)據(jù)���,并對該基因組所有的2687 個ORFs 進行了綜合評估�,最終篩選出位于細菌表面的130 個ORFs��, 其中只有108 個ORFs 能夠成功克隆和表達����,將這些蛋白純化后,通過小鼠模型評價其免疫保護效果����。結(jié)果表明, 有6 種蛋白(Sp36�����、Sp46���、Sp91���、Sp101、Sp128和Sp130)能夠使機體產(chǎn)生抗肺炎鏈球菌感染的有效抗體�����。通過流式細胞熒光分選技術(FACS)分析證明這6 種抗原定位在細菌表面,并且都在不同菌株中廣泛分布[33-34]����。為了評估這些抗原在人類宿主感染期間的表達情況,應用免疫印跡試驗檢測了17 名細菌性肺炎恢復期患者血清與5種重組肺炎鏈球菌抗原的反應性���。結(jié)果表明����,17 名患者中的15 名在肺炎鏈球菌感染期間產(chǎn)生的免疫血清可以識別Sp36 蛋白�。此外, 大多數(shù)患者血清都能識別Sp91�、Sp128 和Sp130 蛋白( 識別率分別為76%、82% 和94%)����。71% 患者的恢復期血清不能識別Sp46 蛋白,表明該蛋白可能在這種臨床疾病中的表達水平很低���,或者在自然環(huán)境中的免疫原性很差。由于恢復期抗血清的數(shù)量有限���,Sp101 蛋白沒有以這種方式進行檢測�����。雖然對這些抗原的免疫反應本身并不能預測其保護能力�����,但這些數(shù)據(jù)確實表明它們在體內(nèi)表達����,在宿主感染期間具有免疫原性。此外��,在感染敗血癥小鼠模型中發(fā)現(xiàn)Sp91蛋白既沒有免疫原性����,也沒有保護性[35]。由于鑒定出可用的候選蛋白數(shù)量太少��,因此研究者仍在積極利用反向疫苗學技術尋找新的候選抗原��,使其成為新型肺炎鏈球菌疫苗的組分[36-37]����。
近兩年��, 馬丁· 加利亞諾(Martín-Galiano) 等[31] 基于之前的研究��,應用反向疫苗學技術探究出新一代基于蛋白質(zhì)的肺炎鏈球菌疫苗的抗原候選物��。DiiA 是一種由sp_1992 基因編碼的表面蛋白���,包含幾個保守的B 細胞表位,與細菌定植和致病機制有關����,在小鼠模型中,該蛋白可產(chǎn)生強烈的免疫反應����,與佐劑對照組相比,接種DiiA 可促進細菌清除并加強對機體的保護����,使小鼠感染后48 小時的存活率提高70%,證實該蛋白可能成為降低肺炎鏈球菌感染的候選抗原���。
1.3 結(jié)核分枝桿菌
結(jié)核分枝桿菌(Mycobacterium tuberculosis)是一種古老的病原體����,通過其復雜的機制來逃避免疫監(jiān)視并獲得在宿主中建立持續(xù)感染的能力����,是引起肺結(jié)核的致病菌。目前�,全球估計有1/3 的人口攜帶結(jié)核分枝桿菌,而其中3%~10% 的人群在其一生中有發(fā)生活動性結(jié)核病的風險[38-39]���。由于人類免疫缺陷病毒的并發(fā)感染��、抗生素濫用導致耐藥株增加等����,肺結(jié)核的發(fā)病率呈回升趨勢[40]�。在世界衛(wèi)生組織(World Health Organization,WHO) 擴大免疫接種計劃指導下�����, 卡介苗(Bacillus Calmette-Guérin��,BCG)是全球廣泛使用的唯一結(jié)核病疫苗[41]����,全球大約有40 億人進行接種���,對結(jié)核病的預防作出了很大貢獻。隨著醫(yī)療水平的不斷提高��,雖然BCG 對控制兒童結(jié)核病具有一定效果�,但對于成人結(jié)核病預防效果在不同地區(qū)存在一定的差異[42],其效力不穩(wěn)定���,不能完全解決預防和控制問題����,因此研發(fā)新型預防和控制結(jié)核病疫苗非常有必要��。
之前用傳統(tǒng)方法研發(fā)結(jié)核病疫苗的最大困難是所鑒定的抗原在動物模型中提供的保護力比BCG低�����,而且結(jié)核菌培養(yǎng)周期長[43]���。研究者利用反向疫苗學技術對結(jié)核分枝桿菌全基因組序列進行分析�,發(fā)現(xiàn)一組被稱為PE_PGRS基因家族的基因�����,在該病原體的致病過程中發(fā)揮著作用[44-45]。穆德利(Moodley) 等[46-47] 利用生物信息學分析PE_PGRS 家族的4 個基因(PE_PGRS17�、PE_PGRS31、PE_PGRS50和PE_PGRS54) 的結(jié)構和功能�����, 發(fā)現(xiàn)PE_PGRS17 具有很好的免疫原性���,通過算法工具預測T 細胞和B 細胞表位來構建多表位疫苗(multiple epitope vaccines,MEV)候選體��,用于疫苗的開發(fā)�,但需要進一步的試驗驗證[48-50]����。
1.4 牙齦卟啉單胞菌
牙周炎是侵犯牙齦和牙周組織的慢性炎癥,是一種破壞性疾病��,也是導致成人牙齒缺失的主要原因����,目前尚無理想的治療方法, 只能減緩或者抑制病情發(fā)展����,我國成人牙周炎的發(fā)病率約為50%����。一些動物模型研究表明���,牙齦卟啉單胞菌(Porphyromonas gingivalis)是導致成人慢性牙周炎的一種主要致病菌�����,需開發(fā)一種能夠有效預防牙齦卟啉單胞菌感染繼而引發(fā)慢性牙周炎的疫苗���。
羅斯(Ross)等[51] 應用反向疫苗學技術共篩選到120 個基因,有107 個成功表達��,對表達產(chǎn)物用大鼠���、小鼠以及人類的抗牙齦卟啉單胞菌血清做免疫學分析�,獲得了40 個陽性結(jié)果,表明這40 個基因的編碼產(chǎn)物能夠在機體中誘導產(chǎn)生抗體����。隨后進行的動物實驗中�����,發(fā)現(xiàn)PG32�、PG33 基因編碼的蛋白具有良好的保護性與保守性�����,可以被用來作為慢性牙周炎疫苗的候選抗原��。納西里(Nasiri)等[52] 利用反向疫苗學技術得到12 種可作為新型牙周疾病疫苗的候選抗原��。汗(Khan) 等[53] 也發(fā)現(xiàn)3 種具有抗原性且對病原體的生存至關重要的蛋白�, 分別為Q7MWZ2����、Q7MVL1 和Q7MTY1,推測可用于疫苗設計�。
1.5 金黃色葡萄球菌
金黃色葡萄球菌(Staphylococcus aureus) 是常見的食源性致病菌,廣泛存在于自然環(huán)境中����,在適宜條件下,能夠產(chǎn)生腸毒素��,引起人類食物中毒�����。由該菌引起的食物中毒占食源性微生物食物中毒事件的25%左右��。因此���,金黃色葡萄球菌成為僅次于沙門菌和副溶血弧菌的第三大致病菌。研究者們[54-56] 應用反向疫苗學技術發(fā)現(xiàn)有12 種蛋白可作為研發(fā)金黃色葡萄球菌疫苗的候選抗原����,其中已有3 個基本的毒力因子和抗原蛋白在大腸桿菌中成功表達,包括糖基轉(zhuǎn)移酶�、彈性蛋白結(jié)合素和葡萄球菌分泌抗原。近兩年����, 瑙蕾姆(Naorem)等[57] 通過反向疫苗學技術又確定了4 個潛在的候選蛋白,其中PrsA 蛋白和EssA 蛋白被認為是有希望的疫苗候選分子����。
1.6 布魯氏菌
布魯氏菌(Brucella)是能引起全球性人畜共患傳染病的病原體�����,其引起的疾病涉及范圍非常廣��,特別是在亞洲���、非洲、南美洲和地中海地區(qū)[58]���,造成嚴重的公共健康威脅�,人布魯氏菌病臨床表現(xiàn)為各種類型�����,包括波動熱���、關節(jié)炎、心內(nèi)膜炎���、腦膜炎等[59-60]�����。我國目前唯一批準人用布魯氏菌疫苗為減毒活疫苗104M 株[61]�����,由于布魯氏菌保護性抗原譜復雜�,單一抗原很難起到完全的保護作用。宰(Zai)等[62] 建立了蛋白質(zhì)組學與生物信息學聯(lián)用的保護性抗原篩選新策略�,獲得多個新的潛在保護性抗原;對其中4 個候選抗原進行免疫動物試驗驗證��,證明Omp19���、VirB8 和HlyD 能使小鼠產(chǎn)生較強的免疫反應�����,并且在攻毒試驗中有較好保護效果��,為新型人用布魯氏菌疫苗設計奠定了基礎[63-64]�����。
1.7 幽門螺桿菌
幽門螺桿菌(Helicobacter pylori)是一種可導致消化性潰瘍等胃部疾病的致病菌��,被WHO列為一級致癌因子[63]�����。由于抗幽門螺桿菌治療中使用抗生素的耐藥性菌株不斷增加�����,開發(fā)有效的疫苗迫在眉睫�����。應用反向疫苗學技術優(yōu)化幽門螺桿菌疫苗設計,可能加快這一目標的實現(xiàn)����。哈斯(Haas) 等[65] 用陽性患者血清對幽門螺桿菌菌株進行免疫印跡分析,將檢測得到的抗原識別譜進行系統(tǒng)分析�,發(fā)現(xiàn)7 個蛋白質(zhì)只對陽性患者血清有免疫反應,其中HtrA(HP1019)���、Cag3(HP0522) 和HP0231 蛋白是新發(fā)現(xiàn)的特異性抗原。納茲(Naz)等[66] 采用反向疫苗學技術對幽門螺桿菌基因組中所有候選蛋白的表面抗原表位進行預測和分析���,預測出可能的候選表位包括vacA�����、babA����、sabA、fecA 和omp16��,為開發(fā)多組分幽門螺桿菌疫苗奠定了基礎���。馬(Ma)等[67]對幽門螺桿菌的381 個蛋白質(zhì)序列通過生物信息學的方法構建免疫原性評分模型����,并對排名靠前的部分蛋白質(zhì)的免疫原性進行測試��。將UreB��、PLA1 和Omp6三個表現(xiàn)良好的蛋白的B 細胞表位和T 細胞表位以隨機順序組裝成6 個MEV���。通過結(jié)構預測和分子對接模擬試驗分析,選擇構建S1 結(jié)構����,它具有結(jié)合TLR2��、TLR4 和TLR9 的潛力�����,最終形成穩(wěn)定的復合物�,刺激機體產(chǎn)生強烈的免疫反應��。該研究應用反向疫苗學技術為構建MEV 的表位組裝提供了很好的策略�。
1.8 肺炎衣原體
肺炎衣原體(Chlamydia pneumoniae) 是專性細胞內(nèi)寄生的病原體, 感染后不僅能引起肺炎�����, 還能導致動脈粥樣硬化和心血管疾病等�����。蒙蒂賈尼(Montigiani) 等[68] 應用反向疫苗學技術鑒定肺炎衣原體的表面抗原�,首先通過分析肺炎衣原體的基因組序列,預測出157 個可能暴露在其表面的蛋白質(zhì)���。將這些蛋白質(zhì)在大腸桿菌中克隆、表達�����、純化,然后免疫小鼠制備抗血清���,應用免疫學技術評價各個蛋白的免疫原性��,并成功地定位肺炎衣原體原體時期的表面蛋白�。這一研究開辟了確定肺炎衣原體表面蛋白的新途徑��,為研發(fā)新型肺炎衣原體疫苗奠定基礎��。努爾(Noor)等[69] 在研究中共發(fā)現(xiàn)了4754 個核心蛋白����,隨后應用蛋白質(zhì)組學技術,從4754 個核心蛋白中獲得4 個目標蛋白���。最后通過對其進行免疫信息學分析來構建MEV�,對MEV 中密碼子進一步優(yōu)化��,并克隆到大腸桿菌表達宿主中���,以確保疫苗蛋白的最大表達�。
1.9 梅毒螺旋體
梅毒螺旋體(Treponema pallidum)是引起梅毒的病原體。該病原體在實驗室條件下不能培養(yǎng)�����,不宜用傳統(tǒng)方法研究疫苗[29]��。之前有研究者通過兔體培養(yǎng)梅毒螺旋體���,已鑒定了20 多種疫苗候選抗原����,但沒有進行深入的研究����。近些年,研究者首次應用反向疫苗學技術開展梅毒疫苗研究����,通過對梅毒螺旋體進行全基因組預測,篩選出潛在的抗原候選分子�����,并以重組蛋白或DNA 的形式表達[70],可加快該疫苗的研發(fā)進程����。庫馬爾·賈伊斯瓦爾(KumarJaiswal)等[71] 按照反向疫苗學技術路線來確定候選抗原��,最終鑒定出15 個潛在的抗原蛋白�����,可作為未來梅毒螺旋體疫苗研發(fā)的候選抗原����。
2、 在病毒疫苗研發(fā)中的應用
2.1 新型冠狀病毒
新型冠狀病毒(Severe Acute Respiratory Syndrome Coronavirus 2)感染后會引起輕度至中度呼吸道疾病�����,較嚴重可導致肺炎����、嚴重急性呼吸綜合征、腎衰竭甚至死亡�。截至2023 年3月7 日,全球已有7 億多例感染病例�����,其中包括680 多萬例死亡病例[72]。接種疫苗能有效阻斷病毒感染��,截至2022 年初��,全球已有9 款疫苗列入緊急使用清單��,57 個國家的70% 人口接種了新冠疫苗[73]��。但新型冠狀病毒易變異����,目前已有11 種變異毒株,基于原始毒株序列設計的疫苗針對變異毒株可能無法提供完全保護��。因此���,在新型冠狀病毒疫苗研發(fā)工作中需要充分考慮變異毒株�。
新型冠狀病毒由刺突蛋白(S)�����、膜蛋白(M)����、包膜蛋白(E)和核衣殼蛋白(N)4 個結(jié)構蛋白組成�����。病毒進入宿主細胞由S 蛋白介導����,該蛋白由2 個功能亞基(S1 和S2)組成���,S1 亞基由N端結(jié)構域(NTD)和受體結(jié)合域(RBD)組成,新型冠狀病毒通過S1 亞基上的RBD 與細胞表面受體血管緊張素轉(zhuǎn)換酶2(ACE2)相結(jié)合感染宿主細胞���;S2 亞基由融合肽(FP)�、七肽重復序列1(HR1)�、中心螺旋(CH)、連接結(jié)構域(CD)�、七肽重復序列2(HR2)、跨膜結(jié)構域(TM)和細胞質(zhì)尾部(CT)組成����,主要負責病毒與宿主細胞的膜融合[74]。
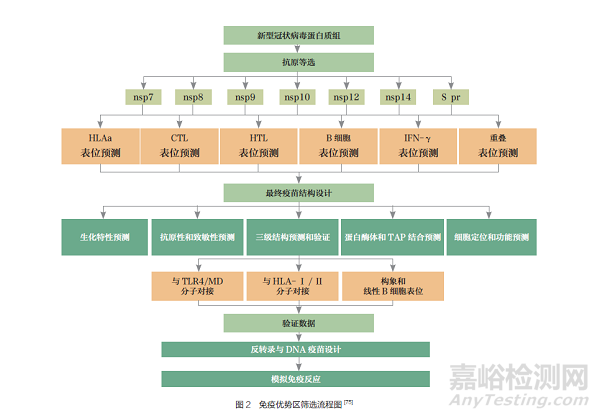
研制新型冠狀病毒這種突發(fā)且易突變病原體的疫苗����,利用反向疫苗學技術可以大大縮短其抗原篩選驗證過程�,及時確定可能有效的免疫抗原��。薩法維(Safavi)等[75] 利用多種免疫學工具篩選出新型冠狀病毒非結(jié)構蛋白上(nsp7��、nsp8��、nsp9�����、nsp10�、nsp12 和nsp14)能激發(fā)T 細胞免疫應答的免疫優(yōu)勢區(qū)(圖2),并選擇S 蛋白400~510 位片段(S pr)作為誘導產(chǎn)生中和抗體的免疫優(yōu)勢區(qū)����,將這兩部分免疫優(yōu)勢區(qū)組合成新型冠狀病毒疫苗候選抗原。該疫苗由3 個區(qū)域組成����,包括β- 防御素(TLR4 激動劑)、B 細胞反應誘導域和T 細胞反應誘導域��, 并在疫苗的N 端連接TLR4/MD 復合物����,C 端同時連接CD4+T 輔助性表位PADRE�����。該疫苗具有多個CD8+T 和CD4+T 重疊表位��、IFN-γ 誘導表位和線性B 細胞表位���, 經(jīng)過理化性質(zhì)、抗原性和群體覆蓋率等多個項目驗證���,該疫苗可與TLR4/MD 復合物形成穩(wěn)定的相互作用,并經(jīng)過計算機模擬該疫苗HLA- Ⅰ 和HLA- Ⅱ 表位的全球人口覆蓋率約為96.2% 和97.1%��。
斯利瓦斯塔瓦(Srivastava)等[76] 對免疫表位數(shù)據(jù)庫中新型冠狀病毒蛋白質(zhì)組中11 個ORFs進行抗原區(qū)域篩選�����, 將重疊的表位簇命名為抗原補?。ˋg-patches),并利用識別出的Ag-patches設計多補丁疫苗(multi-patch vaccines ��, MPVs )���,MPVs 相較于MEV 能覆蓋更多的重疊表位以及HLA 等位基因��。該研究從新型冠狀病毒蛋白組中共鑒定出73 個CTL 表位和49個HTL 表位��,這些Ag-patehes包含針對55 種HLA 等位基因的768 個抗原表位��,覆蓋全球99.98% 的人口且高度保守�����,并與先天免疫受體TLR3 形成穩(wěn)定的復合物�����。該研究從整個新型冠狀病毒蛋白組中識別出高免疫原性的抗原區(qū)域�, 具有高特異性和全面的人口覆蓋率,是一種極具潛力的新型冠狀病毒候選疫苗��。
塔希爾· 卡瑪爾(Tahir UlQamar)等[77] 利用多種生物信息學軟件對新型冠狀病毒S���、E和M 蛋白表面的B 細胞表位進行預測, 共篩選到23 個線性表位���、9 個MHC- Ⅰ 類和7 個MHC- Ⅱ 類表位。最終選取3個CTL��、6 個HTL 和4 個BCL表位構建一種基于多表位的亞單位疫苗(multiepitope-based subunit vaccine�����,MESV)��, 通過計算機模擬預測該疫苗可覆蓋全球88.4% 的人口���,并且可與先天免疫受體TLR3 穩(wěn)定結(jié)合��,使其可能被引入宿主免疫系統(tǒng)。通過計算機模擬�,該疫苗能引起強烈的免疫反應且不產(chǎn)生過敏反應,同時也可在E.coli K-12 系統(tǒng)中表達��。但該研究依賴計算機模擬以及免疫信息學��,需要進一步的體內(nèi)外實驗驗證其預測的準確性���,為所設計的MESV 提供更加全面的數(shù)據(jù)基礎�。
2.2 流行性感冒病毒
流行性感冒病毒(influenza virus),簡稱流感病毒�����,分為甲(A)��、乙(B)����、丙(C)和?�。―)四型����,感染流感病毒后可引起人禽畜等多種動物發(fā)病。其中����,人流感病毒主要由甲、乙和丙三型組成�����,人感染后可引起季節(jié)性流感���、禽流感和人畜共患型流感��。流感病毒在全球范圍內(nèi)廣泛傳播��,可感染任何年齡段的人群,甲型流感病毒(influenza A virus)曾多次引起世界性大流行�,嚴重的可造成重大疾病甚至死亡���,預防流感病毒感染最有效的辦法就是接種疫苗���。
流感病毒結(jié)構由包膜、基質(zhì)蛋白和核心三部分組成,包膜上含有2 種非常重要的糖蛋白:血凝素(HA)和神經(jīng)氨酸酶(NA)�,基質(zhì)蛋白構成了病毒的骨架����,核心包含了病毒的遺傳物質(zhì)和酶�����。流感病毒HA 蛋白具有免疫原性,抗HA 抗體可中和流感病毒�����,NA蛋白切斷流感病毒與宿主細胞的聯(lián)系����,可作為流感治療藥物的靶點。流感病毒不同基因組之間易發(fā)生基因重組���,主要為抗原轉(zhuǎn)變和抗原漂移�����。流感病毒的高度變異性導致人們無法預測即將流行的病毒株,隨即無法針對性地進行疫苗接種。因此�����,WHO 全球流感監(jiān)測和應對系統(tǒng)(Global Influenza Surveillance and Response System�����,GISRS)持續(xù)監(jiān)測人類中流行的流感病毒��,并每半年更新一次流感疫苗組分���。
夏爾馬(Sharma)等[78] 選取1918 年����、1957 年、1968 年和2009 年引起流感大流行以及世界范圍內(nèi)不同地區(qū)季節(jié)性流感流行病毒株��,共50 株甲型流感病毒�����, 這些毒株來自5 種甲型流感病毒亞型(H1N1���、H2N2、H3N2�����、H5N1 和H7N9)�����, 并利用多種生物信息學軟件對其HA、M1 和NP 蛋白上的CTL����、HTL和BCL 表位進行預測����,每種蛋白選取4 種MHC- Ⅰ類表位(A1�����、A2��、A3 和B7)��。該研究在HA蛋白上識別到18 個CTL 表位����、25 個HTL 表位和5 個BCL 表位;M1 和NP 蛋白上均識別到4 個CTL 表位�����、5 個HTL 表位和1 個BCL 表位。結(jié)合每一類蛋白的保守性和HLA 等位基因覆蓋率等因素�����,最后構建一個含有26 個CTL 表位�、9 個HTL 表位和7 個BCL 表位的通用流感亞單位疫苗��。利用RaptorX 預測到該疫苗具有高度穩(wěn)定的三級結(jié)構����,并與TLR3��、TLR7��、TLR8��、MHC- Ⅰ 和MHC- Ⅱ 能形成穩(wěn)定的復合物�����,通過計算機模擬可知該疫苗具有一定免疫原性�。
2.3 呼吸道合胞病毒
呼吸道合胞病毒(respiratory syncytial virus)是導致細支氣管炎和肺炎的主要病原體����,其中6個月以下嬰兒為高風險人群�����,同時呼吸道合胞病毒也可導致老年人以及免疫缺陷人群發(fā)生嚴重的呼吸道疾病[79]����。1 歲以下嬰兒因感染呼吸道合胞病毒導致死亡的病例占急性呼吸道感染死亡病例的1/3,每年有多達20 萬兒童死于呼吸道合胞病毒感染[80]����。由于呼吸道合胞病毒在進化過程中形成了多種免疫逃逸機制���,目前尚無呼吸道合胞病毒疫苗上市�����。
呼吸道合胞病毒基因組主要編碼3 種跨膜蛋白(F、G 和SH)����、2 種基質(zhì)蛋白(M1 和M2)����、3 種核衣殼蛋白(N、P 和L)以及2 種非結(jié)構蛋白(NS1和NS2)�。多項研究結(jié)果表明��,呼吸道合胞病毒的F 和G 蛋白在促進細胞感染和調(diào)節(jié)宿主免疫反應等方面起到重要作用[81-82]�����,可作為呼吸道合胞病毒疫苗研發(fā)的重點[83-85]�����。
孫譽芳等[86] 將呼吸道合胞病毒胞外區(qū)第64~298 位氨基酸作為目標區(qū)域����, 利用多種生物信息學軟件對該區(qū)域進行B、Th 和CTL 細胞表位預測�����, 綜合預測分值并選取共有序列�,最終確定呼吸道合胞病毒G 蛋白的5 個B 細胞表位、10 個Th表位和9 個CTL 表位。預測到的B 細胞表位分別位于85~90�����、142~147、227~231����、250~258和280~295 區(qū)段�����, 其中第250~258 位和第280~295 位氨基酸可與呼吸道合胞病毒感染者血清發(fā)生反應[87]��, 第142~204位氨基酸與乙肝病毒嵌合的病毒樣顆粒疫苗免疫小鼠可誘導產(chǎn)生呼吸道合胞病毒特異性中和抗體IgG,并對呼吸道合胞病毒感染具有保護作用[88]�����。有研究采用HLA-A3 型多肽( 第184~198位氨基酸)免疫小鼠后���,可誘導產(chǎn)生Th1 型細胞因子���,且小鼠體內(nèi)嗜酸性粒細胞增多[89],與孫譽芳等[86] 研究預測的第188~197位氨基酸相似��。第130~230 位氨基酸串聯(lián)在復制缺陷型腺病毒載體上���,可在小鼠體內(nèi)誘導強烈的CD4+T 細胞反應[90]���。該研究綜合多種預測結(jié)果����,篩選出呼吸道合胞病毒G 蛋白上的多個抗原表位,其中有部分抗原表位已被證實能誘導小鼠體內(nèi)細胞免疫和體液免疫���,并且對呼吸道合胞病毒感染具有保護作用����,為呼吸道合胞病毒疫苗的研發(fā)提供了理論依據(jù)�����。
2.4 人類免疫缺陷病毒
人類免疫缺陷病毒(human immunodeficiency virus) 又稱艾滋病病毒���,感染人類免疫缺陷病毒后會引起危害性極大的傳染病──艾滋病(acquired immunedeficiency syndrome,AIDS)��。人類免疫缺陷病毒主要破壞人體自身免疫系統(tǒng),致使人體喪失免疫功能�。人類免疫缺陷病毒感染者進入艾滋病期后會引起各種機會性感染和腫瘤的發(fā)生�,甚至威脅生命��,迄今為止人類免疫缺陷病毒仍然是全球公共衛(wèi)生問題之一[91]�。目前,全世界范圍內(nèi)尚無可以有效預防人類免疫缺陷病毒感染的疫苗上市,且人類免疫缺陷病毒易發(fā)生變異和免疫逃逸���,急需能夠解決以上問題的有效疫苗。
人類免疫缺陷病毒基因組包含3 個結(jié)構基因(gag����、pol 和env)、2 個調(diào)節(jié)基因(tat 和rev)以及4 個輔助基因(vif�����、vpr��、vpu 和nef)[92]���。其中���,Vpr 蛋白具有免疫抑制作用,可以作為治療人類免疫缺陷病毒感染的一個重要靶點[93-96]���。薩巴赫(Sabbah)等[97] 證實了抗Vpr 抗體的免疫原性��,證明Vpr 作為人類免疫缺陷病毒治療靶點的重要意義�,但未能闡明該抗體在Vpr 蛋白上的結(jié)合位點�����。
孫俊等[98] 將人類免疫缺陷病毒數(shù)據(jù)庫中所有中國來源的人類免疫缺陷病毒1 型 B 亞型和CRF07_BC 重組型毒株的Vpr 蛋白序列生成共享序列��,利用多種生物信息學軟件分析和預測Vpr 蛋白共享序列潛在的B 細胞表位��, 確定Vpr 蛋白N 端的第3~19 位氨基酸和C 端的第82~95 位氨基酸為Vpr 蛋白共享序列的B 細胞抗原表位����。分別合成肽段并與載體蛋白血藍蛋白(keyhole limpet hemocyanin,KLH)偶聯(lián)后免疫家兔�����,純化得到Vpr 蛋白多肽特異性抗體��。體外驗證實驗表明�����,該抗體可以識別不同亞型人類免疫缺陷病毒1型的Vpr 蛋白,并且能特異性識別天然狀態(tài)和變性狀態(tài)下的Vpr蛋白��。該研究成功利用反向疫苗學技術制備出具有較好特異性和通用性的Vpr 多肽抗體��,為人類免疫缺陷病毒疫苗的研制提供了理論基礎�。
方塞卡(Fonseca) 等[99]篩選人類免疫缺陷病毒1 型 B 亞型全基因組序列中最保守區(qū)域的CD4+T 細胞表位���, 得到一組多個HLA-DR 結(jié)合的CD4+T 細胞表位����。隨后�,利用32 位人類免疫缺陷病毒1 型感染者的外周血單個核細胞(peripheral blood mononuclear cell,PBMC) 對合成多肽進行識別�, 其中高達91% 患者的PBMC 可識別這些表位,同時該方法還鑒定出大多數(shù)未知的CD4+T 細胞表位���。此外����,這些表位也能被CD8+T 細胞識別�,并且與人類免疫缺陷病毒1型的A、C、D 和F 分離株序列有50% 以上的重合��。該研究利用反向疫苗學技術預測得到的抗原表位�,理論上可覆蓋多種毒株且可能引起跨分支保護,可用作人類免疫缺陷病毒疫苗的候選抗原分子���。
2.5 登革病毒
感染登革病毒(dengue virus)后會引起登革熱(dengue fever�����,DF)�����、登革出血熱(dengue hemorrhagic fever�����,DHF) 和登革休克綜合征(dengue shock syndrome����,DSS)�����。登革病毒含有4 種血清型,感染一種血清型康復后��,對該血清型終身免疫�����,但對其余血清型只有部分短暫的交叉保護�����,若后續(xù)再次感染其他血清型��,可能會引起抗體依賴性增強效應(antibody dependent enhancement�,ADE) 從而導致更加嚴重的臨床表現(xiàn)�����。目前全球范圍內(nèi)已有兩款針對登革病毒的疫苗獲批上市����。第一款是于2015 年獲批的重組四價減毒活疫苗CYD-TDV,該疫苗對接種前已感染者(血清陽性)具有一定的保護效力���,但未感染者(血清陰性)在接種該疫苗后反而增加了患登革熱的風險[100]�����。針對已批準該疫苗上市的國家����,WHO 建議僅對有既往登革病毒感染人群進行接種[101]。第二款是于2022年在印度尼西亞獲批的四價減毒活疫苗TAK-003��,不論先前是否暴露于登革病毒�,在接種該疫苗后的3 年內(nèi),TAK-003 持續(xù)保護接種者避免登革病毒感染����,但保護效果因血清型而異,并隨著時間的推移而下降[102]����。整體來說,目前雖然已有兩款獲批上市的登革病毒疫苗����,但適用范圍、安全性及保護持久性仍待考察����。
登革病毒基因組編碼3 個結(jié)構蛋白(C�、prM 和E) 和7個非結(jié)構蛋白(NS1���、NS2A��、NS2B�����、NS3����、NS4A����、NS4B和NS5)�����。登革病毒E 蛋白上的抗原決定簇可以誘導宿主產(chǎn)生中和抗體和血凝抑制抗體[103]�����,NS1和NS3 蛋白具有免疫原性和免疫反應性[104-105]�。
胡云章團隊[106] 檢索了中國分離的155 株登革病毒(4 個血清型)的NS5 蛋白序列���,利用dbMHC 數(shù)據(jù)庫檢索中國人群HLA Ⅰ類(HLA-A、HLA-B 和HLA-C)等位基因的分布���,分析篩選到116 個與HLA Ⅰ類等位基因相互作用的CD8+T 細胞表位���,利用計算機預測并分析候選表位的抗原性、保守性及種群覆蓋率�。篩選到14 個高度保守表位, 其中NS592-99��、NS5200-210�����、NS5362-369 和NS5514-524 4個表位組合可對我國90% 以上個體進行免疫�����。
曹虹團隊[107] 利用多種生物信息學軟件預測分析了登革病毒1 型夏威夷株E 蛋白Ⅱ區(qū)和登革病毒2 型NGC 株E 蛋白Ⅲ區(qū)的B���、T 細胞表位�,發(fā)現(xiàn)登革病毒1 型ED Ⅱ 281-295 和登革病毒2 型ED Ⅲ 345-359�����、ED Ⅲ 383-397 可能為登革病毒潛在的B、T 細胞表位��。該團隊[108] 后續(xù)在體內(nèi)外均驗證ED Ⅲ 345-359 和ED Ⅲ 383-397具有良好的免疫原性���。并再次利用生物信息學工具設計將篩選到的B��、T 細胞表位(ED Ⅲ 345-359�����、ED Ⅲ 383-397) 和泛DR 表位(PADRE)串聯(lián)構建成一個多表位肽疫苗��,隨后免疫小鼠評價其誘導體液���、細胞免疫應答效果和免疫保護性,體內(nèi)實驗結(jié)果檢測到該多表位肽疫苗誘導小鼠產(chǎn)生了高水平抗體����。
2.6 狂犬病毒
人類因被患病獸抓傷或咬傷而感染狂犬病毒(rabies virus)���,狂犬病毒進入人體后先感染肌細胞����,隨后侵入末梢神經(jīng),最后隨血液擴散至腦干和小腦處神經(jīng)元從而導致疾病�����。感染狂犬病毒后會引起高致死性人畜共患病──狂犬病���,一旦發(fā)病即為100% 死亡�,嚴重威脅到人畜的健康�����。目前對于狂犬病缺乏有效的治療手段�,但可通過疫苗進行預防。現(xiàn)有的狂犬病毒疫苗可以提供一定的保護��,但其存在免疫程序繁瑣���、細胞免疫反應較弱����、抗體水平不持久等問題。
狂犬病毒基因組含5 個ORFs�,編碼5 種結(jié)構蛋白(N、P���、M��、G 和L)�。其中��,G 蛋白和N蛋白是狂犬病毒的主要抗原����,可誘導機體細胞免疫和體液免疫[109-113]。G 蛋白可誘導產(chǎn)生中和抗體和血凝抑制抗體���,N 蛋白可誘導產(chǎn)生補體結(jié)合抗體和沉淀素��。
胡曉波等[114] 利用反向疫苗學技術對狂犬病毒G����、N 蛋白的CTL 細胞和Th 細胞表位進行預測分析����, 選取了4 條針對MHC- Ⅰ類分子的候選多肽,4條針對MHC-Ⅱ類分子的候選多肽���。分別合成多肽后免疫小鼠���,G367-381 和G333-341 均可誘導分泌IL-4 和IFN-γ, 其中G367-381主要誘導分泌IL-4���,G333-341 主要誘導分泌IFN-γ���。G367-381 主要誘導產(chǎn)生以CD4+T 細胞增殖為主的Th 型免疫應答,而G333-341則主要誘導產(chǎn)生以CD8+T 細胞增殖為主的CTL 型免疫應答�����。該研究結(jié)合生物信息學技術和免疫學實驗�����,篩選并驗證了2 條狂犬病毒G 蛋白的多肽�,分別是潛在的Th 表位和CTL 表位。
狂犬病毒P 蛋白不僅可作為分子伴侶促進病毒RNA 的合成����,還可抑制干擾素信號轉(zhuǎn)導[115],是先天免疫反應的關鍵調(diào)控因子。張金陽等[116] 利用生物信息學軟件對狂犬病毒Flury-HEP 株P蛋白的二級結(jié)構進行預測�����,并分析狂犬病毒P 蛋白的表面可及性����、柔性、親水性和抗原性����,最終篩選出11 個潛在的B 細胞抗原表位。再將合成的狂犬病毒P 基因與真核表達載體pCI-neo 連接�����,后轉(zhuǎn)染成神經(jīng)瘤細胞并用狂犬病毒多抗血清進行免疫熒光檢測�,證實其在體外成功表達,并被狂犬病毒標準陽性血清識別�����。該研究中狂犬病毒P 蛋白真核表達驗證了生物信息學分析預測的可靠性����,為進一步狂犬病毒單克隆抗體��、抗病毒活性多肽以及疫苗研制奠定了理論基礎���。
2.7 丙型肝炎病毒
感染丙型肝炎病毒(hepatitis C virus)后會引起急性或慢性肝炎��,甚至發(fā)展為肝硬化和肝細胞癌�。抗病毒藥物可使95% 以上的丙型肝炎感染者得到治愈�����,但若后期再次暴露在高風險環(huán)境中��,會有重新感染的風險[117]�����。因此����,預防性丙型肝炎病毒疫苗對阻斷丙型肝炎病毒傳播十分重要。但由于丙型肝炎病毒基因組具有顯著異源性和高度可變性[117-118]����,基因組各部分的變異程度也并不一致�����,研發(fā)針對某一靶點的疫苗無法起到完全的保護作用�。另外����, 丙型肝炎病毒在體外很難感染和培養(yǎng), 幾乎無法開展減毒和滅活疫苗的研發(fā)工作, 同時缺乏合適的動物模型�, 進一步限制了丙型肝炎病毒疫苗的研發(fā)工作。目前尚無有效的丙型肝炎病毒疫苗問世�。
萬祥輝等[119] 采用單參數(shù)方案, 利用反向疫苗學技術對我國丙型肝炎病毒主要流行基因型1b��、2a 和6a 型的B 細胞����、CTL 細胞和Th 細胞的抗原表位分別進行預測和篩選,設計了一種能有效誘導體液免疫和細胞免疫的多抗原表位串聯(lián)疫苗�����。并利用不同的組合方式聯(lián)合免疫小鼠�����,聯(lián)合免疫和單獨免疫均誘導了小鼠體內(nèi)特異性免疫應答。當效靶比為25 ∶ 1 和50 ∶ 1 時�����,HCV-(CTL+B+Th) 聯(lián)合免疫激活的CTL 活性高于HCVCTL單獨免疫�;HCV-(CTL +B + Th)聯(lián)合免疫誘導小鼠產(chǎn)生分泌IFN-γ 的細胞數(shù)明顯高于HCV-CTL 單獨免疫及HCV-(B + Th)聯(lián)合免疫后產(chǎn)生的細胞數(shù);HCV-(CTL + B + Th)聯(lián)合免疫與HCV-(B + Th)免疫均誘導了強烈的體液免疫�����。體內(nèi)實驗證明����,該研究篩選到的抗原表位可有效誘導小鼠的體液免疫和細胞免疫�����,且持續(xù)保護效果良好����。
皮什拉夫·薩比特(Pishraft Sabet)等[120] 利用多種生物信息學軟件對丙型肝炎病毒HLA-A2限制性表位進行篩選,隨后利用肽結(jié)合建模優(yōu)化了表位排列��,分別設計了丙型肝炎病毒多表位DNA 疫苗和丙型肝炎病毒多肽疫苗�����, 包含CD8+T 細胞、CD4+T細胞����、Th 細胞及B 細胞表位。多肽疫苗免疫小鼠后產(chǎn)生的IgG����、IFN-γ 水平明顯高于多表位DNA 疫苗,而多表位DNA 疫苗可誘導小鼠產(chǎn)生更高的Th1 免疫應答�。該研究利用小鼠模型評價了篩選表位的免疫原性,并且根據(jù)實驗結(jié)果合理預測�����,多表位DNA 疫苗配合強佐劑可能提高疫苗的保護效果���,為進一步優(yōu)化HLA-A2 限制性表位疫苗提供了方案和依據(jù)���。
2.8 埃博拉病毒
埃博拉病毒(Ebola virus)是一種非常罕見的病毒, 是世界上最高級別的病毒之一�, 生物安全等級為4 級, 目前已確定5 個埃博拉病毒亞型�。感染埃博拉病毒后會引起人類和靈長類動物患埃博拉出血熱(Ebola hemorrhagic fever���,EBHF),病死率為50%~90%����。埃博拉病毒僅在個別國家和地區(qū)間歇性流行, 在時空上有一定的局限性�。但為防止更大規(guī)模的傳播流行,采取一定預防措施十分重要����。目前�����,一款實驗性疫苗(rVSV-ZEBoV)僅在2018~2019 年剛果(金)發(fā)生埃博拉疫情期間得到使用�����。
埃博拉病毒基因組編碼7 個結(jié)構蛋白和2 個非結(jié)構蛋白����。其中,糖蛋白�����、核蛋白、基質(zhì)蛋白(VP40)在埃博拉病毒的感染�、增殖和生命周期中發(fā)揮重要作用,是埃博拉病毒疫苗研制的潛在靶點[121-123]����。
陳薇團隊[124] 對EBO-Sudan和EBO-Zaire 株GP 蛋白上小鼠H-2d MHC- Ⅰ 類限制性表位進行預測,再將各生物信息學軟件排名前五的預測結(jié)果進行匯總���,最終選定了12 個多肽����。隨后利用表達埃博拉病毒GP 復制缺陷型腺病毒載體免疫小鼠進行評價��,體內(nèi)實驗結(jié)果表明�����,RPHTPQFLF(EBO-Sudan)��、GPCAGDFAF 和LYDRLASTV(EBO-Zaire)能刺激小鼠脾細胞產(chǎn)生大量的IFN-γ���,這3 個多肽可作為埃博拉病毒GP 上的T細胞表位����,可成為埃博拉病毒疫苗研發(fā)的候選位點。
邦茨( Bounds) 等[125] 對EBO-Sudan 和委內(nèi)瑞拉馬腦炎病毒(Venezuelan equineencephalitis virus) 的NP 和GP 蛋白中HLA- Ⅱ類限制性T細胞表位進行預測����,篩選了44 個表位進行體外結(jié)合分析,其中有21 個多肽與HLA-DR 表位強烈結(jié)合�,最后選取17 個可與小鼠的MHC- Ⅱ類等位基因結(jié)合的表位免疫小鼠。普通小鼠在接種該疫苗后體內(nèi)產(chǎn)生委內(nèi)瑞拉馬腦炎病毒抗體�����,但沒有檢測到埃博拉病毒抗體�;HLA-DR3 轉(zhuǎn)基因小鼠在接種該疫苗后,有4 個多肽產(chǎn)生了明顯的細胞免疫反應��,并產(chǎn)生了埃博拉病毒和委內(nèi)瑞拉馬腦炎病毒抗體����,但隨后的攻毒實驗中發(fā)現(xiàn)該候選疫苗并不具備保護效果���。
3�、 在寄生蟲疫苗研發(fā)中的應用
3.1 瘧原蟲
瘧原蟲是通過按蚊叮咬進行傳播,寄生于人類的瘧原蟲有4種�����,分別是惡性瘧原蟲���、間日瘧原蟲����、三日瘧原蟲和卵形瘧原蟲�����,感染后分別引起惡性瘧��、間日瘧����、三日瘧和卵形瘧。惡性瘧可發(fā)展為嚴重疾病�����, 甚至死亡�����。2021年10 月,WHO 建議生活在惡性瘧原蟲中高度傳播地區(qū)的兒童使用RTS�����,S/AS01 瘧疾疫苗[126]�,但該疫苗伴有嚴重的不良反應(24.2%~28.4%)[127]。目前還沒有一種有效的人類瘧疾疫苗為瘧疾流行地區(qū)人口提供保護���。
惡性瘧原蟲編碼的多肽家族(RIFIN)�����、亞端粒變異開放閱讀框(STEVOR)和惡性瘧原蟲紅細胞膜蛋白1(PfEMP1)分別存在于寄生蟲感染紅細胞的表面[128]��。
普里塔姆(Pritam) 等[129]對瘧原蟲基因組中保守的5 種同源抗原進行抗原表位預測����,篩選到82 個連續(xù)B 細胞表位���,這些連續(xù)B 細胞表位共包含433個T 細胞表位, 其中有142個HLA- Ⅰ 類表位和291 個HLA- Ⅱ類表位����。根據(jù)不同的佐劑和連接子組合篩選到的表位集合��,共設計了15 個多肽疫苗����。利用軟件預測了15 個多肽疫苗的三級結(jié)構����, 并利用ClusPro2.0對該多肽疫苗與受體分子TLR2和TLR4 的對接進行模擬,結(jié)果顯示有12 個多肽疫苗能與受體分子對接����。接著利用VaxiJen、ANTIGENPro 和Secret-AAR等工具預測到有2 個肽段具有誘導體液和細胞免疫反應的能力���。但該研究需要進一步體內(nèi)外實驗進行驗證�����,以評估多肽疫苗的有效性�。
馬哈拉杰(Maharaj)等[130]利用生物信息學軟件對惡性瘧原蟲共751 條序列進行初步篩選����,對48 個滿足抗原性的序列進行進一步抗原表位篩選���,最初篩選到77 個CD8+T 細胞表位、177個CD4+T 細胞表位����。經(jīng)過致敏性等性質(zhì)評估,最終保留10 個CD8+T 細胞表位�����、12 個CD4+T細胞表位和1 個B 細胞表位���。經(jīng)過計算機模擬可知����,這些表位均可與相應的HLA 等位基因結(jié)合����,并且能與TLR4形成穩(wěn)定的結(jié)合物。
3.2 血吸蟲
人體一般通過皮膚接觸含尾蚴的水而感染血吸蟲�,感染后會引起血吸蟲病。該疾病導致的殘疾病例多于死亡病例����,對經(jīng)濟發(fā)展造成嚴重影響。據(jù)WHO 估計�����,2019 年至少有2.366 億人需要獲得血吸蟲病預防性治療[131]����。目前,預防性治療血吸蟲病的措施是對目標群體進行吡喹酮治療��,但沒有適合學齡前兒童的吡喹酮配方�����,且吡喹酮可得性有限��,極大影響了血吸蟲病防控工作��。同時��,目前尚無可用于預防血吸蟲病的疫苗�。
拉赫瑪尼(Rahmani)等[132]選擇了曼氏血吸蟲不同株間保守的7 種蛋白作為候選抗原,預測到12 個CTL 表位�����、14 個針對MHC- Ⅱ等位基因的HTL 表位,隨后構建了一個含有617 個氨基酸的嵌合疫苗��。利用Mfold 對候選序列的mRNA 二級結(jié)構進行預測�����,結(jié)果顯示該mRNA 具有較好的穩(wěn)定性����。并且MD 建模結(jié)果表明,該候選疫苗能與TLR4 產(chǎn)生良好的相互作用�����,具有誘導T 細胞和B 細胞免疫應答的潛力�����。
桑奇斯(Sanches) 等[133]以曼氏血吸蟲的跨膜蛋白為目標����,利用生物信息學工具對584 個序列進行篩選,將候選抗原減少到37 個質(zhì)膜蛋白�����,并設計了兩組抗原表位,一組為CTL 與B 細胞重疊表位�, 另一組為HTL 與B細胞重疊表位,經(jīng)過抗原性分析后最終確定了19 個表位作為疫苗的組成�。經(jīng)過計算機模擬預測得知��,該MEV 具有誘導持久體液免疫和細胞免疫的潛力����,并能與細胞表面受體TLR4 穩(wěn)定結(jié)合。
3.3 利什曼原蟲
利什曼原蟲通過沙蠅為媒介進行傳播���,感染后會引起人畜共患病——利什曼病�,其中最嚴重的為黑熱病��,患病后若不進行治療會導致超過95% 的死亡率����。據(jù)估計,全球每年有70 萬~100 萬利什曼病新發(fā)病例出現(xiàn)[134]��。目前�,尚缺乏安全有效的利什曼病疫苗。
德布里托(De Brito)等[135]將嬰兒利什曼原蟲9 種已知具有免疫原性的蛋白作為候選抗原����, 利用多種生物信息學軟件預測了候選抗原中MHC-Ⅰ�����、MHC-Ⅱ 類表位��, 并根據(jù)這些表位對人類和小鼠MHC 等位基因的親和力確定了12 個候選表位��,構建2 種嵌合體疫苗����。利用RaptorX 進行預測發(fā)現(xiàn)����,這2 種嵌合體分別能與TLR3 和TLR4相結(jié)合,并能觸發(fā)免疫反應�。嵌合體免疫小鼠后可以誘導小鼠體內(nèi)多功能T 細胞增殖并產(chǎn)生IFN-γ 和IFN-α, 還能誘導T淋巴細胞的記憶效應����,降低小鼠脾臟中的寄生蟲載量。
塞西爾(Cec í lio)等[136] 將疫苗設計策略轉(zhuǎn)向傳播媒介沙蠅�����,選取2 種具有免疫原性潛力的沙蠅唾液蛋白PdSP15 和LJL143組成融合蛋白,使宿主產(chǎn)生抗媒介唾液免疫反應���。利用反向疫苗學技術對融合蛋白進行CD4+T����、CD8+T 細胞表位預測����, 并結(jié)合人和小鼠MHC-Ⅰ�、MHC-Ⅱ等位基因進行篩選,設計了一種DNA 疫苗��。該疫苗免疫小鼠后可誘導小鼠體內(nèi)T 細胞增殖��,驗證了融合蛋白的免疫原性�����。
3.4 隱孢子蟲
隱孢子蟲是一類體積微小的球蟲類寄生蟲���,廣泛存在于脊椎動物體內(nèi)�����,感染后引起以腹瀉為主要臨床表現(xiàn)的人畜共患病——隱孢子蟲病����。免疫功能低下患者病情會相對嚴重,甚至威脅生命�。
潘達(Panda) 等[137] 采用比較基因組學和免疫信息學預測篩選到7 個可通過阻斷酶活性而抑制病原體的蛋白質(zhì), 其中cgd3_1400 作為疫苗候選蛋白��,利用ABCpred 和CTLpred 預測到疫苗候選蛋白上存在3 個B細胞表位和3 個CTL 表位��, 并利用ClusPro 預測了候選表位與MHC-Ⅰ��、MHC-Ⅱ 類等位基因?qū)咏Y(jié)果���。該研究結(jié)果為有效應對隱孢子蟲病提供了疫苗候選分子�����。
哈桑(Hasan) 等[138] 利用生物信息學軟件在6 種隱孢子蟲蛋白中篩選到13 個MHC-Ⅰ類特異性CTL 表位���,6 個HTL 表位和6 個B 細胞表位,并構建一種MEV��。通過軟件模擬分析可知,該疫苗具有穩(wěn)定的結(jié)構��,并且與TLR2 形成穩(wěn)定的復合物����,能在體內(nèi)引起明顯的免疫反應。
4����、 展望
反向疫苗學技術的高速發(fā)展得益于相關技術的進步。隨著測序技術的迭代更新����,流行株的全基因組序列信息可在短時間內(nèi)獲取�����,病原體基因組信息庫得到不斷擴容和豐富�,目前已有上百種病原體全基因組信息被全面解析。泛基因組學和比較基因組學的發(fā)展�,幫助我們快速了解病原體流行株抗原突變的信息和趨勢,篩選新的抗原分子或優(yōu)化已有的疫苗分子序列��,以獲得更有效的針對性疫苗和通用疫苗�����。不僅如此,越來越多的新型技術應用于反向疫苗學技術�����,可補充和完善疫苗設計過程中的缺陷和不足���,最終設計或改良出更加高效安全的新型疫苗���。
反向疫苗學技術作為新型疫苗研發(fā)工具,其發(fā)展時間相對短暫�����,本身還存在著一些不足之處����。但是,目前已通過反向疫苗學技術針對B 群腦膜炎球菌����、呼吸道合胞病毒、人類免疫缺陷病毒�����、新型冠狀病毒和多種寄生蟲等病原體,篩選出候選疫苗分子����。其中,針對B 群腦膜炎球菌的二價rLP2086(Trumenba®) 和4CMenB(Bexsero®)疫苗已完成臨床學階段研究�,并獲批上市。反向疫苗學技術的迅猛發(fā)展��,在未來能夠不斷攻克復雜病原體的檢測和防疫難點���,為人類健康事業(yè)保駕護航�����,為全球公共衛(wèi)生事業(yè)貢獻一份力量。