摘 要 Abstract
合規(guī)風(fēng)險是啟動藥品注冊核查考慮的重要因素����。本文對啟動注冊核查的合規(guī)風(fēng)險因素及申辦者合規(guī)管理進行了探討,并提出第三方專業(yè)機構(gòu)參與藥品研發(fā)全生命周期合規(guī)管理的建議,以期為申辦者�����、研究機構(gòu)��、外包服務(wù)機構(gòu)等研發(fā)生產(chǎn)主體應(yīng)對基于風(fēng)險的注冊核查合規(guī)管理提供借鑒�����。
Compliance risk is an important triggering factor in initiating drug registration inspection. This paper discussed the compliance risk factors of starting registration inspection and the compliance management of sponsors, and proposed that the third-party professional institutions should participate in the compliance management of the whole life cycle of drug research and development, expected to provide reference for sponsors, research institutions, outsourcing service agencies and other R&D and production bodies to cope with the risk-based registration inspection compliance management.
2022 年1 月1 日起實施的《藥品注冊核查檢驗啟動工作程序(試行)》(以下簡稱《啟動工作程序》)對參與藥學(xué)研制�����、藥理毒理學(xué)研究��、臨床試驗以及生產(chǎn)制造的相關(guān)單位和機構(gòu)��,即“全鏈條”研發(fā)生產(chǎn)主體及藥品研發(fā)“全生命周期”合規(guī)風(fēng)險提出核查要求����,明確了啟動注冊核查的對象、啟動注冊核查的風(fēng)險考慮因素��、核查原則和程序等問題����?����!秵庸ぷ鞒绦颉返膶嵤?yīng)當(dāng)引起申辦者��、研究機構(gòu)�����、外包服務(wù)機構(gòu)等研發(fā)生產(chǎn)主體的高度重視�����。“研發(fā)生產(chǎn)主體”“風(fēng)險因素”“重大不合規(guī)”“質(zhì)量管理體系”“有因檢查”等監(jiān)管概念構(gòu)成了藥品注冊核查啟動及持續(xù)監(jiān)管的基本框架��。
一�����、注冊核查概述
《藥品注冊管理辦法》第四十五條規(guī)定,藥品注冊核查是指為核實申報資料的真實性����、一致性以及藥品上市商業(yè)化生產(chǎn)條件����,檢查藥品研制的合規(guī)性�����、數(shù)據(jù)可靠性等��,對研制現(xiàn)場和生產(chǎn)現(xiàn)場開展的核查活動��,以及必要時對藥品注冊申請所涉及的化學(xué)原料藥����、輔料及直接接觸藥品的包裝材料和容器生產(chǎn)企業(yè)、供應(yīng)商或者其他受托機構(gòu)開展的延伸檢查活動��。藥品注冊核查的范圍包括藥品上市許可申請����,涉及藥品生產(chǎn)過程中處方工藝或生產(chǎn)批量重大變更,或者新增臨床試驗數(shù)據(jù)等補充申請����。
注冊核查對象為藥品研發(fā)生產(chǎn)主體。根據(jù)《啟動工作程序》及相關(guān)配套文件規(guī)定����,研發(fā)生產(chǎn)主體包括參與藥學(xué)研制�����、藥理毒理學(xué)研究����、臨床試驗以及生產(chǎn)制造的相關(guān)單位和機構(gòu)�����,覆蓋范圍廣泛����,見表1。
啟動注冊核查考慮的風(fēng)險因素包括品種因素和研發(fā)生產(chǎn)主體合規(guī)因素��。本文主要討論研發(fā)生產(chǎn)主體合規(guī)因素��,包括研發(fā)生產(chǎn)主體風(fēng)險等級��、既往接受核查情況及重大不合規(guī)問題等��。同時,因?qū)徳u過程中發(fā)現(xiàn)申報資料真實性存疑或者有明確線索舉報的��,監(jiān)管部門可根據(jù)需要對藥品注冊申請啟動有因檢查����。
對于因合規(guī)因素啟動的注冊核查����,主要包括藥品研制現(xiàn)場核查和藥品生產(chǎn)現(xiàn)場核查。在藥品研制現(xiàn)場核查中����,國家藥品監(jiān)督管理局食品藥品審核查驗中心(以下簡稱藥品核查中心)通過對藥品研制合規(guī)性、數(shù)據(jù)可靠性進行檢查����,對藥品注冊申請的研制情況進行核實,對原始記錄和數(shù)據(jù)進行審查����,以確認申報資料真實性、一致性等����。在藥品生產(chǎn)現(xiàn)場核查中,藥品核查中心通過對申報品種的數(shù)據(jù)可靠性進行實地核查�����,以核實申報資料的真實性及商業(yè)化生產(chǎn)規(guī)模下相關(guān)生產(chǎn)和質(zhì)量控制活動與申報資料的一致性等。
合規(guī)因素風(fēng)險等級分為高風(fēng)險�����、中風(fēng)險和低風(fēng)險��。合規(guī)因素高風(fēng)險主要包括真實性問題����、賄賂問題、僅用于中國注冊的生物等效性(BE)試驗由境外機構(gòu)完成��、藥品生產(chǎn)企業(yè)尚無同劑型品種上市��、藥品生產(chǎn)企業(yè)和關(guān)鍵臨床試驗數(shù)據(jù)研究機構(gòu)近3 年內(nèi)未接受過國內(nèi)外監(jiān)管機構(gòu)注冊核查����。合規(guī)因素中風(fēng)險主要包括研發(fā)生產(chǎn)主體間的利益關(guān)系。對高風(fēng)險等級的藥品注冊申請按照100% 的比例啟動注冊核查�����,對中風(fēng)險等級的藥品注冊申請按照20%~40% 的比例啟動注冊核查,對低風(fēng)險等級的藥品注冊申請按照10%~20% 的比例啟動注冊核查�����。
對于注冊核查結(jié)論明確的��,國家藥品監(jiān)督管理局藥品審評中心(以下簡稱藥品審評中心)予以接收��。對于注冊核查結(jié)論不明確的�����,藥品審評中心與藥品核查中心溝通�����,待注冊核查結(jié)論明確后予以接收��。注冊核查發(fā)現(xiàn)的申請人和(或)被核查單位的問題��,可作為藥品核查中心后續(xù)判斷注冊核查風(fēng)險����、確定核查組織模式和方法及核查地點的重要依據(jù)��,也可作為藥品審評中心后續(xù)啟動注冊核查合規(guī)因素劃分的依據(jù)。
二��、合規(guī)風(fēng)險因素
(一)利益輸送
《啟動工作程序》規(guī)定申辦者與臨床試驗項目研究機構(gòu)之間�����,或臨床試驗項目研究機構(gòu)之間存在相關(guān)“利益關(guān)系”是合規(guī)中風(fēng)險因素[1]����。《啟動工作程序》未明確“利益關(guān)系”的定義��?�!蛾P(guān)于加強藥品審評審批信息保密管理的實施細則》將“利益關(guān)系”主要界定為投資��、持股及謀取不正當(dāng)利益��,由于該法規(guī)僅適用于審評審批工作人員與醫(yī)藥企業(yè)的“利益關(guān)系”�����,可能無法涵蓋《啟動工作程序》中“利益關(guān)系”的完整范疇����。根據(jù)公司治理和上市相關(guān)規(guī)則����,存在利益關(guān)系的相關(guān)方還應(yīng)包括客戶��、供應(yīng)商��、債務(wù)人��、債權(quán)人����、實際控制人��、創(chuàng)始人等��。
中國臨床研究能力提升與受試者保護高峰論壇(CCHRPP)發(fā)布的《臨床研究利益沖突管理共識(試行版)》中將“利益沖突”界定為兩種表現(xiàn)形式�����,一種是經(jīng)濟利益沖突��,另一種是其他利益沖突����。經(jīng)濟利益沖突主要表現(xiàn)為:相關(guān)人員及其直系親屬在申辦者(包括受托CRO)擁有股份或擔(dān)任高級職務(wù)以及從申辦者獲得顧問費��、專家咨詢費����、禮品��、宴請及旅游等各種費用����;相關(guān)人員及其直系親屬擁有研究相關(guān)知識產(chǎn)權(quán),包括但不限于專利�����、商標(biāo)��、版權(quán)或轉(zhuǎn)讓協(xié)議等�����。其他利益沖突指經(jīng)濟利益以外的利益沖突�����,如申請基金課題����、獲得榮譽或獎項��、擴大聲望與影響力等造成的利益沖突����;學(xué)術(shù)會議贊助��、資助發(fā)表論文����、彼此間存在競爭關(guān)系也會產(chǎn)生利益沖突等[2]。
為避免因“利益關(guān)系”風(fēng)險因素而啟動注冊核查����,申辦者應(yīng)在臨床試驗啟動前就相關(guān)方之間的“利益關(guān)系”開展專項盡職調(diào)查����,并要求相關(guān)機構(gòu)在與申辦者簽署的合同中承諾不存在利益關(guān)系及相關(guān)約束機制。一旦發(fā)生因未披露的“利益關(guān)系”導(dǎo)致的風(fēng)險��,申辦者可向責(zé)任方主張解除合同����、損害賠償?shù)妊a救措施�����。
(二)重大不合規(guī)問題
《啟動工作程序》具體規(guī)定了5 種類型的重大不合規(guī)問題�����。此外��,藥品審評中心在臨床試驗和藥學(xué)研制與生產(chǎn)中重點關(guān)注的重大不合規(guī)問題還包括質(zhì)量管理體系(QMS)是否合規(guī)��,受試者的權(quán)益是否得到保障�����,臨床試驗或研發(fā)數(shù)據(jù)的真實性��、可靠性及完整性是否存在問題�����,法規(guī)依從性是否有保證等����。關(guān)于質(zhì)量管理體系的合規(guī)性�����,可從臨床試驗及藥品生產(chǎn)兩個角度考量,本文主要探討臨床試驗和藥品生產(chǎn)QMS關(guān)注的合規(guī)問題�����。
1. 臨床試驗質(zhì)量管理不合規(guī)
申辦者是臨床試驗數(shù)據(jù)質(zhì)量和可靠性的最終責(zé)任人����,因此,申辦者應(yīng)履行管理職責(zé)�����,建立研究和管理團隊����,對臨床試驗全過程實施質(zhì)量管理����。臨床試驗質(zhì)量管理體系應(yīng)覆蓋臨床試驗全過程,包括試驗設(shè)計��、實施��、記錄、評估�����、報告和文件歸檔����,重點是受試者保護、試驗結(jié)果可靠及相關(guān)操作合規(guī)��。在臨床試驗質(zhì)量管理中�����,常見的不合規(guī)問題包括:①一般的方案違背和(或)未上報倫理�����;②臨床試驗記錄不符合邏輯����;③臨床試驗用藥品未在醫(yī)院信息系統(tǒng)(HIS)體現(xiàn);④倫理審查記錄不完整����、不準(zhǔn)確或未及時遞交倫理審查�����,倫理委員會未對項目修訂方案及知情同意書審查��;⑤臨床試驗生物樣本等記錄不規(guī)范或不完善�����;⑥試驗方案執(zhí)行(分工任務(wù)等)由未經(jīng)主要研究者授權(quán)的人員執(zhí)行�����;⑦試驗用藥品部分原始記錄不完整����,規(guī)范不準(zhǔn)確或缺失��;⑧不良事件(AE)判斷不合理��、描述不規(guī)范��、記錄不及時����;⑨臨床試驗原始記錄不完整、不規(guī)范或不準(zhǔn)確等[3]��。
2. 藥品生產(chǎn)質(zhì)量管理不合規(guī)
藥品生產(chǎn)質(zhì)量管理體系應(yīng)涵蓋影響藥品質(zhì)量的所有因素��,確保所生產(chǎn)的產(chǎn)品符合申報工藝和質(zhì)量要求����,并最大限度地降低藥品生產(chǎn)過程中污染、交叉污染以及混淆����、差錯等風(fēng)險。在藥品生產(chǎn)質(zhì)量管理中��,常見的不合規(guī)問題包括:①存在嚴重偏離《藥品生產(chǎn)質(zhì)量管理規(guī)范》等相關(guān)法律法規(guī)����,以及可能對產(chǎn)品質(zhì)量帶來嚴重風(fēng)險或者對使用者造成危害的情形;②編造生產(chǎn)�����、檢驗記錄和數(shù)據(jù)��;③隱瞞記錄和數(shù)據(jù),無合理解釋地棄用記錄和數(shù)據(jù)�����,或以其他方式選擇性使用記錄和數(shù)據(jù)導(dǎo)致對藥品質(zhì)量評價產(chǎn)生影響����;④故意損毀、隱匿記錄和數(shù)據(jù)或者其存儲介質(zhì)等破壞記錄和數(shù)據(jù)真實性的情形����;⑤無法證明能按照申報的上市商業(yè)化生產(chǎn)條件實現(xiàn)持續(xù)穩(wěn)定生產(chǎn);⑥存在嚴重的數(shù)據(jù)可靠性問題�����,關(guān)鍵數(shù)據(jù)和記錄無法溯源�����,導(dǎo)致對藥品質(zhì)量的評價產(chǎn)生影響等[4]�����。
三��、有因檢查
《啟動工作程序》第二十九條規(guī)定,審評過程中發(fā)現(xiàn)申報資料真實性存疑或者有明確線索舉報等����,需要現(xiàn)場核實的��,應(yīng)按相關(guān)程序?qū)λ幤纷陨暾垎佑幸驒z查[1]����。
1. 真實性問題
真實性問題可啟動核查程序。所謂真實性問題�����,包括但不限于編造或者無合理解釋地修改相關(guān)信息和數(shù)據(jù)�����,隱瞞相關(guān)記錄和數(shù)據(jù)����、無合理解釋地棄用記錄和數(shù)據(jù)或以其他方式選擇性使用記錄和數(shù)據(jù),故意損毀��、隱匿記錄和數(shù)據(jù)����,關(guān)鍵數(shù)據(jù)和記錄無法溯源�����,申報資料與原始記錄不一致且影響結(jié)果評價等[5]�����。
2. 舉報
有明確線索的舉報亦可啟動核查程序��。申辦者應(yīng)重點關(guān)注臨床前及臨床試驗開展過程中的合規(guī)問題����,盡可能降低來自內(nèi)部或外部的舉報風(fēng)險����,相關(guān)合規(guī)問題包括但不限于:①試驗用藥品(如試驗用藥品的供應(yīng)、存儲��、回收�����、銷毀����、服用依從性��、生產(chǎn)�����、包裝、標(biāo)簽等合規(guī))��。②知情同意(如知情同意書合規(guī)�����,或知情同意程序合規(guī))��。③倫理委員會(如缺少倫理委員會意見�����、倫理委員會遞交程序合規(guī)��、倫理委員會組成合規(guī))��。④受試者保護(如試驗設(shè)計����,個人數(shù)據(jù)保護����,受試者安全和權(quán)益保障�����,受試者保險�����、補償��、賠償�����,受試者付款等合規(guī))��。⑤監(jiān)管(如缺少合規(guī)的監(jiān)管部門批準(zhǔn)文件�����、監(jiān)管部門溝通和應(yīng)對程序等)�����。⑥臨床試驗管理[ 如方案、病例報告表(CRF)��、日記卡��、調(diào)查問卷設(shè)計的合規(guī)��,數(shù)據(jù)管理����、監(jiān)查��、稽查����、文件控制、統(tǒng)計分析��、臨床試驗報告合規(guī)等]�����。⑦臨床試驗機構(gòu)(如方案依從性����,包括入排標(biāo)準(zhǔn)����、安全性報告�����、CRF 和日記卡合規(guī)等)�����。⑧其他方面[ 如組織和人員����、設(shè)施和設(shè)備、資格和培訓(xùn)����、標(biāo)準(zhǔn)操作規(guī)程(SOP)、源文件����、臨床試驗合同等合規(guī)]。
臨床試驗涉及眾多參與方,包括申辦者����、醫(yī)療機構(gòu)、研究者����、受試者、CRO����、SMO、第三方檢測機構(gòu)����、保險公司�����、招募機構(gòu)等�����。申辦者是臨床試驗的最終責(zé)任人����,但臨床試驗各參與方的合規(guī)問題也會影響臨床試驗的合規(guī)�����,為此�����,筆者建議申辦者在臨床試驗項目啟動前對相關(guān)供應(yīng)商開展合規(guī)盡職調(diào)查��,完善申辦者與第三方簽署的合同��,并有效開展供應(yīng)商“全鏈條”和“全生命周期”合規(guī)管理����,盡最大可能防患于未然����。
四、風(fēng)險等級動態(tài)調(diào)整和合規(guī)整改
1. 風(fēng)險等級的動態(tài)調(diào)整
合規(guī)因素風(fēng)險等級并非固定不變����,而是根據(jù)后續(xù)注冊核查情況適時調(diào)整。其中��,風(fēng)險等級升高的情形為:既往注冊核查過程中發(fā)現(xiàn)存在重大不合規(guī)問題,且經(jīng)后續(xù)注冊核查發(fā)現(xiàn)相關(guān)問題仍存在的��,合規(guī)因素風(fēng)險升級為高風(fēng)險�����。風(fēng)險等級降低的情形為:高風(fēng)險后續(xù)經(jīng)過連續(xù)兩次注冊核查�����,核查結(jié)論均為通過且未發(fā)現(xiàn)重大不合規(guī)問題的��,降級為中風(fēng)險����;中風(fēng)險后續(xù)經(jīng)過連續(xù)兩次注冊核查,核查結(jié)論均為通過且未發(fā)現(xiàn)重大不合規(guī)問題的����,降級為低風(fēng)險��。風(fēng)險等級不調(diào)整的情形為:研發(fā)生產(chǎn)主體間存在利益關(guān)系的�����,風(fēng)險等級為中風(fēng)險且風(fēng)險等級不調(diào)整;僅供中國注冊的BE由境外醫(yī)療機構(gòu)完成��,相關(guān)醫(yī)療機構(gòu)風(fēng)險等級為高風(fēng)險且不調(diào)整�����;對于發(fā)現(xiàn)存在真實性問題����、賄賂問題,自查實之日起五年內(nèi)高風(fēng)險等級不調(diào)整�����。
對于上述存在一定“劣跡”的研發(fā)生產(chǎn)主體��,需特別關(guān)注后續(xù)注冊核查��、檢查的合規(guī)管理及合規(guī)體系的建設(shè)��。
2. 合規(guī)整改
存在合規(guī)問題的研發(fā)生產(chǎn)主體��,藥品審評中心給予整改的機會��。若整改后研發(fā)生產(chǎn)主體能夠解決相關(guān)合規(guī)問題的�����,則降低合規(guī)風(fēng)險等級;不整改或整改后仍存在相關(guān)合規(guī)問題的�����,提高或不調(diào)整合規(guī)風(fēng)險等級�����。有鑒于此�����,研發(fā)生產(chǎn)主體應(yīng)梳理既往接受核查情況�����、與各研發(fā)生產(chǎn)主體間是否存在利益關(guān)系及是否存在重大不合規(guī)問題����,按照梳理情況進行相應(yīng)整改,并建立健全覆蓋非臨床研究��、臨床試驗��、生產(chǎn)經(jīng)營����、上市后研究、不良反應(yīng)監(jiān)測及報告的藥品全生命周期的合規(guī)管理體系�����。
五�����、申辦者合規(guī)管理
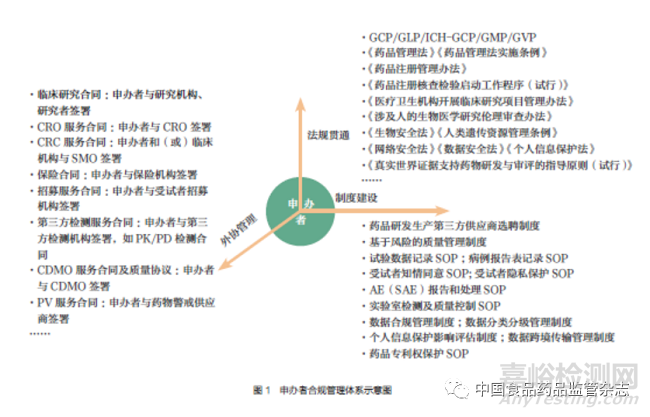
申辦者可將臨床試驗部分或全部工作委托給CRO 或根據(jù)需要聘請其他研發(fā)生產(chǎn)主體參與藥品研發(fā)��。若受托研發(fā)生產(chǎn)主體自身受到有因檢查或發(fā)生重大不合規(guī)問題以及其他不合規(guī)因素而觸發(fā)注冊核查��,由于申辦者是臨床試驗數(shù)據(jù)質(zhì)量和可靠性的最終責(zé)任人��,除申辦者的藥品注冊申請將受影響外����,申辦者自身合規(guī)情況也可能受到挑戰(zhàn)和質(zhì)疑。若申辦者對其他研發(fā)生產(chǎn)主體盡到合規(guī)管理責(zé)任后(如盡職調(diào)查��、持續(xù)監(jiān)督管理等)�����,申辦者能否降低因其他研發(fā)生產(chǎn)主體不合規(guī)對自身產(chǎn)生的不利影響是值得思考的。同時����,若申辦者注冊核查未能通過或發(fā)現(xiàn)其他重大不合規(guī)問題的,可能進一步導(dǎo)致申辦者其他藥品注冊申請的合規(guī)風(fēng)險因素升高����。鑒于此,申辦者應(yīng)積極履行管理職責(zé)�����,建立研究和管理團隊����,對研發(fā)生產(chǎn)“全鏈條”和藥品研發(fā)“全生命周期”實施合規(guī)管理,并建立完善的合規(guī)管理體系����,筆者建議申辦者可基于圖1 所示建立合規(guī)管理體系。
1. 法規(guī)貫通
《藥品管理法》《藥品注冊管理辦法》《藥物臨床試驗質(zhì)量管理規(guī)范》《藥物非臨床研究質(zhì)量管理規(guī)范》《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂)》等法規(guī)是我國藥品研發(fā)監(jiān)管的主要依據(jù)�����,除此之外,立法和監(jiān)管部門還就研究機構(gòu)�����、倫理審查����、數(shù)據(jù)核查����、藥物警戒、藥品生產(chǎn)�����、數(shù)據(jù)安全��、人類遺傳資源管理等發(fā)布了相關(guān)法律法規(guī)和規(guī)范性文件�����,并開展基于風(fēng)險的現(xiàn)場核查�����。因此,申辦者應(yīng)全面了解監(jiān)管法規(guī)動態(tài)和現(xiàn)場核查要求����,及時調(diào)整合規(guī)管理體系,嚴格依法開展藥品研發(fā)活動��。
2. 外協(xié)管理
申辦者應(yīng)建立第三方服務(wù)機構(gòu)篩選��、合同管理等合規(guī)制度����,對第三方服務(wù)機構(gòu)進行盡職調(diào)查,了解第三方服務(wù)機構(gòu)既往接受注冊核查情況��;選擇合格的第三方服務(wù)機構(gòu)并與其簽署權(quán)責(zé)明確的合同����,在合同中明確相關(guān)的違約責(zé)任和監(jiān)督管理要求等;建立第三方供應(yīng)商監(jiān)督管理制度�����,加強對第三方服務(wù)機構(gòu)外包工作的監(jiān)督管理����。
3. 制度建設(shè)
為規(guī)范藥品研發(fā)活動合規(guī)開展����,申辦者可在企業(yè)內(nèi)部建立相關(guān)的內(nèi)控制度��,并嚴格要求各參與方在藥品研發(fā)全生命周期活動中遵守相關(guān)的內(nèi)控要求�����。
六�����、第三方專業(yè)機構(gòu)合規(guī)管理
申辦者作為臨床試驗數(shù)據(jù)質(zhì)量和可靠性的最終責(zé)任人�����,應(yīng)充分理解注冊核查合規(guī)風(fēng)險�����,提前把關(guān)研發(fā)生產(chǎn)主體合規(guī)風(fēng)險因素�����,選擇合適的臨床試驗參與方并對其進行合規(guī)監(jiān)督管理����,積極開展合規(guī)培訓(xùn),構(gòu)建基于風(fēng)險的合規(guī)管理體系��?���?紤]到申辦者臨床研究供應(yīng)商管理可能存在流于形式、合規(guī)部門不熟悉臨床試驗GCP合規(guī)�����、臨床質(zhì)量管理依賴CRO但CRO 對合規(guī)管理沒有實質(zhì)性約束義務(wù)和擔(dān)當(dāng)?shù)惹闆r����。筆者建議申辦者可以嘗試引入專業(yè)的第三方臨床合規(guī)管理機構(gòu),一方面�����,能夠協(xié)助申辦者提升臨床合規(guī)管理水平并構(gòu)建契合特定臨床研究需要的合規(guī)管理體系�����;另一方面,也為監(jiān)管機構(gòu)評估申辦者合規(guī)風(fēng)險及確認申辦者落實臨床研究合規(guī)要求提供有效依據(jù)和保障�����。