生物制藥市場(chǎng)正在迅速增長(zhǎng)����,預(yù)計(jì)在2018年至2024年之間,復(fù)合年增長(zhǎng)率為8.6%���,到2024年將達(dá)到3,900億美元���。單克隆抗體(mAB)是市場(chǎng)上的主要蛋白質(zhì)類型藥物,占總市場(chǎng)的四分之一��。單克隆抗體領(lǐng)域始于30年前����,批準(zhǔn)了用于預(yù)防腎臟移植排斥反應(yīng)的Orthoclone OKT3����,此后���,每年都有三到五種基于單抗的新產(chǎn)品獲批����。目前�,藥品市場(chǎng)以生產(chǎn)生物仿制藥為導(dǎo)向,預(yù)計(jì)蛋白質(zhì)藥物的數(shù)量將進(jìn)一步增長(zhǎng)��。生物大分子分子量大且不穩(wěn)定����,通常采用腸胃外給藥。蛋白質(zhì)的穩(wěn)定性是生物制藥設(shè)計(jì)和開(kāi)發(fā)的主要出發(fā)點(diǎn)����。凍干是制造穩(wěn)定的生物制藥產(chǎn)品的首選方法,目前50%的生物藥采用凍干制劑從而保證其使用穩(wěn)定性���。由于生物藥的復(fù)雜性和敏感性����,通常加入藥物特異性輔料來(lái)優(yōu)化凍干過(guò)程,以使其生物活性成分穩(wěn)定����。例如,皮下注射治療性蛋白藥物由于粘度高導(dǎo)致可注射性降低和復(fù)溶時(shí)間增長(zhǎng)��,需要加入降粘劑��,以降低溶液粘度��。
一�、生物制劑處方穩(wěn)定性
溶液中的蛋白質(zhì)通常不穩(wěn)定����,凍干是實(shí)現(xiàn)穩(wěn)定生物制藥配方的主要方法,但受凍干條件影響��,蛋白質(zhì)分子可能會(huì)不穩(wěn)定�����?;瘜W(xué)不穩(wěn)定性會(huì)導(dǎo)致肽共價(jià)鍵的形成或破壞,從而產(chǎn)生新的化學(xué)體�����。常見(jiàn)的過(guò)程包括氧化、脫酰胺和異構(gòu)化�。脫酰胺容易發(fā)生在中性和堿性pH值下,堿性條件下的脫酰胺比例是酸性條件下的三倍����。異構(gòu)化通常發(fā)生在中性或酸性條件下,可能導(dǎo)致蛋白分子的親和力降低�����。物理不穩(wěn)定會(huì)導(dǎo)致蛋白質(zhì)變性和聚集�,影響物理穩(wěn)定性的因素包括 pH 值、溫度��、離子強(qiáng)度����、凍融、蛋白質(zhì)濃度和機(jī)械應(yīng)力�。糖、聚合物�、表面活性劑、多元醇和氨基酸等輔料對(duì)于在凍干和儲(chǔ)存期間穩(wěn)定生物蛋白制劑至關(guān)重要,但由于腸外制劑的監(jiān)管要求��,其選擇十分有限���。
二���、凍干過(guò)程
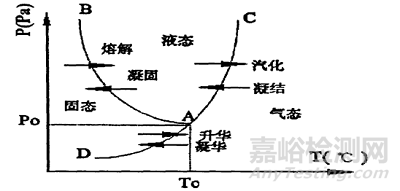
凍干是在冷凍后通過(guò)升華從生物制藥藥物中去除水分的過(guò)程,這種技術(shù)的時(shí)間和經(jīng)濟(jì)成本通常較高��。凍干過(guò)程包括冷凍����、初級(jí)和次級(jí)干燥步驟�。
冷凍步驟旨在將大部分水變成冰,形成凍結(jié)濃縮溶液�。冷凍期間的溫度必須設(shè)置在最大凍結(jié)濃度溶液的玻璃化轉(zhuǎn)變溫度和結(jié)晶材料的共晶溫度以下。退火是冷凍后執(zhí)行的一步�,可形成更大、更均勻的冰晶并使填充劑結(jié)晶����,從而提高初級(jí)干燥的效率。冷凍過(guò)程中蛋白質(zhì)分子所在的體系特性會(huì)發(fā)生變化����,影響產(chǎn)品的穩(wěn)定性��。冷卻速度會(huì)影響冰晶的大小和形態(tài)��,進(jìn)而影響凍干的干燥階段�����。蛋白質(zhì)濃度�、類型和退火步驟的加入也會(huì)影響產(chǎn)品復(fù)溶時(shí)間����。
初級(jí)干燥通過(guò)升華去除冷凍的游離水,適當(dāng)選擇板層溫度和壓力值可以縮短該過(guò)程����。初級(jí)干燥是凍干過(guò)程中最耗時(shí)和能量的階段,通常最佳壓力為0.1-0.2 mbar�,板層溫度選擇基于玻璃化轉(zhuǎn)變溫度Tg'和塌陷溫度Tc。通常將產(chǎn)品溫度保持在Tg'以下2-3°C以保持蛋白質(zhì)穩(wěn)定性����,但是適當(dāng)?shù)奶幏絻?yōu)化甚至允許產(chǎn)品在Tg'或Tc以上進(jìn)行干燥。當(dāng)產(chǎn)品溫度Tp等于板層溫度時(shí)����,初級(jí)干燥即完成����。通常Tg'和Tc可以分別通過(guò)差示掃描量熱法和凍干顯微鏡來(lái)確定���。
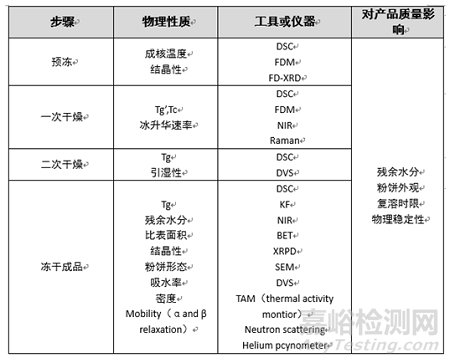
二次干燥通過(guò)解吸去除未冷凍的結(jié)合水�����,以避免儲(chǔ)存期間出現(xiàn)蛋白質(zhì)穩(wěn)定性問(wèn)題��。為了避免樣品崩潰�����,應(yīng)逐漸提高板層溫度,一般不超過(guò)50°C���,時(shí)間通常不超過(guò)6h��。干燥結(jié)束后��,產(chǎn)品中的殘留水分為應(yīng)符合要求�。根據(jù)QbD原則,過(guò)程分析技術(shù)的主要目的是提高過(guò)程效率并保證產(chǎn)品的關(guān)鍵質(zhì)量屬性�。近年來(lái),已經(jīng)開(kāi)發(fā)出用于在線和實(shí)時(shí)測(cè)量的新工具�,如溫度遠(yuǎn)程監(jiān)控系統(tǒng)和TrackSense Pro系統(tǒng),基于對(duì)產(chǎn)品溫度��、板層溫度和腔室壓力的監(jiān)控���,可以確定一次干燥甚至二次干燥的終點(diǎn)���。LyoTrack系統(tǒng)基于光學(xué)發(fā)射光譜測(cè)量干燥室內(nèi)的水分濃度,從而獲得更準(zhǔn)確的干燥終點(diǎn)����。壓力溫度測(cè)量是一種壓力上升測(cè)試,當(dāng)干燥室中的蒸汽壓力不再上升時(shí)���,初級(jí)干燥完成����。此外����,通過(guò)使用近紅外和拉曼探頭��,可以監(jiān)測(cè)凍干配方的中間參數(shù)���,例如過(guò)程誘導(dǎo)的轉(zhuǎn)變、結(jié)晶�、固態(tài)化、多晶型轉(zhuǎn)化和殘余水分含量����。過(guò)程分析技術(shù)工具以及相應(yīng)的屬性如下表。
三�����、凍干制劑輔料
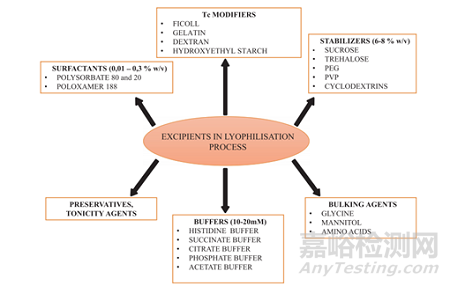
選擇合適輔料能有助于產(chǎn)品在凍干過(guò)程中獲得理想的質(zhì)量屬性和穩(wěn)定性���,并降低生產(chǎn)的時(shí)間和經(jīng)濟(jì)成本����,提高產(chǎn)量��。下圖為生物藥凍干制劑常用輔料選用:
1. 穩(wěn)定劑
凍干過(guò)程中蛋白質(zhì)的穩(wěn)定基于兩種主要機(jī)制:玻璃化和水置換理論����。玻璃化定義了蛋白質(zhì)分子在由無(wú)定形穩(wěn)定劑形成的基質(zhì)中的固定化,從而降低蛋白質(zhì)分子之間的相互作用����,從而防止其結(jié)構(gòu)的變化。水置換機(jī)制是基于穩(wěn)定劑糖的羥基和蛋白質(zhì)的極性基團(tuán)之間氫鍵的形成��,在干燥過(guò)程中取代了水和蛋白質(zhì)之間的氫鍵�,從而允許保留蛋白質(zhì)分子的天然形式。玻璃化理論代表動(dòng)力學(xué)穩(wěn)定���,而水替代理論代表穩(wěn)定的熱力學(xué)方面��,動(dòng)力學(xué)穩(wěn)定與Tg密切相關(guān)�����。Tg的測(cè)定對(duì)于選擇適當(dāng)?shù)膬?chǔ)存和運(yùn)輸條件至關(guān)重要��。在凍結(jié)態(tài)下����,無(wú)定形輔料和蛋白質(zhì)形成玻璃狀基質(zhì)溫度低于該溫度Tg�。但即使在低于Tg的溫度下,蛋白質(zhì)遷移也可以加速降解反應(yīng)����。蛋白質(zhì)會(huì)增加制劑處方的Tg���,需要添加Tg值相對(duì)較高的輔料以保持蛋白質(zhì)穩(wěn)定性,特別是在高濃度蛋白質(zhì)制劑中�。研究顯示,在蔗糖作為穩(wěn)定劑制劑中添加山梨糖醇而增加的分子遷移率不會(huì)影響在Tg溫度下儲(chǔ)存的蛋白質(zhì)的穩(wěn)定性�����,這表明遷移率(即動(dòng)力學(xué)穩(wěn)定)對(duì)于蛋白質(zhì)穩(wěn)定性并不重要��。此外���,最終產(chǎn)品的水含量應(yīng)在最佳范圍內(nèi)�,過(guò)度干燥不利于蛋白質(zhì)穩(wěn)定性����。不建議以<1% (w/v)為干燥最終水分控制標(biāo)準(zhǔn),但較高的殘留水也會(huì)降低儲(chǔ)存條件下制劑處方的Tg從而降低蛋白質(zhì)穩(wěn)定性�����。因此,需要選擇凍干過(guò)程中最佳的二次干燥條件���,以保證合適水分量的控制【1】。
臨界溫度Tg'和Tc也是穩(wěn)定劑的重要特性����,它們決定了凍干過(guò)程的溫度條件和干燥周期的持續(xù)時(shí)間。較高Tg'和Tc的穩(wěn)定劑有助于減少凍干時(shí)間�,通常為了得到合適的干燥時(shí)間,穩(wěn)定劑的Tg'不應(yīng)小于-40°C�。加入具有較高臨界溫度的輔料可以在較高的產(chǎn)品溫度Tp(高于Tg',甚至高于Tc)下進(jìn)行初級(jí)干燥���,從而縮短初級(jí)干燥時(shí)間而不會(huì)發(fā)生塌陷���。蔗糖和海藻糖在凍干過(guò)程和儲(chǔ)存過(guò)程中對(duì)增加蛋白質(zhì)穩(wěn)定性都非常明顯。主要原因是這兩種糖在凍干過(guò)程中不易結(jié)晶����,從而不會(huì)與蛋白質(zhì)相分離。不建議使用結(jié)晶性的填充劑作為穩(wěn)定劑�,如甘露醇和甘氨酸。與海藻糖相比���,蔗糖更便宜經(jīng)濟(jì)��。海藻糖作為穩(wěn)定劑的優(yōu)勢(shì)在于其較高Tg為111°C����,而蔗糖Tg為65°C【2】。
保證穩(wěn)定性的重要因素是穩(wěn)定劑和蛋白質(zhì)之間的適當(dāng)比例����。糖和蛋白質(zhì)之間的摩爾比應(yīng)至少為360:1【3】。添加過(guò)量糖會(huì)降低Tg'�。優(yōu)化凍干過(guò)程的方法是選擇具有高穩(wěn)定性效果和高臨界溫度T?和Tc的替代輔料,高于蔗糖和海藻糖��。包含具有高Tg'和Tc改性劑的輔料��,允許產(chǎn)品在更高的干燥溫度下進(jìn)行初級(jí)干燥而不會(huì)破壞產(chǎn)品結(jié)構(gòu)���。此外��,Tc改性劑和填充劑通過(guò)形成晶格的組合可以在產(chǎn)品溫度高于Tc的情況下進(jìn)行初級(jí)干燥����,而不影響蛋白質(zhì)穩(wěn)定性和不發(fā)生塌陷【4】����。下表列出的穩(wěn)定劑輔料(除山梨醇外)Tg'都高于蔗糖(這意味著可能使用更高的干燥溫度來(lái)縮短干燥過(guò)程)����。為了確保蛋白質(zhì)的穩(wěn)定性并防止相分離�����,建議將蔗糖和葡聚糖結(jié)合使用【2】����。
聚乙烯吡咯烷酮PVP也是一種可用于穩(wěn)定劑的聚合物�,它可以抑制緩沖鹽的結(jié)晶,PVP通常與糖結(jié)合使用�。對(duì)于腸外劑型,由于易在體內(nèi)積聚不推薦使用高分子量PVP【5】�。羥丙基-β-環(huán)糊精可以作為穩(wěn)定劑或表面活性劑,通過(guò)水替代理論和增加凍干體系Tg來(lái)穩(wěn)定蛋白質(zhì)����。如果將環(huán)糊精用作凍干保護(hù)劑,則濃度通常在1-10%(w / v)����。環(huán)糊精還能限制已經(jīng)具有結(jié)晶傾向的穩(wěn)定劑結(jié)晶,因此其主要幫助在生產(chǎn)和儲(chǔ)存過(guò)程中蛋白質(zhì)保持穩(wěn)定。羥丙基-β-環(huán)糊精的兩親性質(zhì)通過(guò)防止蛋白質(zhì)在界面處展開(kāi)和聚集���,從而在冷凍�、干燥和復(fù)溶過(guò)程中增加蛋白質(zhì)穩(wěn)定性��,從而起到表面活性劑的作用��。除了與蛋白質(zhì)相互作用外��,它還降低了表面張力����,從而防止空氣/水、冰/水和固體/空氣界面的不穩(wěn)定���。研究顯示羥丙基-β-環(huán)糊精在低濃度(0.1% w/v)下能表現(xiàn)出表面活性劑作用【6】�����。下表列出生物凍干制劑中的各種穩(wěn)定劑及其關(guān)鍵參數(shù)��。
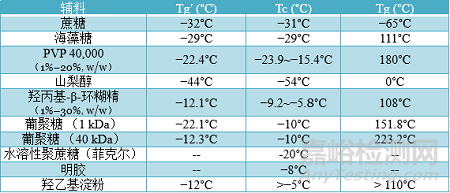
在氨基酸中��,最常用作穩(wěn)定劑的是甘氨酸�、組氨酸和精氨酸。組氨酸在保持在無(wú)定形狀態(tài)時(shí)作為緩沖液和冷凍/凍干保護(hù)劑�,以及作為抗氧化劑。在凍干制劑中����,甘氨酸通常作為填充劑或緩沖劑添加,而其穩(wěn)定特性顯示出與糖的協(xié)同作用����。精氨酸穩(wěn)定作用是基于其與蛋白質(zhì)表面的弱結(jié)合��,可以防止蛋白質(zhì)相互作用和聚集����,同時(shí)它在凍干期間和之后表現(xiàn)為無(wú)定形狀態(tài)。在用于皮下給藥的高濃度蛋白質(zhì)制劑方面精氨酸使用較多�����,鹽酸精氨酸降低制劑的粘度并有助于增加蛋白質(zhì)溶解度��。此外��,脯 氨酸��、丙氨酸、絲氨酸���、苯丙氨酸�、異亮氨酸�����、亮氨酸��、賴氨酸和纈氨酸等氨基酸也可能被用作穩(wěn)定劑�����,通常為了增強(qiáng)蛋白質(zhì)的穩(wěn)定性而與二糖聯(lián)合使用��。除精氨酸鹽酸鹽�����、賴氨酸鹽酸鹽�、組氨酸鹽酸鹽可作為降粘劑外,不同的鹽(NaCl�、NaAc、Na2所以4和 NH4Cl)以及將一些輔料改性成疏水鹽也可以降低高濃度蛋白的粘度【2】【7】�����。
2. 填充劑
填充劑能為凍干餅提供適當(dāng)?shù)慕Y(jié)構(gòu),有助于凍干餅塊的適當(dāng)形態(tài)��,形成孔結(jié)構(gòu)��,孔隙率是冷凍水升華的先決條件����,較大的孔隙可以更快地升華,因此可以減少初級(jí)干燥時(shí)間�����。添加填充劑可實(shí)現(xiàn)更短的初級(jí)干燥(產(chǎn)品溫度Tp?Tg'或Tc)時(shí)間���,可作為優(yōu)化生物制藥凍干過(guò)程的方法。
通常穩(wěn)定劑與填充劑的比例應(yīng)至少為1:2��,以提供必要的填充劑結(jié)晶��。形成的晶格為處于無(wú)定形狀態(tài)的成分提供機(jī)械支撐���。在Tg'上方��,制劑體系形成的無(wú)定形狀態(tài)剛性不夠��,無(wú)法支撐其自身重量��,并且會(huì)坍縮到晶體網(wǎng)絡(luò)上�。由于機(jī)械支撐,盡管干燥溫度高于Tg'(甚至高于Tc)���,但仍可以防止塌陷發(fā)生����。在蛋白質(zhì)濃度<50 mg/mL的處方中��,添加填充劑尤為重要����,因?yàn)樵诘鞍踪|(zhì)濃度較高的配方中體系的Tg′會(huì)增加。但如果填充劑在凍干過(guò)程中保持無(wú)定形狀態(tài)��,由于儲(chǔ)存過(guò)程中潛在的結(jié)晶�,可能會(huì)影響蛋白質(zhì)穩(wěn)定性,因此��,通常加入退火步驟可促進(jìn)填充劑的結(jié)晶��。市售產(chǎn)品大多以甘露醇或甘氨酸作為填充劑,因?yàn)樗鼈兙哂懈呓Y(jié)晶傾向���。甘露醇/冰和甘氨酸/冰混合物具有較高的共晶熔融溫度����,分別為-1.5°C和-4°C�。即使甘氨酸的部分結(jié)晶(蔗糖與甘氨酸的比例為2:1)也能使體系在更高的干燥條件下進(jìn)行而不會(huì)對(duì)凍干餅結(jié)構(gòu)產(chǎn)生影響。與未退火的無(wú)定形制劑相比�,退火后部分結(jié)晶的甘露醇有助于縮短高濃度蛋白質(zhì)制劑的復(fù)溶時(shí)間。但是填充劑的物理狀態(tài)還取決于蛋白質(zhì)的類型���、濃度����、pH和緩沖液濃度���。研究顯示將凍干溶液中的pH值從5.9降低到3.0,并將磷酸鹽緩沖液濃度從50mM增加到250mM會(huì)降低甘氨酸結(jié)晶速率【8】����。
填充劑對(duì)蛋白質(zhì)穩(wěn)定性的影響很小(填充劑的結(jié)晶度增加還是會(huì)或多或少導(dǎo)致蛋白質(zhì)物理穩(wěn)定性降低)或沒(méi)有影響�����。因此需要選擇合適的填充劑和穩(wěn)定劑,由于二者的協(xié)同作用����,含有穩(wěn)定劑和填充劑的配方有助于提高物理穩(wěn)定性。但是當(dāng)使用的穩(wěn)定劑阻止填充劑結(jié)晶導(dǎo)致支撐非晶相的晶格無(wú)法形成時(shí)��,將會(huì)影響初級(jí)干燥溫度����。研究發(fā)現(xiàn)添加甘露醇作為填充劑幾乎不會(huì)損害蛋白質(zhì)穩(wěn)定性,同時(shí)防止在凍干中塌陷【9】���。
除了甘露醇和甘氨酸��,葡聚糖和PEG����,苯丙氨酸�����、異亮氨酸、亮氨酸����、蛋氨酸、精氨酸和組氨酸等氨基酸也可以作為填充劑�。研究顯示,與甘氨酸和甘露醇相比���,其他作為填充劑的氨基酸可以在較低的濃度下結(jié)晶�,蔗糖與氨基酸的比例為2.5-47.5已被證明足以促進(jìn)結(jié)晶���。但為了得到更好的外觀和是蛋白質(zhì)穩(wěn)定性更好��,蔗糖與氨基酸(即亮氨酸��、異亮氨酸�����、苯丙氨酸)的最佳比例為4:1【10】����。
3. 緩沖劑
緩沖劑的作用是將溶液的pH值維持在保持蛋白質(zhì)具有較好穩(wěn)定性的條件�����?���?筛鶕?jù)蛋白質(zhì)的等電點(diǎn)選擇溶液的pH,為了防止使用后的刺激�,疼痛和副作用,pH需要在人體生理可接受范圍內(nèi)���。結(jié)合目前已上市的生物制劑以及相關(guān)研究����,生物蛋白質(zhì)藥物大多緩沖區(qū)間在pH4.6-8.2范圍內(nèi)��。蛋白質(zhì)分子在凍干���、復(fù)溶和儲(chǔ)存過(guò)程中暴露于不同的降解條件�,因此選擇合適的緩沖液至關(guān)重要����。
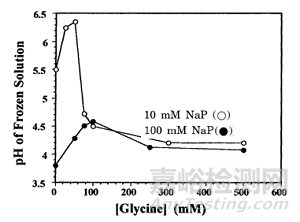
對(duì)于凍干制劑,最常用的緩沖液是非氨基酸緩沖液����,例如磷酸緩沖液�����、乙酸緩沖液���、檸檬酸緩沖液和琥珀酸緩沖液。對(duì)于氨基酸緩沖液的使用�����,組氨酸緩沖液是使用最廣泛的��。檸檬酸鹽緩沖液通常是最先考慮的��,因?yàn)樗柠}組分在冷凍過(guò)程中表現(xiàn)出低結(jié)晶傾向�����,并且具有高臨界溫度Tc���,這有助于縮短初級(jí)干燥時(shí)間�����。在冷凍過(guò)程中需要避免緩沖鹽的結(jié)晶�����,因?yàn)榻Y(jié)晶會(huì)改變體系pH值并導(dǎo)致蛋白質(zhì)不穩(wěn)定(在磷酸鈉溶液的冷凍過(guò)程中��,二鈉鹽的結(jié)晶會(huì)導(dǎo)致pH值降低至3個(gè)pH單位)����。雖然一些情況下添加填充劑如甘露醇和甘氨酸����,可能會(huì)促進(jìn)緩沖鹽結(jié)晶,但填充劑對(duì)緩沖鹽的結(jié)晶影響主要取決于填充劑的濃度����,濃度<50 mM的甘氨酸抑制磷酸鹽緩沖液中二鈉鹽的結(jié)晶,而當(dāng)濃度較高時(shí)����,結(jié)晶速率明顯增加,如下圖��。此外�����,冷凍過(guò)程中磷酸鹽緩沖液的急劇pH變化也會(huì)導(dǎo)致蛋白質(zhì)的不穩(wěn)定,但通常加入穩(wěn)定劑后處于無(wú)定型狀態(tài)的穩(wěn)定劑能很大程度緩解緩沖液結(jié)晶和pH變化引起的蛋白質(zhì)不穩(wěn)定����,各輔料起到協(xié)同作用【11】。
此外�����,當(dāng)緩沖液處于非結(jié)晶狀態(tài)下時(shí)�,其pH對(duì)溫度敏感性也值得關(guān)注,非結(jié)晶狀態(tài)下��,Tris緩沖液比磷酸鹽緩沖液更容易受溫度影響�。當(dāng)溫度降低時(shí),Tris(PKa7.4)緩沖液的緩沖能力會(huì)降低�����,而當(dāng)溫度升高時(shí)�����,pH值也可能會(huì)上升�����,因此尤其是在配制和使用Tris緩沖液時(shí),需要特別注意合適的溫度范圍����。
4. 表面活性劑
表面活性劑在蛋白質(zhì)制劑中的作用是通過(guò)表面活性劑吸附到蛋白質(zhì)表面的疏水區(qū)域或冰/空氣和水之間的界面來(lái)防止蛋白質(zhì)表面聚集�����。表面活性劑增加了蛋白質(zhì)展開(kāi)所需的自由能��,并降低了凍干和復(fù)溶過(guò)程中形成界面的表面張力����。在復(fù)溶過(guò)程中,有助于凍干餅塊的復(fù)溶���。
與離子表面活性劑相比�����,非離子性質(zhì)不會(huì)促進(jìn)蛋白質(zhì)變性如聚山梨酯80和20是最常用的�。使用聚山梨酯時(shí)��,必須考慮其對(duì)氧化和水解的敏感性。其可能形成的降解產(chǎn)物(例如��,過(guò)氧化氫��,甲酸)會(huì)對(duì)蛋白質(zhì)穩(wěn)定性產(chǎn)生影響��。此外�,還需要考慮聚山梨酯的成分、等級(jí)和來(lái)源�����。藥典規(guī)定�,聚山梨酯80(II)含油酸應(yīng)不低于98.0%,含肉豆蔻酸��、棕櫚酸��、棕櫚油酸����、硬脂酸、亞油酸與亞麻酸均不得超過(guò)0.5%��。而聚山梨酯20含月桂酸應(yīng)為40.0%~60.0%��,含肉豆蔻酸應(yīng)為14.0%~25.0%,含棕櫚酸應(yīng)為7.0%~15.0%��,含己酸����、辛酸、癸酸�、硬脂酸、油酸與亞油酸分別不得過(guò)1.0%�、10.0%����、10.0%、7.0%����、11.0%與3.0%。此外���,泊洛沙姆是可以代替聚山梨酯使用的比較有前景的表面活性劑��,但是目前它們?cè)谑惺郛a(chǎn)品中的使用量很低����。
在凍干過(guò)程中,藥物制劑中的蛋白質(zhì)分子可能會(huì)受到不同因素影響�,包括pH,脫水����,離子強(qiáng)度增加,水/冰界面的形成和溫度變化�。通過(guò)選用合適的輔料,不僅可以提高生物制藥的穩(wěn)定性�����,還可以影響凍干過(guò)程的參數(shù)���。因此�,這些輔料對(duì)于降低成本凍干工藝至關(guān)重要�,這些工藝可提供具有可接受的凍干餅結(jié)構(gòu)和所需關(guān)鍵質(zhì)量屬性的穩(wěn)定產(chǎn)品。最重要的輔料是穩(wěn)定劑���。除蔗糖和海藻糖外��,具有較高T?和Tc的新型穩(wěn)定劑如PEG��,低分子量PVP和環(huán)糊精等能夠使產(chǎn)品在相對(duì)較高溫度下進(jìn)行初級(jí)干燥�,從而縮短初級(jí)干燥時(shí)間,這從工業(yè)角度來(lái)看尤為重要�����。穩(wěn)定劑為蛋白質(zhì)分子提供穩(wěn)定性�,填充劑負(fù)責(zé)有助于凍干餅的合適外觀和孔隙率,以及無(wú)定形材料的機(jī)械支撐����,從而有助于縮短初級(jí)干燥時(shí)間。從生物制藥皮下應(yīng)用的當(dāng)代趨勢(shì)來(lái)看����,新型輔料也越來(lái)越受到關(guān)注��,特別是在高濃度蛋白質(zhì)配方方面����。
參考文獻(xiàn):
[1] Liuquan, Lucy, Chang., Deanna, Shepherd., Joanna, Sun., Xiaolin, Charlie, Tang., Michael, J., Pikal. "Effect of sorbitol and residual moisture on the stability of lyophilized antibodies: Implications for the mechanism of protein stabilization in the solid state." Journal of Pharmaceutical Sciences, 94 (2005).:1445-1455. doi: 10.1002/JPS.20363
[2] Valeria, Gervasi., R., Dall, Agnol., S., Cullen., T., McCoy., Sonja, Vucen., Abina, M., Crean. "Parenteral protein formulations: An overview of approved products within the European Union.." European Journal of Pharmaceutics and Biopharmaceutics, 131 (2018).:8-24. doi: 10.1016/J.EJPB.2018.07.011
[3] J.L. Cleland, X. Lam, B. Kendrick, J. Yang, T.H. Yang, D. Overcashier, D. Brooks, C. Hsu, J.F. Carpenter A specific molar ratio of stabilizer to protein is required for storage stability of a lyophilized monoclonal antibodyJ. Pharm. Sci., 90 (2001), pp. 310-321, 10.1016/j.talanta.2017.01.023
[4] E.Y. Shalaev, W. Wang, L.A. Gatlin Rational choice of excipients for use in lyophilized formulations E.J. McNally, J.E. Hastedt (Eds.), Protein Formulation and Delivery, Informa Healthcare (2007), pp. 197-219
[5] S. Pramanick, D. Singodia, V. Chandel Excipient selection in parenteral formulation development, 45 (2013), pp. 65-77
[6] T. Serno, R. Geidobler, G. Winter Protein stabilization by cyclodextrins in the liquid and dried stateAdv. Drug Deliv. Rev., 63 (2011), pp. 1086-1106, 10.1016/j.addr.2011.08.003
[7] S. Wang, N. Zhang, T. Hu, W. Dai, X. Feng, X. Zhang, F. QianViscosity-lowering effect of amino acids and salts on highly concentrated solutions of two IgG1 monoclonal antibodies Mol. Pharm., 12 (2015), pp. 4478-4487, 10.1021/acs.molpharmaceut.5b00643
[8] D.B. Varshney, S. Kumar, E.Y. Shalaev, P. Sundaramurthi, S.-W. Kang, L.A. Gatlin, R. Suryanarayanan Glycine crystallization in frozen and freeze-dried systems: effect of pH and buffer concentrationPharm. Res., 24 (2007), pp. 593-604, 10.1007/s11095-006-9178-z
[9] K. Schersch, O. Betz, P. Garidel, S. Muehlau, S. Bassarab, G. Winter Systematic investigation of the effect of lyophilizate collapse on pharmaceutically relevant proteins I: stability after freeze-dryingJ. Pharm. Sci., 99 (2010), pp. 2256-2278, 10.1002/jps.22000
[10] J. Horn, E. Tolardo, D. Fissore, W. FriessCrystallizing amino acids as bulking agents in freeze-dryingEur. J. Pharm. Biopharm. Off. J. Arbeitsgemeinschaft Pharm. Verfahrenstechnik EV, 132 (2018), pp. 70-82, 10.1016/j.ejpb.2018.09.004
[11] Pikal-Cleland KA, Cleland JL, Anchordoquy TJ, Carpenter JF. Effect of glycine on pH changes and protein stability during freeze-thawing in phosphate buffer systems. J Pharm Sci. 2002 Sep;91(9):1969-79. doi: 10.1002/jps.10184. PMID: 12210044.