引言
植入醫(yī)療器械產(chǎn)品多面臨腐蝕、材料降解、涂層剝離���、顆粒脫落等問題,致使金屬植入物的離子析出�,從而導(dǎo)致人體過量攝入金屬離子���,引發(fā)神經(jīng)損傷、癌癥風(fēng)險(xiǎn)升高等后果�。因此金屬植入醫(yī)療器械的離子釋放速率和釋放量是評(píng)價(jià)其臨床使用安全性的重要內(nèi)容。
基于器械原材料本身的性質(zhì)特點(diǎn)�,開展模擬生理環(huán)境中發(fā)生的植入醫(yī)療器械產(chǎn)品金屬離子析出試驗(yàn)研究,通過建立金屬離子體外釋放模型�,形成金屬離子釋放評(píng)價(jià)的體外試驗(yàn)方法,更好地保證增材制造植入物醫(yī)療器械產(chǎn)品的臨床使用安全性�。
對(duì)增材制造技術(shù)醫(yī)療器械產(chǎn)品進(jìn)行金屬離子析出試驗(yàn)研究,主要包含:毒理學(xué)允許限量的建立���,浸提條件和時(shí)間的確認(rèn)���,方法學(xué)開發(fā)驗(yàn)證,離子析出含量的測(cè)定以及毒理學(xué)風(fēng)險(xiǎn)評(píng)估����。本文據(jù)此展開闡述,歡迎留言探討����。
1、研究背景
近年來�,增材制造技術(shù)(3D打印技術(shù))迅猛發(fā)展,在醫(yī)療器械中的應(yīng)用越來越多��,例如增材制造可降解鎂合金植入物���、增材制造椎間融合器��、金屬增材制造截骨填充融合體����、金屬增材制造脊柱人工椎體���、金屬增材制造髖關(guān)節(jié)骨缺損系統(tǒng)����、金屬增材制造膝關(guān)節(jié)骨缺損補(bǔ)塊系統(tǒng)等�����,3D打印醫(yī)療器械產(chǎn)品的結(jié)構(gòu)及組成成分也越來越復(fù)雜����。
3D打印本身的特點(diǎn)決定了除力學(xué)性能外,在顆粒殘留、離子析出等方面可能存在與常規(guī)加工的材料完全不同的性質(zhì)——這些領(lǐng)域的生物學(xué)相關(guān)評(píng)價(jià)成了決定類似器械研發(fā)及上市可能性的重點(diǎn)�����,因此對(duì)醫(yī)療器械安全性評(píng)價(jià)的技術(shù)要求也越來越高��。
醫(yī)療器械生物學(xué)評(píng)價(jià)是根據(jù)目前現(xiàn)有的科學(xué)技術(shù)能力和認(rèn)知水平�����,對(duì)醫(yī)療器械在與人體接觸使用過程中的潛在危害性進(jìn)行預(yù)估�����,它是一種綜合性的分析評(píng)價(jià)��。
基于《介入類醫(yī)療器械產(chǎn)品化學(xué)性能要求的說明》和增材制造產(chǎn)品的技術(shù)要求和指導(dǎo)原則���,如《3D打印人工椎體注冊(cè)技術(shù)審查指導(dǎo)原則》���,《3D打印髖臼杯產(chǎn)品注冊(cè)技術(shù)審查指導(dǎo)原則》等,要求對(duì)于采用非國家標(biāo)準(zhǔn)/行業(yè)標(biāo)準(zhǔn)或國際標(biāo)準(zhǔn)化組織(ISO)發(fā)布的標(biāo)準(zhǔn)中規(guī)定的金屬材料制造的介入類醫(yī)療器械產(chǎn)品組件����,需要考慮制定有害金屬離子析出量的控制指標(biāo)���,如鎳�、鈷、釩��、鉛等�;以及對(duì)采用兩種或兩種以上不同金屬材料制造的介入類醫(yī)療器械產(chǎn)品組件,當(dāng)不同金屬材料間可能發(fā)生相互作用影響到該組件的耐腐蝕性能時(shí)���,需要在其化學(xué)性能要求中考慮制定有害金屬離子析出量的控制指標(biāo)�。
增材制造可降解鎂合金植入物
△ 圖源:中國工程院院刊《Engineering》
同時(shí)��,現(xiàn)代金屬腐蝕學(xué)理論認(rèn)為��,金屬及其合金的生物相容性主要取決于該材料在環(huán)境中金屬元素析出的種類和數(shù)量級(jí)���。任何一種人體必需的金屬元素�,若在人體中的含量過高或過低都可能導(dǎo)致病態(tài)�。因此,在臨床前評(píng)價(jià)階段�,宜通過建立金屬離子體外釋放模型,形成金屬離子釋放評(píng)價(jià)的體外試驗(yàn)方法���,以更好地保證相關(guān)產(chǎn)品的臨床使用安全性����。
金屬離子析出研究是指某一醫(yī)療器械在特定配置的溶液中 在規(guī)定的時(shí)間和條件下金屬離子的釋放。
2���、研究方法
2.1金屬離子析出原理
引起金屬植入物離子析出的因素可能是腐蝕����,材料降解�,涂層剝離,顆粒脫落等��。而腐蝕可能發(fā)生在不同的材料表面��,如皮膚(有機(jī)物)��、木材(無機(jī)物)���、金屬(鋁��、銅)等�����。由于物質(zhì)表面發(fā)生化學(xué)����、電化學(xué)或其他反應(yīng)而導(dǎo)致物質(zhì)變化的過程,是一種化學(xué)(電化學(xué))反應(yīng)����;腐蝕也可以是氧化��、酸���、堿等反應(yīng)�。
植入體內(nèi)的器械材料浸泡在人體體液中���,他們均含有蛋白質(zhì)��、有機(jī)酸�、堿金屬和無機(jī)鹽����,其中Na+, K+, Cl-等離子均是電解質(zhì),可使金屬產(chǎn)生均勻腐蝕�;產(chǎn)品成分不純����,組織不均勻����,應(yīng)力集中或疲勞斷裂等因素也可能造成金屬植入物腐蝕。
2.2金屬離子析出試驗(yàn)研究方法
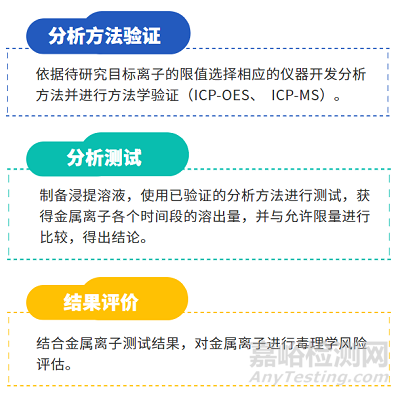
金屬離子析出研究和毒理學(xué)風(fēng)險(xiǎn)評(píng)估依據(jù)ISO10993-1��、ISO 10993-15���、ISO 10993-17���、ASTM F3306、YY/T 1823-2022 《心血管植入物 鎳鈦合金鎳離子釋放試驗(yàn)方法》和YY/T 1802-2021《增材制造醫(yī)療產(chǎn)品 3D打印鈦合金植入物金屬離子析出評(píng)價(jià)方法》等進(jìn)行�����,項(xiàng)目研究流程圖如下:
3����、增材制造產(chǎn)品金屬離子析出試驗(yàn)研究
3.1金屬離子析出試驗(yàn)設(shè)計(jì)
針對(duì)增材制造醫(yī)療產(chǎn)品 3D打印鈦合金植入物,主要依據(jù)YY/T 1802-2021 建立金屬離子體外釋放模型��,重點(diǎn)關(guān)注對(duì)3D打印鈦合金植入物析出的Ti����, Al����, V�����, Fe元素離子進(jìn)行定量分析研究�。
根據(jù)產(chǎn)品的特點(diǎn)選擇不同取樣時(shí)間點(diǎn)進(jìn)行取樣分析���,并依據(jù)完整的方法學(xué)驗(yàn)證和測(cè)試Ti�����, Al����, V����, Fe元素析出含量并對(duì)其進(jìn)行毒理學(xué)的風(fēng)險(xiǎn)評(píng)估。
通常試驗(yàn)條件設(shè)計(jì)主要有以下幾個(gè)因素:浸提樣品(有接觸風(fēng)險(xiǎn)的部件)���;浸提方式(模擬使用浸提)�;浸提介質(zhì)(pH=7.4的Hank’s人工模擬體液 );浸提體積(重量���、臨床使用)���;浸提條件(時(shí)間、溫度等)�;振蕩頻率等。
3.2試樣樣品的要求
依據(jù)標(biāo)準(zhǔn)要求���,推薦使用標(biāo)準(zhǔn)樣件�����,即:

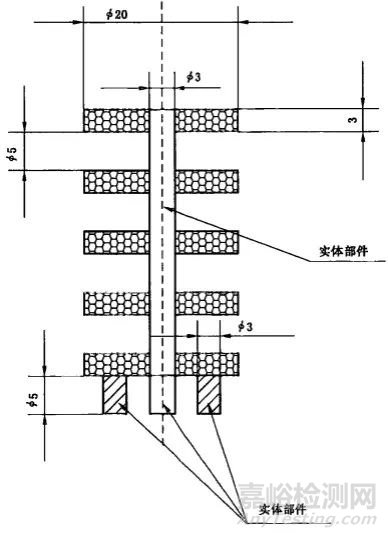
測(cè)試用多孔鈦合金樣品剖面示意圖
4�、研究總結(jié)
增材制造技術(shù)(3D打印技術(shù))的產(chǎn)品種類多�����,應(yīng)用也廣泛��。針對(duì)增材制造椎間融合器、金屬增材制造截骨填充融合體����、金屬增材制造脊柱人工椎體、金屬增材制造髖關(guān)節(jié)骨缺損系統(tǒng)�����、金屬增材制造膝關(guān)節(jié)骨缺損補(bǔ)塊系統(tǒng)等產(chǎn)品金屬離子的析出試驗(yàn)����,通過毒理學(xué)風(fēng)險(xiǎn)評(píng)估建立Ti, Al���, V, Fe元素的允許限量(AL)���,進(jìn)而根據(jù)金屬離子析出試驗(yàn)的ICP-MS的測(cè)試結(jié)果�����,計(jì)算產(chǎn)品的估計(jì)暴露量���,從而確定產(chǎn)品的毒理學(xué)風(fēng)險(xiǎn)是否可接受。
另外,增材制造產(chǎn)品的規(guī)格型號(hào)千差萬別����,需要結(jié)合產(chǎn)品實(shí)際的規(guī)格型號(hào)和預(yù)期使用的解剖學(xué)位置進(jìn)行綜合的評(píng)估:
一般情況下,推薦使用標(biāo)準(zhǔn)樣件進(jìn)行金屬離子析出試驗(yàn)���;
當(dāng)增材制造的產(chǎn)品規(guī)格或者潛在的接觸表面積遠(yuǎn)遠(yuǎn)大于實(shí)際人體組織部位時(shí)����,建議在進(jìn)行金屬離子析出試驗(yàn)時(shí)���,推薦使用產(chǎn)品最大規(guī)格型號(hào)進(jìn)行金屬離子析出試驗(yàn)��,確保對(duì)產(chǎn)品的安全性風(fēng)險(xiǎn)進(jìn)行全面綜合的評(píng)估��。
【參考文獻(xiàn)】
[1] ISO 10993-1, Biological evaluation of medical devices Part 1: Evaluation and testing within a risk management process (2018).
[2] ISO 10993-12, Biological evaluation of medical devices-Part 12: Sample preparation and reference materials (2012).
[3] ISO 10993-15:2019�,Biological evaluation of medical devices — Part 15: Identification and quantification of degradation products from metals and alloys
[4] ISO 10993-17, Biological evaluation of medical devices Part 17: Establishment of allowable limits for leachable substances (2002)
[5] ISO 10993-18, Biological evaluation of medical devices-Part 18: Chemical characterization of medical device materials within a risk management process (2020).
[6] ICH Q2 (R2) Validation of analytical procedures: Text and Methodology.
[7] ICH Q3D(R2), Guideline for elemental impurities.
[8] ChP<0412>, Inductively Coupled Plasma Mass Spectrometry (2020).
[9] ChP<9101>, Guideline for analytical methods of pharmaceutical quality standards (2020).
[10] USP <232> Element Impurities-Limits
[11] USP<233>Element Impurities-Procedure
[12] ASTM F3306-19 Standard Test Method for Ion Release Evaluation of Medical Implants.
[13] YY/T 1802-2021《增材制造醫(yī)療產(chǎn)品 3D打印鈦合金植入物金屬離子析出評(píng)價(jià)方法》
[14] YY/T 1823-2022《心血管植入物 鎳鈦合金鎳離子釋放試驗(yàn)方法》
[15] T/CSBM 0011-2021 醫(yī)用鈦合金植入物金屬離子析出評(píng)價(jià)方法