今日頭條
藹睦引進(jìn)眼用植入劑獲批注冊(cè)臨床。藹睦醫(yī)療宣布從Ocular Therapeutix公司引進(jìn)的地塞米松眼用植入劑DEXTENZA獲國(guó)家藥監(jiān)局批準(zhǔn)開(kāi)展Ⅲ期注冊(cè)臨床���,用于評(píng)價(jià)眼科術(shù)后炎癥和疼痛的療效和安全性��。Dextenza不含防腐劑��,單次插入可持續(xù)釋放地塞米松長(zhǎng)達(dá)30天���。該產(chǎn)品已在美國(guó)和澳門(mén)獲批用于治療眼科手術(shù)后的眼部炎癥和疼痛,以及過(guò)敏性結(jié)膜炎有關(guān)的眼部瘙癢�����。
國(guó)內(nèi)藥訊
1.恒瑞HER2-ADC早期臨床積極��。恒瑞醫(yī)藥在AACR 2023會(huì)議上公布其HER2 ADC藥物SHR-A1811用于晚期實(shí)體瘤后線治療的最新臨床試驗(yàn)數(shù)據(jù)��。數(shù)據(jù)顯示�����,SHR-A1811在HER2陽(yáng)性乳腺癌患者中的ORR可達(dá)81.5%��;在HER2低表達(dá)乳腺癌患者中的ORR可達(dá)55.8%��。而在另一項(xiàng)針對(duì)HER2突變NSCLC后線治療的研究中��,SHR-A1811的ORR可達(dá)40%���,mPFS可達(dá)10.8個(gè)月��。研究中���,SHR-A1811的安全性良好,其中間質(zhì)性肺炎發(fā)生率為3.2%�����。
2.賽神Lp-PLA2抑制劑上Ⅰ期臨床���。賽神醫(yī)藥新型Lp-PLA2抑制劑SNP318在澳大利亞進(jìn)入Ⅰ期臨床試驗(yàn)�����,擬開(kāi)發(fā)用于治療中樞神經(jīng)系統(tǒng)疾病�����。脂蛋白相關(guān)磷脂酶A2(Lp-PLA2)是一種酶�����,它可水解低密度脂蛋白(LDL)上的氧化磷脂��,產(chǎn)生溶血磷脂酰膽堿(lysoPC)��。在臨床前研究中��,該產(chǎn)品已被證明可以修復(fù)血管系統(tǒng)��,包括血腦屏障和血視網(wǎng)膜屏障���,具有治療阿爾茨海默病和糖尿病性黃斑水腫的潛力��。
3.漢康生技SIRPα融合蛋白獲批臨床。漢康生技創(chuàng)新融合蛋白HCB101獲FDA臨床許可��,擬開(kāi)發(fā)用于治療晚期實(shí)體瘤及復(fù)發(fā)難治性非霍奇金淋巴瘤���。HCB101是一款與IgG4-Fc連結(jié)的工程化SIRPα融合蛋白��,旨在通過(guò)阻斷巨噬細(xì)胞和癌細(xì)胞之間的“不要吃我”信號(hào)來(lái)觸發(fā)巨噬細(xì)胞的吞噬活性��。臨床前數(shù)據(jù)顯示��,HCB101可成為一款比其它CD47單克隆抗體或SIRPα融合蛋白更為安全而且更有效的生物制劑�����。
4.康希諾二價(jià)新冠mRNA疫苗獲批臨床��。康希諾生物二價(jià)新冠病毒mRNA疫苗獲國(guó)家藥監(jiān)局臨床許可�����,擬用于預(yù)防新冠肺炎���。該產(chǎn)品由公司第一代廣譜新冠mRNA疫苗和基于Omicron BA.4/5變體的新冠mRNA疫苗組成��。在臨床前研究中���,二價(jià)新冠mRNA疫苗相較于單價(jià)新冠疫苗對(duì)原始毒株、Omicron BA.1���、BA.2.75���、BA.4/5和XBB.1具有更廣譜的中和抗體反應(yīng),且具有良好的安全性���。
5.過(guò)度嗜睡創(chuàng)新療法在華獲批臨床���。Axsome公司1類(lèi)化藥索安非托片(solriamfetol���,Sunosi)獲國(guó)家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可,擬開(kāi)發(fā)用于改善阻塞性睡眠呼吸暫停(OSA)伴有日間過(guò)度思睡的成年患者的覺(jué)醒程度�����。Solriamfetol是一種雙效多巴胺和去甲腎上腺素再攝取抑制劑��,已在多項(xiàng)Ⅲ期臨床TONES項(xiàng)目中顯著改善患者的覺(jué)醒維持時(shí)間和嗜睡評(píng)分��。2019年3月�����,F(xiàn)DA批準(zhǔn)solriamfetol上市�����,治療與發(fā)作性睡病或OSA綜合征相關(guān)的白天過(guò)度嗜睡��。
6.晟斯血友病B融合蛋白報(bào)IND��。鄭州晟斯生物申報(bào)的1類(lèi)生物制品“注射用培重組人凝血因子IX-Fc融合蛋白”的臨床試驗(yàn)申請(qǐng)獲CDE受理�����。這是該公司研發(fā)的重組長(zhǎng)效凝血因子產(chǎn)品��,擬用于先天性九因子缺乏的血友病B患者的出血控制���。值得一提的是���,晟斯生物針對(duì)血友病布局的在研管線還有注射用重組人凝血因子VIII-Fc融合蛋白(晟斯107)和注射用重組人凝血因子Ⅶa-Fc融合蛋白(晟斯109)。
國(guó)際藥訊
1.印度瘧疾佐劑疫苗獲批上市���。印度血清研究所PvT Ltd(SIIPL)���、Novavax公司與牛津大學(xué)開(kāi)發(fā)的瘧疾佐劑疫苗R21/Matrix-MTM獲得加納(Ghana)食品和藥物管理局的批準(zhǔn)上市,用于5至36個(gè)月的兒童預(yù)防罹患瘧疾�����。在接種三劑主要疫苗后一年進(jìn)行的R21/Matrix-M加強(qiáng)劑試驗(yàn)中�����,疫苗對(duì)瘧疾的高效力呈現(xiàn)持續(xù)性,且繼續(xù)達(dá)到WHO瘧疾疫苗技術(shù)路線圖的至少75%疫苗效力目標(biāo)�����。
2.默沙東K藥聯(lián)合化療報(bào)胃癌sBLA���。默沙東PD-1療法Keytruda的補(bǔ)充生物制品許可(sBLA)申請(qǐng)獲FDA受理��,與含氟嘧啶和鉑類(lèi)化療藥物聯(lián)用��,一線治療局部晚期不可切除或轉(zhuǎn)移性胃癌或胃食管交界處(GEJ)腺癌患者�����。PDUFA日期為2023年12月16日���。在KEYNOTE-859試驗(yàn)中,中位隨訪為31.0個(gè)月時(shí)���,Keytruda組合較單獨(dú)化療顯著改善患者的總生存期�����,死亡風(fēng)險(xiǎn)降低22%(p<0.0001)���。
3.羅氏Tecentriq組合肝癌III期臨床積極。羅氏在AACR2023年會(huì)上公布PD-L1抑制劑阿替利珠單抗(泰圣奇®��,Tecentriq®)聯(lián)合貝伐珠單抗(安維汀®�����,Avastin®)用于切除或消融后復(fù)發(fā)風(fēng)險(xiǎn)高的肝細(xì)胞癌的III期臨床IMbrave050最新數(shù)據(jù)��。中位隨訪為17.4個(gè)月時(shí)��,聯(lián)合治療可減少癌癥復(fù)發(fā)風(fēng)險(xiǎn)28%(HR=0.72���,95% CI:0.56-0.93��;P=0.0120)�����;目前總生存期(OS)尚不成熟(7%事件率)��。藥物的安全性與已知研究一致�����。
4.靶向CD22異基因CAR-T臨床前研究積極���。Sana Biotechnology公司在《自然-通訊》上發(fā)表其低免疫(HIP)修飾��、靶向CD22的異基因CAR-T療法SC262用于治療人源化小鼠腫瘤模型的臨床前積極結(jié)果���。分析顯示,SC262在腫瘤清除的持久性以及CAR-T細(xì)胞擴(kuò)增和持久性方面明顯優(yōu)于未修飾的allo CAR-T細(xì)胞��。Sana預(yù)計(jì)今年提交SC262的IND申請(qǐng)���,擬開(kāi)發(fā)用于曾接受過(guò)CD19靶向CAR-T細(xì)胞后失敗的腫瘤患者的治療��。
5.默沙東108億美元布局自免賽道��。默沙東宣布將以108億美元收購(gòu)免疫治療藥物公司Prometheus Biosciences并獲得其潛在“first-in-class”抗TL1A單抗藥物PRA023��。PRA023可與TL1A特異性結(jié)合���,具有顯著改變TL1A表達(dá)水平升高的潰瘍性結(jié)腸炎(IBD)患者病情的潛力。2022年12月�����,PRA023在治療潰瘍性結(jié)腸炎和克羅恩病的兩項(xiàng)Ⅱ期臨床中獲得積極結(jié)果。
6.NK免疫療法公司獲1200萬(wàn)美元融資�����。專(zhuān)注于臍帶血來(lái)源開(kāi)發(fā)下一代同種異體NK細(xì)胞的藥物公司ImmuneBridge宣布完成超額認(rèn)購(gòu)的1200萬(wàn)美元的種子輪融資�����。此輪融資將主要用于建立針對(duì)適應(yīng)癥優(yōu)化的NK細(xì)胞的篩選數(shù)據(jù)集�����,以證明其可制造性能夠被規(guī)?��;㈤_(kāi)展臨床前研究���,以用于治療血液惡性腫瘤和實(shí)體腫瘤��。此輪融資由Insight Partners和M Ventures共同領(lǐng)投��。
7.AZ終止開(kāi)發(fā)一款中后期GLP-1R/GCGR激動(dòng)劑�����。阿斯利康宣布終止開(kāi)發(fā)GLP-1R/GCGR激動(dòng)劑cotadutide(每日1次)���,并將集中資源開(kāi)發(fā)另一款GLP-1R/GCGR激動(dòng)劑AZD9550(每周1次)���。cotadutide是MedImmune(已被阿斯利康收購(gòu))開(kāi)發(fā)的一種胃泌酸調(diào)節(jié)素類(lèi)似物,目前已完成4項(xiàng)II期研究��。在一項(xiàng)針對(duì)伴2型糖尿病的超重或肥胖患者的IIa期研究中���,cotadutide組患者體重顯著減輕(-3.84kgvs-1.70kg�����;P=0.0008)�����,HbA1c水平亦顯著下降(-0.9%vs-0.6%)���。
醫(yī)藥熱點(diǎn)
1.5位青年科學(xué)家被聘為學(xué)部委員。在4月15日上午召開(kāi)的中國(guó)醫(yī)學(xué)發(fā)展大會(huì)上��,來(lái)自中國(guó)科學(xué)院動(dòng)物研究所的劉光慧,南京醫(yī)科大學(xué)的胡志斌���,深圳醫(yī)學(xué)科學(xué)院�����、清華大學(xué)的顏寧,武漢大學(xué)的宋保亮��,上海交通大學(xué)的樊春海5位50歲以下的科學(xué)家被選聘為新一屆的中國(guó)醫(yī)學(xué)科學(xué)院學(xué)部委員���,他們的研究領(lǐng)域涵蓋衰老和再生醫(yī)學(xué)��、分子流行病學(xué)���、結(jié)構(gòu)生物學(xué)和生物化學(xué)。
2.北京胸科醫(yī)院領(lǐng)導(dǎo)班子調(diào)整���。2023年4月12日上午��,北京胸科醫(yī)院召開(kāi)干部會(huì)議���,宣布北京市醫(yī)院管理中心黨委對(duì)醫(yī)院領(lǐng)導(dǎo)班子的調(diào)整決定。北京市醫(yī)院管理中心黨委會(huì)研究決定任孫樹(shù)學(xué)同志為北京市結(jié)核病胸部腫瘤研究所(首都醫(yī)科大學(xué)附屬北京胸科醫(yī)院)副所長(zhǎng)(副院長(zhǎng))職務(wù)。孫樹(shù)學(xué)表示���,在未來(lái)的工作中��,要盡快轉(zhuǎn)變角色�����,主動(dòng)匯入市屬醫(yī)院發(fā)展的大潮�����,敢于擔(dān)當(dāng)��,為醫(yī)院的發(fā)展貢獻(xiàn)力量�����。
3.中國(guó)上市藥企研發(fā)費(fèi)用50強(qiáng)���。 根據(jù)企業(yè)披露數(shù)據(jù)集東方財(cái)富choice數(shù)據(jù),行業(yè)媒體《E藥經(jīng)理人》發(fā)布中國(guó)上市藥企研發(fā)費(fèi)用50強(qiáng)榜單�����。2022年中國(guó)上市藥企研發(fā)費(fèi)用前5強(qiáng)排序分別為百濟(jì)神州(114.25億元)、恒瑞醫(yī)藥(52.99億元)�����、中國(guó)生物制藥(44.54億元)��、復(fù)星醫(yī)藥(43.02億元)和石藥集團(tuán)(39.87億元)�����。
評(píng)審動(dòng)態(tài)
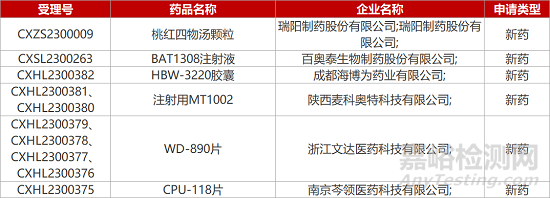
1. CDE新藥受理情況(04月17日)
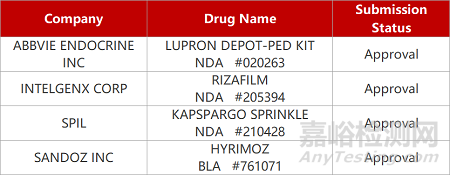
2. FDA新藥獲批情況(北美04月14日)