前言
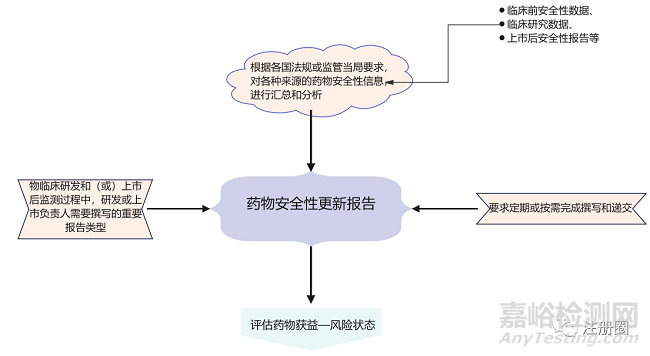
藥物安全性更新報(bào)告是指根據(jù)各國法規(guī)或監(jiān)管當(dāng)局要求,對各種來源的藥物安全性信息�,包括臨床前安全性數(shù)據(jù)、臨床研究數(shù)據(jù)����、上市后安全性報(bào)告等,進(jìn)行匯總和分析���,評估藥物獲益—風(fēng)險(xiǎn)狀態(tài)�,并按要求定期或按需完成撰寫和遞交的報(bào)告。
由于產(chǎn)品所處的階段及撰寫目的的不同����,安全性更新報(bào)告有多種類型,主要包括研發(fā)期間安全性更新報(bào)告(Development Safety Update Report����,DSUR),定期安全性更新報(bào)告(Periodic Safety Update Report���,PSUR)和定期獲益-風(fēng)險(xiǎn)評估報(bào)告(Periodic Benefit Risk Evaluation Report�,PBRER)以及其他安全性更新和總結(jié)報(bào)告����。
一、 安全性更新報(bào)告(Development Safety Update Report����,DSUR)
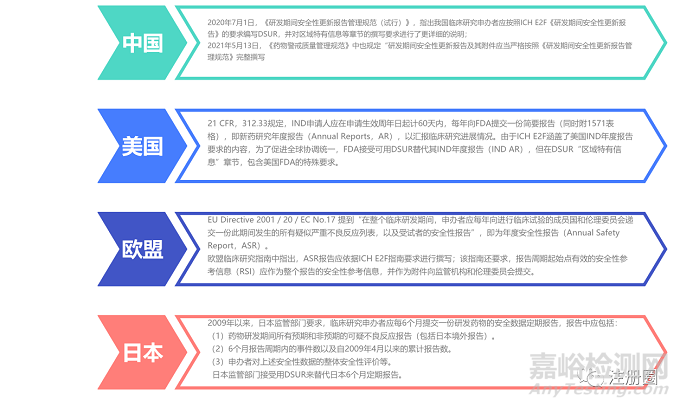
(一)各國法規(guī)對于撰寫和遞交的規(guī)定區(qū)別
(二)DSUR的撰寫數(shù)據(jù)準(zhǔn)備
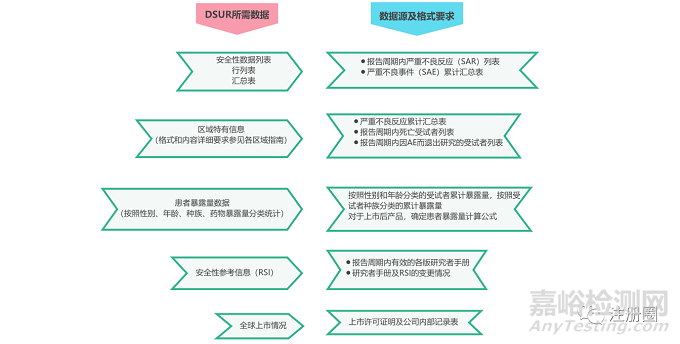

臨床研究申請人應(yīng)根據(jù)ICH E2F指南示例,并結(jié)合各區(qū)域特殊要求進(jìn)行DSUR的撰寫���。下圖總結(jié)出區(qū)域特有信息相關(guān)要求�。
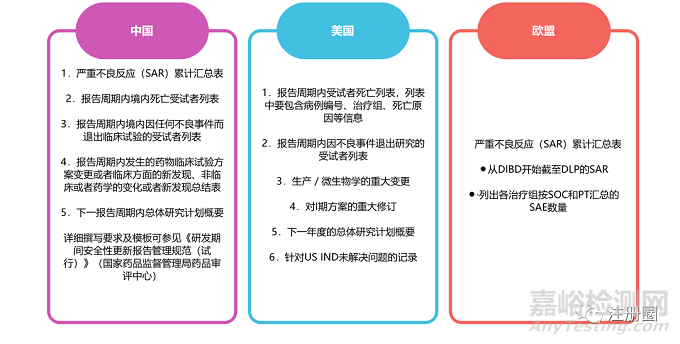
二�、 定期安全性更新報(bào)告(PSUR)和定期獲益—風(fēng)險(xiǎn)評估報(bào)告(PBRER)
(一)概念
與DSUR對應(yīng)�,PSUR或PBRER是針對獲得上市許可的藥物需要準(zhǔn)備的安全性總結(jié)報(bào)告����。
ICH E2 C(R1)指南和ICH E2 C(R2)指南中有相對應(yīng)的提交格式、內(nèi)容和和時(shí)間的規(guī)定����。但是目前各國對于定期上市后安全性報(bào)告的遞交要求并沒有完全統(tǒng)一���。
(二)國內(nèi)外PSUR和PBRER相關(guān)法規(guī)要求
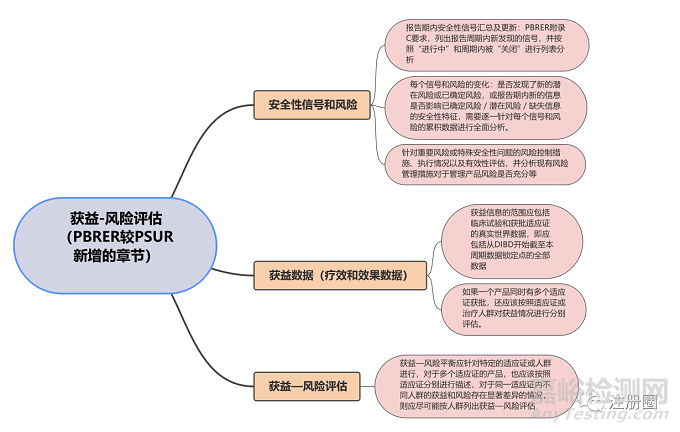
(三)PBRER區(qū)別于PSUR的撰寫要求
總體來說���,PBRER的撰寫基本原則與PSUR相似,包括同一活性成分一份報(bào)告的原則���、統(tǒng)一數(shù)據(jù)鎖定點(diǎn)的原則等���,但PBRER在內(nèi)容結(jié)構(gòu)和評估方法方面增加了新的要求。
下圖是關(guān)于安全性信號和風(fēng)險(xiǎn)���、獲益數(shù)據(jù)和獲益—風(fēng)險(xiǎn)評估這三方面的總結(jié):
產(chǎn)品獲得上市許可后����,應(yīng)按照各國上市后法規(guī)開始撰寫上市后PSUR/PBRER;但如果該產(chǎn)品仍有其他研發(fā)項(xiàng)目或新適應(yīng)癥正在進(jìn)行中����,仍需要按照原來的周期繼續(xù)DSUR的撰寫和提交,分別按照IBD和DIBD來確定報(bào)告的數(shù)據(jù)鎖定日期����,PSUR/PBERE不能替代DSUR。
PSUR和DSUR同時(shí)撰寫時(shí)���,如果企業(yè)出于數(shù)據(jù)清理需要���,希望能統(tǒng)一數(shù)據(jù)鎖定日期時(shí),需要提前與監(jiān)管部門溝通���,且任何一份報(bào)告的周期不低于法規(guī)要求的最低周期�。
對于附條件批準(zhǔn)的上市產(chǎn)品���,如條件要求繼續(xù)進(jìn)行療效和安全性炎癥的臨床研究�,也需要根據(jù)要求同時(shí)撰寫DSUR和PSUR/PBRER�,直至批件中要求的臨床研究完成并獲得批準(zhǔn)。