制藥工業(yè)向連續(xù)制造的范式轉(zhuǎn)變,最近已從概念論證發(fā)展到試生產(chǎn)����,促進了過程系統(tǒng)工程( PSE) 工具的開發(fā)和應(yīng)用�,以實現(xiàn)高效和穩(wěn)健的控制策略����。本研究提出了一個藥品連續(xù)固體制劑生產(chǎn)過程控制設(shè)計與風險分析的系統(tǒng)框架,包括系統(tǒng)辨識與狀態(tài)空間模型; 控制設(shè)計和分析指標; 3 層遞階控制結(jié)構(gòu); 風險地圖���、評估和規(guī)劃( 風險地圖) 戰(zhàn)略; 控制性能指標�。該框架應(yīng)用于進料混合系統(tǒng)�,其中產(chǎn)品質(zhì)量的主要差異源出現(xiàn)??梢宰C明,通過提出的控制設(shè)計和風險分析系統(tǒng)框架�,可以緩解和管理進料配料系統(tǒng)中的差異。為了在先進的層次上實現(xiàn)有效的控制設(shè)計���,用于原料藥質(zhì)量分數(shù)測量的過程分析技術(shù)( PAT) 工具及其相對標準差( RSD) 是必不可少的�。具體而言���,通過實施先進的基于模型的控制策略����,控制性能的改善受到模型對象失配和 PAT 工具采樣時間的限制。
在過去的 10 年中����,通過廣泛的研究,連續(xù) 2 次制造工藝在制藥工業(yè)中的優(yōu)勢已經(jīng)得到了體現(xiàn)�,但主要是在概念或理論層面[1]。為了從概念性的連續(xù)設(shè)計轉(zhuǎn)變?yōu)閷嶋H運行的試驗工廠或制造過程���,如輝瑞公司開發(fā)的便攜式、連續(xù)式���、微型和模塊化技術(shù)( PCMM) ���,鑒于監(jiān)管機構(gòu)、學術(shù)界和工業(yè)界的努力現(xiàn)集中在設(shè)計和實施問題上���,具體介紹了實時釋放控制結(jié)構(gòu)的設(shè)計及其在連續(xù)固體制劑制造中的實現(xiàn)[2]�。因此���,本研究提出了一個系統(tǒng)化的控制設(shè)計與風險分析架構(gòu)����,以期達到有效且強健的主動過程控制。該框架由以下幾個部分組成: 狀態(tài)空間模型的系統(tǒng)辨識; 控制設(shè)計和分析指標; 3 層遞階控制結(jié)構(gòu); 風險地圖�、評估和規(guī)劃( 風險地圖) 戰(zhàn)略; 控制性能指標。具體來說�,遞階控制結(jié)構(gòu)更側(cè)重于實現(xiàn),根據(jù)控制目標的規(guī)模���、所需的過程理解以及處理過程干擾和風險的潛在能力對各層進行分類[3]���。此外,不依賴于傳遞函數(shù)或卷積模型����,提倡狀態(tài)空間模型。
狀態(tài)空間模型由于其固有的靈活性�,在表示多元非線性過程和建模不可測量的干擾和過程時滯方面具有優(yōu)勢。除了常用的時間絕對誤差積分( ITAE) 進行控制整定或性能評價外���,還提出了 3 個新的性能指標�,將控制性能與一致的產(chǎn)品質(zhì)量直接聯(lián)系起來[4-5]���。
1�、過程控制設(shè)計和風險分析的系統(tǒng)框架
通過廣泛的最終產(chǎn)品測試進行質(zhì)量控制( 目前在傳統(tǒng)的藥品批量生產(chǎn)中實施) 與此相反,在連續(xù)的生產(chǎn)過程中���,應(yīng)在其指定的設(shè)定點實時監(jiān)測和控制產(chǎn)品和通向產(chǎn)品的中間流的質(zhì)量[6]�?��?刂平Y(jié)構(gòu)應(yīng)能很好地響應(yīng)由于過程變量����、設(shè)備條件����、進料原材料或環(huán)境因素的干擾和風險引起的潛在變化����,以確保在產(chǎn)品退出過程序列時滿足產(chǎn)品質(zhì)量規(guī)范,這就是實時發(fā)布的含義���。由各種過程系統(tǒng)工程工具組成的系統(tǒng)框架���,用于開發(fā)和評估可行的控制策略,具體如圖 1 所示�。
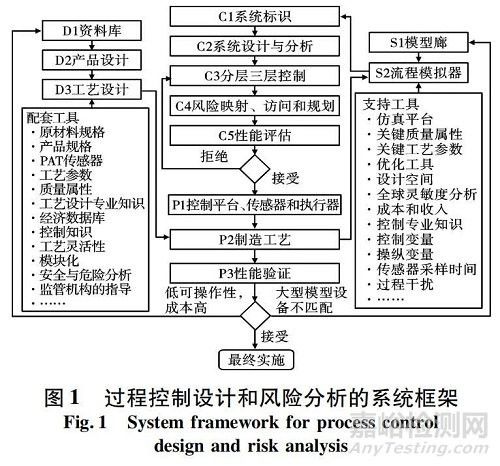
擬議的控制框架還必須與其他輔助知識和工具相結(jié)合,以促進控制戰(zhàn)略實施的軟硬件一體化。例如���,在基于從材料庫( D1) 中獲得的知識進行適當?shù)漠a(chǎn)品設(shè)計( D2) 之后�,將生成固體劑量的適當配方�,需要特定的連續(xù)制造技術(shù),即在工藝設(shè)計( D3) 中直接壓實�、干造粒或濕造粒����。然后,將使用制藥設(shè)備供應(yīng)商提供的模塊化單元操作( 進料���、混合���、壓片等)配置試驗工廠或制造工藝( P2) ,并在 P1 開發(fā)步驟中集成控制平臺和 PAT 傳感器����。由模型庫( S1) 和流程圖模擬( S2) 軟件組成的過程建模工具,通過加速工藝設(shè)計優(yōu)化和實現(xiàn)期望的控制目標�,在有效的全廠控制策略開發(fā)中發(fā)揮重要作用。例如����,基于流程圖模擬( S2) 的全局敏感性分析和系統(tǒng)識別( C1)可通過基本原理控制設(shè)計指標( 如相對增益陣列( RGA) ) 幫助識別和解決過程控制設(shè)計中的潛在挑戰(zhàn)或風險���,即分散、配對�、穩(wěn)定性、恢復(fù)力等�,在控制設(shè)計與分析( C2) 中。一個分層的 3 層過程控制設(shè)計( C3) 和風險分析( C4) 將遵循嚴格的性能評估( C5) ����。步驟 C3 到 C5 之間的迭代將繼續(xù)進行,直到實現(xiàn)滿足實時發(fā)布要求并遵守監(jiān)管指南的控制器設(shè)計���。所得到的控制設(shè)計將在制造過程( P2) 上實施����,并在步驟 P3 中進行實驗驗證�。制造工藝( P2) 的持續(xù)改進將通過提高模型預(yù)測精度或加強產(chǎn)品和工藝設(shè)計( D1 和 D2) 來實現(xiàn)�。
2、控制性能指標
除了常用的性能指標����,如用于控制整定和評估的時間絕對誤差積分( ITAE) ,圖 1 中建立了 C5 性能評估的 3 個附加性能指標,以明確地將控制性能與規(guī)范產(chǎn)品的一致性生產(chǎn)聯(lián)系起來���。如圖 2 所示�,第 1 個是時間到產(chǎn)品( T2P) ���,T2P 描述干擾從其源傳播到產(chǎn)品所需的時間量�,并且它在一個或多個CQA 中被檢測為偏差���。在連續(xù)生產(chǎn)線中���,如果在CPP 上游檢測到不可接受的干擾,則 T2P 對于確定何時開始/準備轉(zhuǎn)移不合格產(chǎn)品具有實際重要性����。
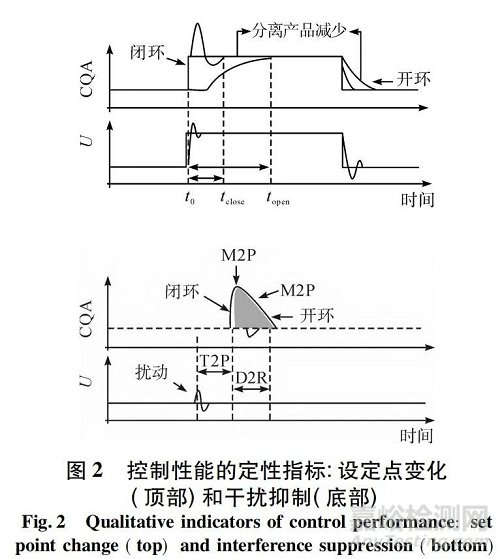
第 2 個指標,拒絕持續(xù)時間( D2R) ���,是有或沒有控制系統(tǒng)的過程消除過程干擾或達到 CQA 新設(shè)定點所需的時間長度����。較小的 D2R 是理想的���,這樣當系統(tǒng)中發(fā)生過程干擾時�,將產(chǎn)生較少數(shù)量的不合格產(chǎn)品。
第 3 個指標�,量積比( M2P) ,描述了在操作過程時CQAs 與目標設(shè)定點的最大偏差���。重要的是要限制控制動作���,以避免大的 M2P,從而使 CQA 保持在設(shè)計空間內(nèi)���。圖 2 顯示了這些性能指標的定義����,以及實施主動過程控制的潛在優(yōu)勢�,與開環(huán)操作( 即手動或無需調(diào)整以維持 CQAs) 相比,這些標準定義了更好的性能����。
對于如圖 1 所示的制造過程( P2) 中的控制設(shè)計( C2) 的性能驗證( P3) ,對于穩(wěn)定的過程�,應(yīng)達到與 CQAs 的既定驗收標準有關(guān)的統(tǒng)計控制狀態(tài)���,由于共同原因而產(chǎn)生的內(nèi)在變異性可以用過程能力( Cp 和 Cpk) 指數(shù)來衡量���。過程能力指數(shù)是一種廣泛使用的統(tǒng)計方法�,用于衡量一個過程在規(guī)范極限內(nèi)產(chǎn)生產(chǎn)出的能力���,表明一個過程相對于其規(guī)范極限所經(jīng)歷的自然變化有多大����。它可以用來作為一個指標�,以及如何控制過程。此外����,還可以使用統(tǒng)計數(shù)據(jù)分析工具確定因果關(guān)系,從工藝操作條件和原材料質(zhì)量中找出內(nèi)在可變性的根本原因����,以不斷改進和優(yōu)化當前工藝。
3����、連續(xù)固體制劑生產(chǎn)中的加料配料系統(tǒng)
連續(xù)混合是固體制劑連續(xù)生產(chǎn)的第一步,原料藥與輔料連續(xù)混合���,以滿足所需的粉末混合成分�。由于通常沒有進一步的下游步驟可以糾正混合成分,原料藥含量及其在粉末中的均勻性是這一子系統(tǒng)中必須嚴格控制的 2 個重要 CQA���。另一個需要嚴格控制的重要工藝參數(shù)是混合機出口粉末的總流量�。這一重要的 CPP 影響固體加工線的生產(chǎn)率���,當考慮到下游設(shè)備的有限滯留量時���,這一點極為重要[7-8]。目前國內(nèi)外對配料系統(tǒng)的系統(tǒng)控制系統(tǒng)設(shè)計和分析的研究較少; 下面將簡要闡述該中試設(shè)備的進料混合系統(tǒng)�,系統(tǒng)結(jié)構(gòu)如圖 3 所示。

連續(xù)制造過程的輸入包括 2 個 Schenck Accu-Rate PureFeed AP - 300 失重給料機����,它們能夠通過測量和使用組合料斗和給料機裝置中剩余粉末質(zhì)量的變化來達到和保持規(guī)定的進料速率。這是通過嵌入 0 層控制系統(tǒng)實現(xiàn)的�。喂料器將原料藥對乙酰氨基酚 ( APAP ) 和賦形劑 Avicel 微晶纖維素PH - 200( MCC 200) 連續(xù)喂料到 Gericke GCM - 500連續(xù)混 合 器 中,其 中 2 種組分混合���。操作條件( NOC) 包括 API 流量為 1.0 kg /h���,賦形劑流量為9.0 kg /h�,攪拌機轉(zhuǎn)速為 200 r/min����。使用近紅外光譜儀( Control Development����,Inc. ) 在攪拌機出口處原位測量 API 質(zhì)量分數(shù)。使用 API 質(zhì)量分數(shù)測量值在一個時間窗口內(nèi)的平均值和方差�,以相對標準偏差( RSD) 的形式對含量均勻性進行統(tǒng)計估計。使用基于 X 射線的質(zhì)量流量計( SETXvue XP - 300�,Enurga公司) 。這些設(shè)備使用 Delta V 進行集成���,這些單元操作的過程變量被傳輸?shù)皆佻F(xiàn) Delta V 系統(tǒng)���,NIR 的信號處理延遲為 2 s,X 射線的信號處理延遲為 1 s���。通過 LinkMaster 和 KepServer 軟件包建立了 OPC DA協(xié)議�,將實時過程數(shù)據(jù)從 Emerson DeltaV OPC 服務(wù)器傳輸?shù)?MATLAB���。
4�、分層 3 層控制設(shè)計
圖4 說明了建議的3 層結(jié)構(gòu)在典型的連續(xù)直接壓實過程中的應(yīng)用,作為本工作的一個例子�。一般來說,控制方法根據(jù)實現(xiàn)方法����、復(fù)雜性和處理過程干擾和風險的潛在能力分為3 個層次。0 層控制技術(shù)包括單/多回路 SISO 控制���,通常通過設(shè)備本身的可編程邏輯控制( PLC) 面板實現(xiàn)�。簡單反饋比例���、積分和微分( PID) 控制�、前饋比率控制或先進的專有 MPC 控制算法( 在高度非線性過程動力學情況下) 可在設(shè)備的 PLC 上實現(xiàn)�。該控制層通常由設(shè)備供應(yīng)商設(shè)計和提供,以控制單個/多個關(guān)鍵工藝參數(shù)�,從而保持該設(shè)備的標稱運行條件。
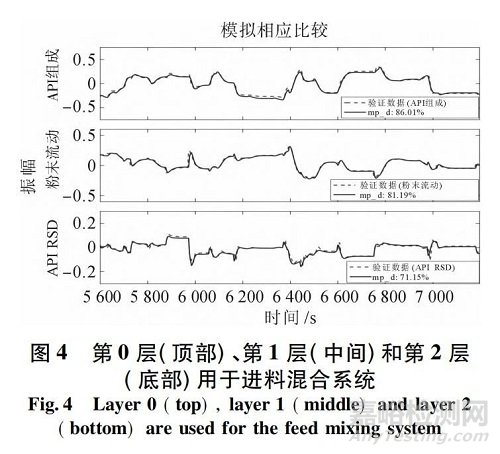
例如����,失重給料機通常配備有內(nèi)置控制回路,通過調(diào)整螺桿轉(zhuǎn)速����,將原料藥����、賦形劑或潤滑劑等成分的流速保持在所需的設(shè)定值���。在大多數(shù)情況下,1 層控制技術(shù)還涉及單回路或多回路 SISO 控制器; 然而�,這些回路依賴于 PAT工具的使用來測量和直接控制 CQA,并且可能涉及多個單元操作����。這些控制回路通常通過監(jiān)控和數(shù)據(jù)采集( SCADA) 設(shè)備執(zhí)行,例如 DCS 系統(tǒng)的商業(yè) OPC服務(wù)器���。OPC 服務(wù)器從現(xiàn)場所有單元操作設(shè)備檢索數(shù)據(jù)或向其發(fā)送命令�。例如���,它可以在第 0 層PLC 控制面板上調(diào)整 CPP 變量的設(shè)定點�。因此���,第1 層控制通常使用級聯(lián)回路來監(jiān)督第 0 層控制�,目的是實現(xiàn)關(guān)鍵質(zhì)量屬性( CQA) 的所需設(shè)置點,這些屬性由 PAT 傳感器現(xiàn)場測量���。例如����,在進料混合系統(tǒng)的情況下�,粉末配方中的原料藥成分是關(guān)鍵 CQA之一,可以通過在第 0 層控制器上操縱這些 CPP 的一個設(shè)定點來直接控制���,例如原料藥進料流量�、賦形劑進料流量或攪拌機轉(zhuǎn)速�。CQA 可與對其具有最大影響的另一 CPP 上游配對; 因此,第 1 層控制通?��?缭絾卧僮?,并使用有效的反饋/前饋控制算法設(shè)計����,以減少干擾的影響,否則可能會傳播到下游�。
5、結(jié)語
提出了一個基于風險的連續(xù)制造過程控制系統(tǒng)設(shè)計的系統(tǒng)框架����,以評價控制系統(tǒng)開發(fā)的每一步�。采用 SIMULINK 動態(tài)過程模型�,將所提出的遞階3 層控制設(shè)計方法應(yīng)用于配料系統(tǒng)。在風險圖設(shè)計的基礎(chǔ)上����,在評價 3 層控制設(shè)計時還考慮了控制性能可能惡化的潛在風險。這些案例研究證明了在連續(xù)生產(chǎn)過程中�,系統(tǒng)控制評價系統(tǒng)對于保證產(chǎn)品質(zhì)量的重要性,并強調(diào)了基于 PAT 的反饋過程控制技術(shù)在藥品連續(xù)生產(chǎn)中的應(yīng)用����。
這項工作的擴展將考慮 PAT 工具與現(xiàn)場 0 層控制的向下集成����,以確保在每個單元操作中保持一致的質(zhì)量屬性,從而要求從上游單元到下游單元的最小程度的控制干預(yù)�。這樣的設(shè)計也將減少第 1 層和第 2 層全廠控制設(shè)計的負荷,并有助于單元操作的模塊化����。例如,如果 NIR 傳感器與攪拌機集成���,則可以通過調(diào)整轉(zhuǎn)速將原料藥含量均勻性控制下載到 L0 控制面板���。研究還表明�,解耦 PID 控制回路可以有效地控制原料藥的混合均勻性����。在我們正在進行的研究中,將建議的框架應(yīng)用到完整的壓片線����。
參考文獻
[1] SU Q L,MORENO M�,GAMESH S,et al. Resilience and risk analysis of fault-tolerant process control design in continuous pharmaceutical manufacturing[J]. Journal of Loss Prevention in the Process Industries���,2018���,55: 411-422.
[2] SU Q,BOMMIREDDY Y�,GONZALEZ M,et al. Variation and risk analysis in tablet press control for continuous manufacturing of solid dosage via direct compaction[J].Computer Aided Chemical Engineering�,2018,44: 679-684.
[3] SU Q L�,GANESH S���,MORENO M,et al. A perspective on Quality-by-Control (QbC) in pharmaceutical continuous manufacturing[J]. Computers & Chemical Engineering:
An International Journal of Computer Applications in Chemical Engineering�,2019,125: 216-231.
[4] GANESH S����,SU Q,PEPKA N����,et al. Design of conditionbased maintenance framework for process operations management in pharmaceutical continuous manufacturing[J].International Journal of Pharmaceutics,2020�,587:119621.
[5] SU Q,REKLAITIS G V���,NAGY Z K. Continuous feedingblending in pharmaceutical continuous manufacturing
[M]/ /Continuous Pharmaceutical Processing. Cham:Springer,2020.
[6] SU Q L����,BOMMIREDDY Y,SHAH Y���,et al. Data reconciliation in the Quality-by-Design( QbD) implementation of pharmaceutical continuous tablet manufacturing[J]. International Journal of Pharmaceutics����,2019,563: 259-272.
[7] TIAN G����,KOOLIVAND A,GU Z���,et al. Development of an RTD-Based Flowsheet Modeling Framework for the Assessment of In-Process Control Strategies [J]. AAPSPharm Sci Tech���,2021,22( 1) : 1-10.
[8] BHASKAR A���,SINGH R. Residence time distribution
( RTD) -based control system for continuous pharmaceutical manufacturing process[J]. Journal of Pharmaceutical Innovation���,2019,14( 4) : 316-331.
[9] SU Q L���,NAGY Z K����,RIELLY C D. Pharmaceutical crystallisation processes from batch to continuous operation using MSMPR stages: Modelling���,design����,and control[J].Chemical Engineering and Processing,2015���,89: 41-53.
[10] ENGISCH W���,MUZZIO F. Using residence time distributions( RTDs) to address the traceability of raw materials in continuous pharmaceutical manufacturing[J]. Journal of Pharmaceutical Innovation,2016���,11( 1) : 64-81.





