根據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》規(guī)定��,國家對醫(yī)療器械按照風(fēng)險程度實(shí)行分類管理。進(jìn)口及港澳臺產(chǎn)品均由國家食品藥品監(jiān)督管理局管理。
一、如何確定醫(yī)療器械產(chǎn)品的類別�?
1、網(wǎng)頁查詢:進(jìn)入國家藥監(jiān)局網(wǎng)站---點(diǎn)擊醫(yī)療器械標(biāo)題欄---點(diǎn)擊企業(yè)查詢---點(diǎn)擊醫(yī)療器械分類目錄
2����、查詢文件:查詢《醫(yī)療器械分類規(guī)則》或《醫(yī)療器械分類目錄》(2017年第104號)
3、申請分類界定:境內(nèi)產(chǎn)品向當(dāng)?shù)厥【痔峤簧暾?�,進(jìn)口產(chǎn)品向醫(yī)療器械標(biāo)準(zhǔn)管理研究所提交申請
4����、同第三類申報:可直接按第三類醫(yī)療器械產(chǎn)品申報�,器審中心根據(jù)申報產(chǎn)品的實(shí)際情況判定類別
5、創(chuàng)新��、優(yōu)先��、藥械組合:在申請完相應(yīng)的流程后����,可隨即進(jìn)行產(chǎn)品類別確定。
二����、醫(yī)療器械分類規(guī)則?
(一)有關(guān)用語含義:
1����、預(yù)期目的:指產(chǎn)品說明書�、標(biāo)簽或者宣傳資料載明的�,使用醫(yī)療器械應(yīng)當(dāng)取得的作用。
2�、無源醫(yī)療器械:不能依靠電能或者其他能源,但是可以通過由人體或者重力產(chǎn)生的能量�,發(fā)揮其功能的醫(yī)療器械。
3�、有源醫(yī)療器械:任何依靠電能或者其他能源,而不是直接由人體或者重力產(chǎn)生的能量�,發(fā)揮其功能的醫(yī)療器械。
4��、侵入器械:借助手術(shù)全部或者部分通過侵入人體����,接觸體內(nèi)組織����、血液循環(huán)系統(tǒng)、中樞神經(jīng)系統(tǒng)等部位的醫(yī)療器械����,包括介入手術(shù)中使用的器材�、一次性使用無菌手術(shù)器械和暫時或短期留在人體內(nèi)的器械等�。
5、重復(fù)使用手術(shù)器械:用于手術(shù)進(jìn)行切�、割、鉆����、鋸��、抓��、刮�、鉗����、抽�、夾等過程,不連接任何有源醫(yī)療器械��,通過一定的處理可以重新使用的無源醫(yī)療器械����。
6、植入器械:借助手術(shù)全部或者部分進(jìn)入人體內(nèi)或腔道(口)中��,或者用于替代人體上皮表面或眼表面����,并且在手術(shù)過程結(jié)束后留在人體內(nèi)30日(含)以上或者被人體吸收的醫(yī)療器械。
7�、接觸人體器械:直接或間接接觸患者或者能夠進(jìn)入患者體內(nèi)的醫(yī)療器械��。
8�、使用時限:
1)連續(xù)使用:醫(yī)療器械按預(yù)期目的����、不間斷的實(shí)際作用時間;
2)暫時:醫(yī)療器械預(yù)期的連續(xù)使用時間在24小時以內(nèi)��;
3)短期:醫(yī)療器械預(yù)期的連續(xù)使用時間在24小時(含)以上����、30日以內(nèi)����;
4)長期:醫(yī)療器械預(yù)期的連續(xù)使用時間在30日(含)以上。
9�、皮膚:未受損的皮膚表面
10��、腔道(口):口腔��、鼻腔��、食道����、外耳道�、直腸�、陰道、尿道等人體自然腔道和永久性人造開口
11��、創(chuàng)傷:各種致傷因素作用于人體所造成的組織結(jié)構(gòu)完整性破壞或者功能障礙
12、組織:人體體內(nèi)組織����,包括骨�、牙髓�、或者牙本質(zhì)�,不包括血液循環(huán)系統(tǒng)和中樞神經(jīng)系統(tǒng)�。
13�、血液循環(huán)系統(tǒng):血管(毛細(xì)血管除外)、心臟
14�、中樞神經(jīng)系統(tǒng):腦和脊髓
15�、獨(dú)立軟件:具有一個或多個醫(yī)療目的,無需醫(yī)療器械硬件即可完成自身預(yù)期目的��,運(yùn)行于通用計算平臺的軟件��。
16�、具有計量測試功能的醫(yī)療器械:用于測定生理��、病理��、解剖參數(shù)����,或者定量測定進(jìn)出人體的能量或物質(zhì)的醫(yī)療器械��,其測量結(jié)果需要精確定量��,并且該結(jié)果的準(zhǔn)確性會對患者的健康和安全產(chǎn)生明顯影響�。
17、慢性創(chuàng)面:各種原因形成的長期不愈合創(chuàng)面����,如靜脈潰瘍、動脈性潰瘍��、糖尿病性潰瘍��、創(chuàng)傷性潰瘍��、壓力性潰瘍等�。
(二)醫(yī)療器械分類判定表
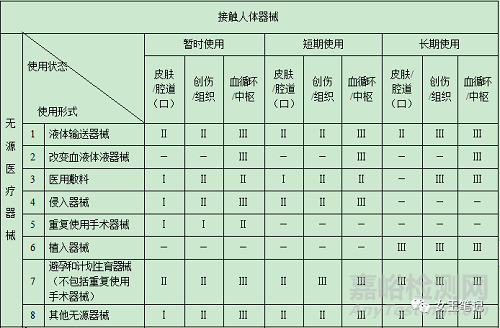
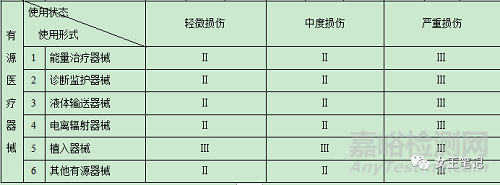
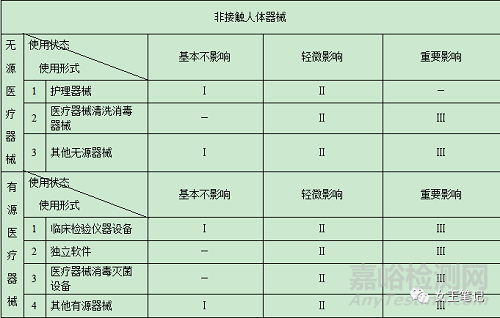
(三)有以下情形的,醫(yī)療器械分類時還應(yīng)當(dāng)參考下述原則:
1����、如果同一醫(yī)療器械適用兩個或兩個以上的分類,應(yīng)當(dāng)采取其中風(fēng)險程度最高的分類�;由多個醫(yī)療器械組成的醫(yī)療器械包,其分類應(yīng)當(dāng)與包內(nèi)風(fēng)險程度最高的保持一致����。
2、可作為附件的醫(yī)療器械����,起分類應(yīng)當(dāng)綜合考慮該附件對配套主體醫(yī)療器械的安全性、有效性的影響�;如果附件對配套主體醫(yī)療器械有重要影響,福建的分類應(yīng)不低于配套主體醫(yī)療器械的分類�。
3、監(jiān)控或者影響醫(yī)療器械主要功能的醫(yī)療器械�,其分類應(yīng)當(dāng)與被監(jiān)控、影響的醫(yī)療器械分類一致�。
4、以醫(yī)療器械為主的藥械組合產(chǎn)品�,按照第三類醫(yī)療器械管理。
5����、可被人體吸收的醫(yī)療器械��,按照第三類醫(yī)療器械管理��。
6�、對醫(yī)療效果有重要影響的有源接觸人體器械,按照第三類醫(yī)療器械管理��。
7��、醫(yī)用敷料如果有以下情形��,按照第三類醫(yī)療器械管理,包括:預(yù)期具有防組織或器官粘連功能�,作為人工皮膚,接觸真皮深層或其以下組織受損的創(chuàng)面�,用于慢性創(chuàng)面,或者可被人體全部或部分吸收的�。
8、以無菌形式提供的醫(yī)療器械����,其分類不應(yīng)低于第二類�。
9、通過牽拉��、撐開�、扭轉(zhuǎn)����、壓握��、彎曲等作用方式����,主動施加持續(xù)作用力于人體����、可動態(tài)調(diào)整肢體固定位置的矯形器械(不包括僅具有固定、支撐作用的醫(yī)療器械�,也不包括配合外科手術(shù)中進(jìn)行臨時矯形的醫(yī)療器械或者外科手術(shù)后或其他治療中進(jìn)行四肢矯形的醫(yī)療器械),其分類應(yīng)不低于第二類�。
10、具有計量測試功能的醫(yī)療器械��,其分類應(yīng)不低于第二類
11�、如果醫(yī)療器械的預(yù)期目的是明確用于某種疾病的治療,其分類應(yīng)不低于第二類��。
12��、用于內(nèi)窺鏡下完成夾取��、切割組織或者取石等手術(shù)操作的無源重復(fù)使用手術(shù)器械,按照第二類醫(yī)療器械管理�。
13、體外診斷試劑按照有關(guān)規(guī)定分類
三�、怎么申請分類界定?
(一) 適用于新研制的尚未列入《分類目錄》或分類界定通知等文件的醫(yī)療器械是指在我國境內(nèi)上市的全新產(chǎn)品��; 或者與已上市的產(chǎn)品相比�,產(chǎn)品的技術(shù)原理、結(jié)構(gòu)組成�、使用部位或技術(shù)特點(diǎn)、預(yù)期目的等發(fā)生了影響產(chǎn)品分類的實(shí)質(zhì)性變化��,根據(jù)《分類目錄》或分類界定通知等相關(guān)文件難以確定管理類別的醫(yī)療器械�。
(二)流程
1、申請人通過中國食品藥品檢定研究院(國家食品藥品監(jiān)督管理總局醫(yī)療器械標(biāo)準(zhǔn)管理中心)網(wǎng)站進(jìn)入“醫(yī)療器械標(biāo)準(zhǔn)管理研究所”二級網(wǎng)站的“醫(yī)療器械分類界定信息系統(tǒng)”頁面�,注冊后填寫《分類界定申請表》�,并上傳其他申請材料。
在線打印《分類界定申請表》及其他上傳的申請材料����。加蓋申請企業(yè)騎縫章,寄送至省級食品藥品監(jiān)督管理單位�,進(jìn)口及港澳臺產(chǎn)品直接寄送至國家食品藥品監(jiān)督管理總局醫(yī)療器械標(biāo)管中心(北京市大興區(qū)生物醫(yī)藥產(chǎn)業(yè)基地華佗路31號院4號樓B104房間��,編號:102629)。
由省級食藥監(jiān)管理部門負(fù)責(zé)對申請人提出的產(chǎn)品分類界定進(jìn)行審查�,經(jīng)綜合判定確定類別或提出預(yù)分類界定意見�。
標(biāo)管中心應(yīng)當(dāng)自其受理分類界定申請之日起20個工作日內(nèi)完成類別確認(rèn)工作��。需要補(bǔ)充資料的,申請人應(yīng)當(dāng)在30個工作日內(nèi)按照補(bǔ)正要求一次提供補(bǔ)充資料�。補(bǔ)充資料及專家研討所需時間不算在內(nèi)。
(三)申請分類資料
1����、分類界定申請表
2、產(chǎn)品照片和/或產(chǎn)品結(jié)構(gòu)圖
3����、產(chǎn)品技術(shù)要求及產(chǎn)品說明書(樣稿)
4、進(jìn)口上市證明材料(如適用)
5��、資料真實(shí)性自我保證聲明
6�、其他與產(chǎn)品分類界定有關(guān)的材料。其中對于尚未列入《分類目錄》等文件的新研制產(chǎn)品����,至少還應(yīng)提交:
1)與國外已上市相關(guān)產(chǎn)品����、《分類目錄》或分類界定通知文件中相關(guān)產(chǎn)品的分析及對比�,并說明符合新研制的尚未列入分類目錄產(chǎn)品的判定依據(jù)。
2)核心刊物公開發(fā)表的能夠充分說明產(chǎn)品臨床應(yīng)用價值的學(xué)術(shù)論文��、專著及文件綜述(如有)
3)產(chǎn)品的創(chuàng)新內(nèi)容
4)信息或者專利機(jī)構(gòu)出具的查新報告����。
所申請資料應(yīng)當(dāng)使用中文��。根據(jù)外文翻譯的��,應(yīng)當(dāng)同時提供原文。




