固體劑型連續(xù)制造( CM) 中,物料通過(guò)完全集成設(shè)備的裝配線��,節(jié)省操作時(shí)間并降低人為錯(cuò)誤發(fā)生的可能性����,已逐漸發(fā)展成為藥物產(chǎn)品的優(yōu)選平臺(tái)�。歐美藥品監(jiān)督管理機(jī)構(gòu)已批準(zhǔn)了數(shù)個(gè)商業(yè)化連續(xù)生產(chǎn)的藥品,其生產(chǎn)工藝控制策略的要素是采用科學(xué)框架來(lái)尋找降低制造過(guò)程發(fā)生變異的風(fēng)險(xiǎn)�����。過(guò)程分析技術(shù)( PAT) 監(jiān)控方法可實(shí)時(shí)控制產(chǎn)品質(zhì)量,促進(jìn)制造的持續(xù)改進(jìn)和創(chuàng)新����,從而實(shí)現(xiàn)先進(jìn)過(guò)程控制和產(chǎn)品的實(shí)時(shí)放行。其最終目標(biāo)是以更高效和更低的成本將更安全的藥品迅速推向市場(chǎng)����,實(shí)現(xiàn)制藥工業(yè) 4.0 數(shù)據(jù)化及過(guò)程控制系統(tǒng)集成的目標(biāo)。本文探討了過(guò)程分析技術(shù)在實(shí)施連續(xù)制造工藝中的模型分類(lèi)與風(fēng)險(xiǎn)考慮�����,先進(jìn)控制策略、當(dāng)今監(jiān)管法規(guī)關(guān)注重點(diǎn)和可能面臨的施行挑戰(zhàn)�,并介紹歐美制藥企業(yè)基于連續(xù)制造的上市新藥審批結(jié)果與 PAT 應(yīng)用項(xiàng)目���。
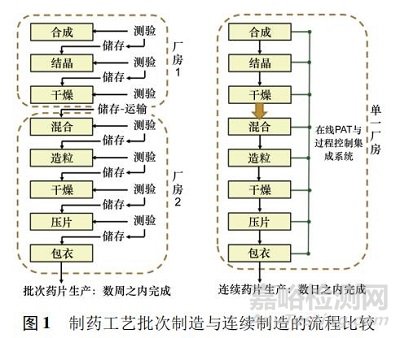
傳統(tǒng)上國(guó)內(nèi)藥品制造一直非常保守,即使高度專(zhuān)業(yè)化的產(chǎn)品生產(chǎn)���,老式的批量( batch manufacturing)加工模式仍然占據(jù)主導(dǎo)地位。批量制造是一個(gè)多步驟的過(guò)程,其中在每個(gè)工藝步驟之后����,生產(chǎn)通常會(huì)暫停以測(cè)試樣品的質(zhì)量,有時(shí)物料可以?xún)?chǔ)存在容器中或運(yùn)送到另一個(gè)設(shè)施以完成下一步制造���。因此處理時(shí)間可能會(huì)數(shù)周,甚至數(shù)月,并且還有可能給對(duì)環(huán)境敏感的活性藥物成分( active pharmaceutical ingredients�,API) 帶來(lái)質(zhì) 量風(fēng)險(xiǎn)����。相比之下,連續(xù)制造( continuous manufacturing���,CM) 是在同一設(shè)施內(nèi)實(shí)現(xiàn)不間斷藥物制造的過(guò)程,各步驟之間沒(méi)有停頓,并且消除了分離中間體的程序�。在連續(xù)制造中,物料通過(guò)完全集成設(shè)備的裝配線,節(jié)省操作時(shí)間并降低人為錯(cuò)誤發(fā)生的可能性。連續(xù)制造還具有額外的優(yōu)點(diǎn),包括自動(dòng)監(jiān)控所涉及的各個(gè)設(shè)備���,在故障發(fā)生之前進(jìn)行檢測(cè)問(wèn)題并實(shí)時(shí)監(jiān)控��。制藥行業(yè)現(xiàn)在也開(kāi)始尋求連續(xù)制造藥品的優(yōu)勢(shì)。在連續(xù)制造中����,生產(chǎn)成品藥品所需的所有單元操作都在一個(gè)車(chē)間內(nèi)進(jìn)行,即單一控制系統(tǒng)。而傳統(tǒng)的批量制造則是各種操作工藝���,如混合����、稱(chēng)重�、壓片和包衣,是在不同的時(shí)間點(diǎn)及不同的車(chē)間進(jìn)行��,見(jiàn)圖 1���。
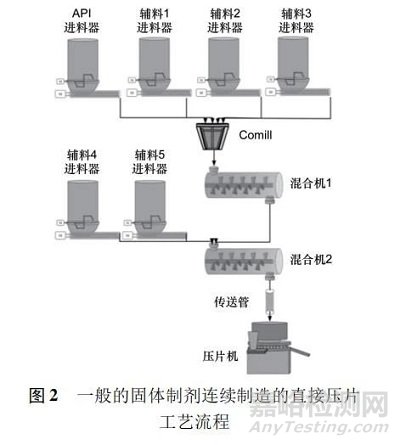
食品����、化學(xué)和石化行業(yè)早已采用了高效的連續(xù)化技術(shù)來(lái)安全地生產(chǎn)其產(chǎn)品�。在制藥領(lǐng)域���,若實(shí)施連續(xù)制造作為一種常規(guī)方法,則需要相關(guān)行業(yè)、監(jiān)管機(jī)構(gòu)����、學(xué)術(shù)機(jī)構(gòu)和設(shè)備制造商之間的充分了解與合作。依據(jù)美國(guó) FDA 的定義,“連續(xù)制造”工藝是指物料連續(xù)地投入并在工藝中完成轉(zhuǎn)換,同時(shí)加工后的物料被連續(xù)地從系統(tǒng)中移除。雖然該描述可以應(yīng)用于單個(gè)操作工序或由一系列操作工序組成的制造過(guò)程,但連續(xù)制造是由一系列 2 個(gè)或更多操作工序組成的整體工藝[1]。美國(guó)聯(lián)邦法 21 CFR 210. 3 中定義批次為特定數(shù)量的藥物或其他物料,預(yù)期在指定的限制內(nèi)具有均勻的特性和質(zhì)量��,并在同一制造周期內(nèi)根據(jù)單一制造訂單生產(chǎn); 因此美國(guó) FDA 認(rèn)為批次是指物料的數(shù)量�,并未指定制造方式�。由此可見(jiàn)��,連續(xù)生產(chǎn)的規(guī)??梢罁?jù)生產(chǎn)時(shí)間而不是由設(shè)備尺寸決定的���。一般情況下連續(xù)制造可長(zhǎng)期運(yùn)行到120 h,運(yùn)行期間以 50 kg·h - 1的定額流量��,實(shí)現(xiàn)制造6 000 kg 的成品,約等同1 500 萬(wàn)片主要成分為400 mg的片劑�����。事實(shí)上一些制藥設(shè)備本身已是以連續(xù)運(yùn)行為主���,如制劑的壓片機(jī)和連續(xù)化發(fā)酵罐。但濕式制粒機(jī)��、包衣機(jī)及化學(xué)合成反應(yīng)等其他設(shè)備或產(chǎn)品必須進(jìn)行改造以便符合連續(xù)生產(chǎn)���。圖 2 顯示的是典型固體制劑連續(xù)制造的直接壓片工藝流程��。
連續(xù)制造為制藥行業(yè)的改進(jìn)與創(chuàng)新提供了多種機(jī)會(huì)�,包括: ① 具有精簡(jiǎn)步驟的集成過(guò)程( 例如更安全����、更快響應(yīng)時(shí)間、更高效�����、更短時(shí)間) �����。② 體積小巧的設(shè)備( 例如可能更小量 API 的要求、更高的操作靈活性��、更低的成本和更加環(huán)保的優(yōu)勢(shì)) ���。③ 先進(jìn)的產(chǎn)品開(kāi)發(fā)方法( 基于質(zhì)量源于設(shè)計(jì)) 。④ 實(shí)時(shí)獲得產(chǎn)品質(zhì)量信息����。⑤ 更容易改變規(guī)模以適應(yīng)供應(yīng)需求��。由此可見(jiàn)��,連續(xù)制造能夠確保時(shí)間����、金錢(qián)和物料的最少浪費(fèi)�。物料沒(méi)有等待時(shí)間����,并且在此過(guò)程中不會(huì)停止運(yùn)送。作為連續(xù)制造的產(chǎn)品數(shù)量可以通過(guò)時(shí)間戳���、產(chǎn)生的物料量或使用的物料量來(lái)定義���,因此比批量生產(chǎn)更具效益����,主要是連續(xù)制造可以更準(zhǔn)確地跟蹤產(chǎn)品流,從而實(shí)現(xiàn)質(zhì)量控制����,以精確定位和隔離確切的缺陷物料[2 - 4]。
然而在常規(guī)化操作過(guò)程中�����,連續(xù)投入的物料屬性����、工藝條件或環(huán)境因素可能存在瞬時(shí)工藝波動(dòng)�,因此實(shí)時(shí)監(jiān)測(cè)質(zhì)量屬性與調(diào)整操作參數(shù)極為關(guān)鍵����。依據(jù)美國(guó) FDA 建議在連續(xù)制造過(guò)程中必須制定控制策略,制造商應(yīng)考慮連續(xù)生產(chǎn)工藝中預(yù)期和發(fā)生意外的變化[1]�。其中控制策略的定義為對(duì)當(dāng)前產(chǎn)品和對(duì)工藝?yán)斫獾囊幌盗杏?jì)劃的控制措施,可確保工藝性能和產(chǎn)品質(zhì)量���。因此控制包括原料藥和藥物制劑物料與組分相關(guān)的參數(shù)和特性�����、工藝和設(shè)備的運(yùn)行條件�����、在線控制���、成品質(zhì)量標(biāo)準(zhǔn)以及相關(guān)方法和監(jiān)測(cè)與控制頻率等(參考ICHQ10件) 。而 FDA 鼓勵(lì)的過(guò)程分析技術(shù)( process analytical technology�����,PAT) 就是通過(guò)實(shí)時(shí)監(jiān)控和過(guò)程控制策略使具有預(yù)定質(zhì)量屬性的產(chǎn)品達(dá)到一致性[5 - 6]。
具體內(nèi)容包括滿(mǎn)足關(guān)鍵質(zhì)量屬性( critical quality attribute�����,CQA) 的標(biāo)準(zhǔn)來(lái)確保所需產(chǎn)品質(zhì)量的性質(zhì); 進(jìn)一步監(jiān)控會(huì)影響質(zhì)量屬性的關(guān)鍵過(guò)程參數(shù)( critical process parameter�����,CPP) 以確保生產(chǎn)出期望質(zhì)量的產(chǎn)品�����。而這些變量均是設(shè)計(jì)控制策略所必須考慮的重點(diǎn)��。實(shí)施 PAT 可進(jìn)一步促成連續(xù)制造����,具體包括: ① 集成化����,提供關(guān)鍵過(guò)程測(cè)量以集成到在線控制系統(tǒng)中。② 數(shù)據(jù)化����,借由收集數(shù)據(jù)可詳細(xì)理解過(guò)程性能,協(xié)助工藝改進(jìn)和建立模型。③ 控制化����,實(shí)現(xiàn)異常事件的早期診斷與實(shí)時(shí)控制。而過(guò)程分析技術(shù)在連續(xù)制造上的應(yīng)用擴(kuò)展����,可進(jìn)階到產(chǎn)品實(shí)時(shí)放行( real time release) 決策,符合 FDA 和 ICH Q8 指南鼓勵(lì)實(shí)時(shí)放行測(cè)試( realtime release testing����,RTRT) 方法的期待。因此從實(shí)踐意義上��,連續(xù)制造技術(shù)要求在整個(gè)產(chǎn)品生命周期中采用全面的整體控制策略�,以可重復(fù)性和一致性的標(biāo)準(zhǔn)確保在產(chǎn)品放行時(shí)和整個(gè)產(chǎn)品保質(zhì)期內(nèi)符合預(yù)期產(chǎn)品質(zhì)量[7 - 8]。因此基于過(guò)程分析技術(shù)在連續(xù)制造技術(shù)的控制策略及其關(guān)鍵性已從傳統(tǒng)制藥生產(chǎn)上“可有可無(wú)”升級(jí)到“必須配置”的層級(jí)上�����。
一����、連續(xù)制造中的過(guò)程分析技術(shù)
1、工具考慮
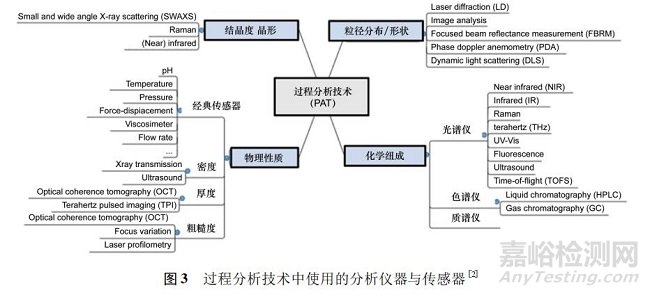
過(guò)程分析技術(shù)框架體系中要求實(shí)現(xiàn)快速采集信息���、增強(qiáng)工藝?yán)斫?�、?shí)施連續(xù)改進(jìn)和降低風(fēng)險(xiǎn)[5]; 建議工具包括: ① 多元數(shù)學(xué)統(tǒng)計(jì)手段( 如實(shí)驗(yàn)統(tǒng)計(jì)設(shè)計(jì)�����、響應(yīng)曲面法���、過(guò)程模擬和模式識(shí)別軟件) 的應(yīng)用及對(duì)產(chǎn)品和過(guò)程變量進(jìn)行鑒定和評(píng)價(jià)的多元統(tǒng)計(jì)工具( 如化學(xué)計(jì)量學(xué)) ����。② 光譜儀器����,如近紅外、中紅外���、拉曼光譜、質(zhì)譜和高速色譜等�����,無(wú)損檢測(cè)并能提供待加工物料的生物學(xué)����、物理特性及化學(xué)特性有關(guān)信息的過(guò)程分析儀器( 見(jiàn)圖 3) ��。③ 保證對(duì)所有關(guān)鍵質(zhì)量屬性的有效控制���,包含過(guò)程監(jiān)測(cè)和控制策略的過(guò)程控制手段。④ 連續(xù)改進(jìn)和知識(shí)管理�����。通過(guò)對(duì)數(shù)據(jù)采集和分析得到的知識(shí)積累���,可作為批準(zhǔn)后工藝變動(dòng)的建議與評(píng)價(jià)依據(jù)�。由此可見(jiàn)����,PAT 項(xiàng)目開(kāi)展必須是“軟( 件) 硬( 件) 兼施”。在固體制劑連續(xù)制造中多半采用快速近紅外( 如二極管陣列) 與拉曼光譜儀; 而 API 合成的流動(dòng)化學(xué)上�����,則多半運(yùn)用中紅外����、拉曼光譜儀或小型核磁共振儀等��。在工具安裝時(shí)也須評(píng)估流量擾動(dòng)時(shí)測(cè)量時(shí)間與流量差距�、探頭的數(shù)量與位置����、探頭失效或探頭維護(hù)等多種因素。一般 PAT 信號(hào)受可變流量和粉末密度影響���,使得準(zhǔn)確計(jì)算移動(dòng)粉末的效力非常具有挑戰(zhàn)性�。長(zhǎng)時(shí)間( 通常為 3 ~ 5 d) 的連續(xù)測(cè)量需要儀器具有高度基線穩(wěn)定性和特殊探頭技術(shù)以防止粉末在探頭上積聚�����。
2����、動(dòng)態(tài)采樣挑戰(zhàn)
在美國(guó) FDA 推出使用過(guò)程分析技術(shù)用于藥品制造的倡議之后,創(chuàng)新傳感技術(shù)在過(guò)去幾年中激增���。然而這些技術(shù)的開(kāi)發(fā)大部分是基于批量生產(chǎn)�,且以生產(chǎn)粉末物料或最終產(chǎn)品是靜態(tài)并且可以多次測(cè)量為主�。將過(guò)程分析技術(shù)納入藥物生產(chǎn)的連續(xù)過(guò)程���,其挑戰(zhàn)主要在于必須將傳感器/分析儀重新配置到連續(xù)框架中���,且粉末或液體流是以動(dòng)態(tài)形式呈現(xiàn)���,而如何實(shí)現(xiàn)動(dòng)態(tài)測(cè)量及使抽樣具有代表性是必須重視的難題。如何改造設(shè)備以便使過(guò)程分析技術(shù)設(shè)備收集到正確的數(shù)據(jù)是連續(xù)制造面對(duì)的重點(diǎn)考慮之一�。一些簡(jiǎn)單測(cè)量( 如流量、壓力和溫度) 可較容易從線上傳感器獲得�����。其他一些復(fù)雜的測(cè)量�����,需要有創(chuàng)新性的設(shè)計(jì)��,如在線近紅外光譜( near infrared�,NIR) 測(cè)量時(shí),須改造采樣探頭與處理設(shè)備的物理接口�。圖 4 示范在線近紅外探頭可大面積窗口測(cè)量粉末的混合均勻性。
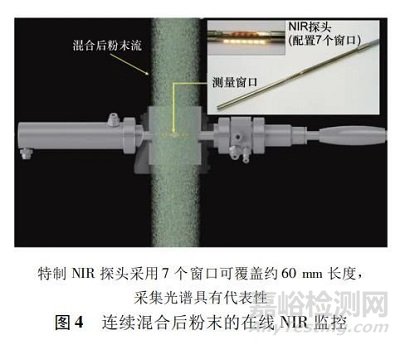
基本上采樣探頭在測(cè)量任何物料的主要成分時(shí)必須考慮以下幾項(xiàng)關(guān)鍵重點(diǎn): ① 避免物料覆蓋到測(cè)量探頭窗口���。② 確定實(shí)際測(cè)量樣本量��,例如在收集光譜期間測(cè)量的粉末取樣重量或體積����。③ 優(yōu)化探頭的裝設(shè)位置,確定探頭不會(huì)阻擋或影響粉末流; 同時(shí)應(yīng)該放置在可測(cè)量到移動(dòng)粉末流�,而不是只測(cè)到黏著在漏斗壁上的粉末( 即當(dāng)發(fā)生流動(dòng)通道) 。④ 選定取樣量或頻率應(yīng)具代表性�����,采用適當(dāng)?shù)慕y(tǒng)計(jì)方法證明采樣與其衍生方法的分析合理性( 如置信度和覆蓋范圍) �。當(dāng)前 PAT 所需探頭可商業(yè)化訂制,一般粉末包覆探頭的解決方案包括自動(dòng)刮除���、空氣吹掃或自動(dòng)清洗等���。使用者可以通過(guò)針對(duì)消除附著探頭窗口的解決方案來(lái)提高其在線檢測(cè)效率。Sierra Vegaa 等[9]在最近研究中��,使用 NIR 法評(píng)估連續(xù)直接壓片工藝混合均勻性的取樣位置����。該研究包括開(kāi)發(fā) 2 種在線偏最小二乘( partial least square,PLS) 校正模型�����,一種是在混合過(guò)程后的過(guò)渡滑槽中���,另一種是在壓片機(jī)的進(jìn)料架中。實(shí)驗(yàn)結(jié)果表明�,在連續(xù)攪拌器的旋轉(zhuǎn)速度下,粉末的藥物濃度明顯受到影響����。滑槽中的粉末均勻性不能代表片劑的含量均勻性��。該研究證明了進(jìn)料架內(nèi)的混合效應(yīng)有助于降低粉末混合物的不均勻性�。
在線光譜分析時(shí)對(duì)于預(yù)測(cè)模型的優(yōu)化,多傾向采用大樣本量的統(tǒng)計(jì)建模方法來(lái)改進(jìn)����。然而在建模過(guò)程中為了降低主要成分藥品的消耗,避免大生產(chǎn)的額外資源浪費(fèi)����,可考慮采用更多的可變通方案建立穩(wěn)健模型。例如美國(guó)禮來(lái)公司 Hetrick 與 Shi 等為了更有效開(kāi)發(fā) NIR 定量 API 的 PLS 校正模型,創(chuàng)新開(kāi)發(fā)了使用小尺度“離線進(jìn)料架桌”的方法收集更具代表性的校準(zhǔn)光譜�。據(jù)估計(jì)進(jìn)料架桌上進(jìn)行校準(zhǔn)可達(dá)到相同的模型穩(wěn)健性,但所消耗的活性藥物成分比完整的 CM 工藝設(shè)備上進(jìn)行校準(zhǔn)時(shí)減少 95%���。
此外��,借著模擬整個(gè)連續(xù)制造過(guò)程中壓片機(jī)進(jìn)料架中粉末差異�����,可獲取影響連續(xù)制造過(guò)程設(shè)備預(yù)期的動(dòng)態(tài)變化���。該文進(jìn)一步描述了各種光譜預(yù)處理方法對(duì)多變量模型的誤差統(tǒng)計(jì)的影響。進(jìn)料架桌方法成功用于連續(xù)藥品生產(chǎn)過(guò)程中壓片機(jī)進(jìn)料架的過(guò)程監(jiān)控��,證明了光譜監(jiān)測(cè)中的小尺度進(jìn)料架桌與完整大生產(chǎn)連續(xù)制造過(guò)程之間的等效性[10]�。
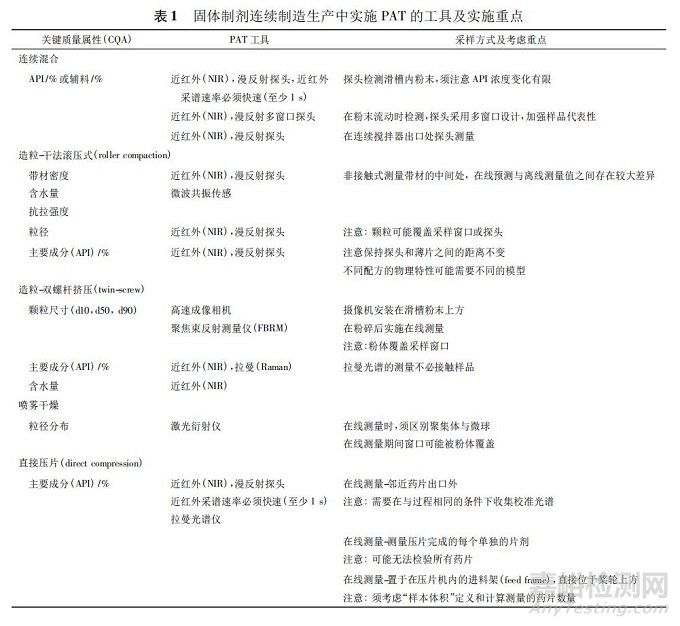
3、模型的分類(lèi)與風(fēng)險(xiǎn)考慮連續(xù)制造過(guò)程變化性
源于 CPP 和關(guān)鍵物料屬性( critical material attribute���,CMA) ��,這些變化將影響 CQA 和整體過(guò)程性能�。完全實(shí)現(xiàn)理解工藝的特性�,包括區(qū)別和解釋產(chǎn)生可變性的所有關(guān)鍵來(lái)源�����,過(guò)程中能控制可變性及根據(jù)所用物料�、工藝流程參數(shù)��、生產(chǎn)���、環(huán)境和其他情況所建立的設(shè)計(jì)范圍,可促成準(zhǔn)確且可靠地預(yù)測(cè)出產(chǎn)品質(zhì)量屬性[11]����。在固體制劑連續(xù)制造上�����,事先鑒別各單元操作的原料與質(zhì)量屬性以及相對(duì)應(yīng)的操作條件為重點(diǎn)( 見(jiàn)圖 5) ��。表 1 列出固體制劑連續(xù)制造生產(chǎn)中實(shí)施 PAT 的工具及實(shí)施重點(diǎn)��。如何具體從關(guān)鍵物料屬性��、CPP 與 PAT 數(shù)據(jù)中預(yù)測(cè)關(guān)鍵質(zhì)量屬性并立即做出控制決定是關(guān)鍵����,而且能夠兼顧預(yù)測(cè)模型理論、開(kāi)發(fā)流程與驗(yàn)證原則的正確性�。如果設(shè)計(jì)適當(dāng),穩(wěn)健及可靠的模型預(yù)測(cè)可以使得工藝過(guò)程始終保持在受控狀態(tài)�����。一般作為控制策略的模型有 3 種類(lèi)別: 機(jī)理模型��、經(jīng)驗(yàn)?zāi)P秃蛢烧呓Y(jié)合的混合模型���。
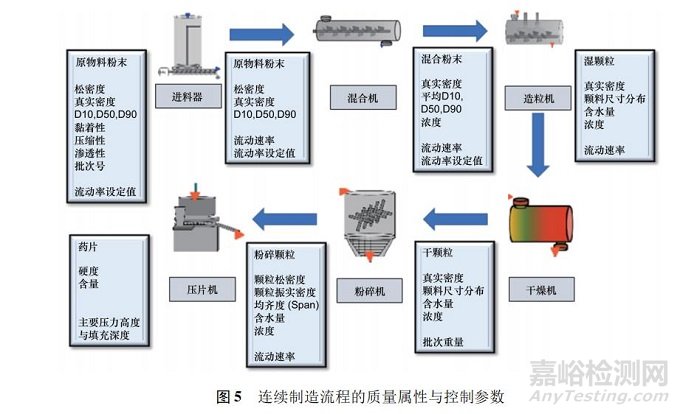
在連續(xù)制造領(lǐng)域中�,可以見(jiàn)到這 3 種模型均有應(yīng)用�����。機(jī)理模型是以科學(xué)依據(jù)理解變量之間關(guān)系���,可用于識(shí)別和表征 CPP 和質(zhì)量屬性的變化��。建模以決定性演算為主,以第一原則�、基礎(chǔ)理論或基于物理原理為依據(jù)。一般多采用總體平衡模型( population balance model) ���,配合停留時(shí)間分布( residence time distribution) 的計(jì)算判斷���,可用于測(cè)量連續(xù)混料器中的粉體流量與控制物料均勻分布�����。經(jīng)驗(yàn)?zāi)P蛣t是通過(guò)經(jīng)驗(yàn)認(rèn)識(shí)關(guān)系,建模以數(shù)據(jù)為依據(jù)��,工具包括統(tǒng)計(jì)分析���、實(shí)驗(yàn)設(shè)計(jì)���、多變量分析與機(jī)器學(xué)習(xí)。典型的例子是運(yùn)用 NIR 結(jié)合工藝過(guò)程監(jiān)測(cè)的多變量數(shù)據(jù)分析模型���。而混合式模型結(jié)合了機(jī)理模型�����,配合經(jīng)驗(yàn)式化學(xué)計(jì)量學(xué)模型���。開(kāi)發(fā)模型時(shí)須依據(jù)科學(xué)合理的原則和條件�����,并能夠反映常規(guī)商業(yè)化大生產(chǎn)的規(guī)模���。一般應(yīng)用在連續(xù)制造的 PAT 模型多為中影響( 如中控) 或高影響模型( 如實(shí)時(shí)放行測(cè)試) [3]。注意傳統(tǒng)的建模策略可能需要仔細(xì)評(píng)估�,尤其是樣品的代表性,例如���,在動(dòng)態(tài)流動(dòng)條件下���,無(wú)法將單一測(cè)量點(diǎn)的 NIR 數(shù)據(jù)與總體取樣參考樣品的液相分析結(jié)果相關(guān)聯(lián)�����。
4�����、 過(guò)程監(jiān)控的控制策略與實(shí)時(shí)放行
制藥生產(chǎn)過(guò)程必須配合有效的控制策略,其目的是取得投入物料����、中間體和成品中監(jiān)控工藝參數(shù)和屬性的實(shí)時(shí)信息,并在物料移送中可以檢測(cè)瞬時(shí)干擾和工藝偏差�����,實(shí)現(xiàn)更準(zhǔn)確主動(dòng)工藝控制����,降低這些潛在干擾產(chǎn)品質(zhì)量的風(fēng)險(xiǎn)。美國(guó) FDA 的 Lee 等[3]在討論連續(xù)制造的質(zhì)量重點(diǎn)中����,具體說(shuō)明了 3 種不同等級(jí)的控制策略����。
一級(jí)控制為主動(dòng)性自動(dòng)控制。利用過(guò)程控制系統(tǒng)實(shí)時(shí)監(jiān)控物料的質(zhì)量屬性����。自動(dòng)調(diào)整過(guò)程參數(shù)反應(yīng)干擾,確保質(zhì)量屬性始終符合既定的驗(yàn)收標(biāo)準(zhǔn)���。例如�,NIR 混合監(jiān)測(cè)并反饋控制進(jìn)料過(guò)程中的物料主要成分。
二級(jí)控制為選擇性分析控制���,包括適宜的最終產(chǎn)品測(cè)試以及在已建立的設(shè)計(jì)空間內(nèi)靈活操控原物料屬性和工藝參數(shù)��。產(chǎn)品和工藝?yán)斫饪山柚⒍嘧兞吭O(shè)計(jì)空間而識(shí)別可能影響產(chǎn)品質(zhì)量的原物料和工藝可變性的潛在來(lái)源�。例如�,使用過(guò)程監(jiān)控來(lái)移除不合格物料。
三級(jí)控制為傳統(tǒng)性規(guī)格控制��。由于對(duì)原物料和工藝可變性如何影響產(chǎn)品質(zhì)量的理解可能有限����,因此控制須依賴(lài)嚴(yán)格約束的物料屬性和過(guò)程參數(shù),并通過(guò)廣泛的最終產(chǎn)品測(cè)試降低放行劣質(zhì)產(chǎn)品的風(fēng)險(xiǎn)���。三級(jí)控制通常不適用連續(xù)制造的監(jiān)控�,部分原因是制造期間存在瞬態(tài)過(guò)程擾動(dòng)的風(fēng)險(xiǎn)��。
多數(shù)連續(xù)制造系統(tǒng)的特征混合模式采用一級(jí)與二級(jí)的混合控制策略�,結(jié)合不同控制水平的方法,其中包括過(guò)程參數(shù)限制( 設(shè)定點(diǎn)和警報(bào)) 、過(guò)程監(jiān)視( 包括 PAT 數(shù)據(jù)) ���、過(guò)程控制( 反饋和前饋) ��、物料移除和實(shí)時(shí)放行測(cè)試的集成�����。對(duì)于中控分析過(guò)程中物料�,評(píng)估其在過(guò)程中的變化并確定一致性/不一致性的警告限制��。實(shí)施上則著重在中控范圍內(nèi)采取控制措施,確保符合驗(yàn)收標(biāo)準(zhǔn)以及在中控驗(yàn)收標(biāo)準(zhǔn)內(nèi)設(shè)置調(diào)整工藝的限制措施�,并加以實(shí)時(shí)監(jiān)控�。其目標(biāo)是唯有通過(guò)中控的所有物料才可在批次分析中放行��。如果物料的可追溯性方法���、過(guò)程監(jiān)控和物料移除機(jī)制已建立���,生產(chǎn)過(guò)程中可實(shí)現(xiàn)隔離和去除不符合中控驗(yàn)收標(biāo)準(zhǔn)的物料,不致影響該批次的其他部分�。
在質(zhì)量源于設(shè)計(jì)與 PAT 的倡議中,ICH Q8 制劑開(kāi)發(fā)文件定義了實(shí)時(shí)放行測(cè)試( RTRT) 原則: “基于過(guò)程數(shù)據(jù)����,評(píng)估與確保中間品和最終產(chǎn)品的質(zhì)量”[12]。這些數(shù)據(jù)可用于構(gòu)建反饋和前饋控制回路��。這意味著當(dāng)完全理解工藝并且可以隨時(shí)確保最終產(chǎn)品質(zhì)量時(shí)��,產(chǎn)品可以在生產(chǎn)后直接放行到市場(chǎng)���。運(yùn)用成熟的過(guò)程分析技術(shù)可保證產(chǎn)品質(zhì)量�����,在生產(chǎn)后直接放行產(chǎn)品���,而不是在批次完成后等待產(chǎn)品測(cè)試完成后做出決定�。實(shí)時(shí)放行可以用于批次生產(chǎn)�����,因?yàn)榕沃腥魶](méi)有偏差����,則可以直接放行。而在連續(xù)制造中的實(shí)時(shí)放行�,則是在沒(méi)有偏差的情況下實(shí)現(xiàn)連續(xù)放行產(chǎn)品。從運(yùn)行角度而言���,在線測(cè)量可識(shí)別不合規(guī)格的產(chǎn)品�,并允許在產(chǎn)品超出規(guī)格之前將其隔離甚至識(shí)別其相對(duì)應(yīng)關(guān)鍵質(zhì)量屬性的變化�。從過(guò)程理解的內(nèi)涵上,實(shí)時(shí)放行測(cè)驗(yàn)還應(yīng)評(píng)估在多批次生產(chǎn)階段性所觀察到關(guān)鍵質(zhì)量屬性的差異����,以確定其在批次內(nèi)和批次間的差異性作為持續(xù)改良的依據(jù)。從研發(fā)目標(biāo)上�,實(shí)時(shí)放行測(cè)驗(yàn)實(shí)施前,其相關(guān)方法開(kāi)發(fā)���、模型驗(yàn)證及控制步驟必須完全確立�,系統(tǒng)中的所有 PAT 工具都已安裝并確驗(yàn)�,必要時(shí)須了解系統(tǒng)的開(kāi)環(huán)動(dòng)態(tài),并估計(jì)必要的時(shí)間滯留常數(shù)��。從法規(guī)角度�����,如果將在線 PAT 方法作為常規(guī)方法( 無(wú)備選方案) 提交給藥監(jiān)部門(mén)時(shí)���,藥企應(yīng)制定實(shí)時(shí)放行測(cè)驗(yàn)計(jì)劃�,內(nèi)容包括解決 PAT 數(shù)據(jù)中的潛在差距���,描述當(dāng) PAT 分析儀無(wú)法使用時(shí)的后續(xù)操作( 如 PAT設(shè)備失效故障) 等要點(diǎn)����。雖然連續(xù)生產(chǎn)工藝并不一定涵蓋實(shí)時(shí)放行測(cè)驗(yàn),但歐美藥監(jiān)部門(mén)鼓勵(lì)制藥行業(yè)實(shí)施部分或全部成品質(zhì)量屬性的實(shí)時(shí)放行檢測(cè)���,尤其是鼓勵(lì)大型創(chuàng)新藥廠將實(shí)時(shí)放行作為連續(xù)制造商業(yè)化后高效率與經(jīng)濟(jì)效益的重要目標(biāo)�����。
5��、PAT 和過(guò)程控制系統(tǒng)集成
在現(xiàn)代商業(yè)化批次處理過(guò)程中���,制藥單元操作大多以“自動(dòng)化孤島”的模式運(yùn)行,但連續(xù)制造的目標(biāo)是通過(guò)使用總體過(guò)程控制系統(tǒng)將多個(gè)單元控制在同一個(gè)單元內(nèi)����。在進(jìn)入制業(yè)工業(yè) 4. 0 的前提下,制藥行業(yè)正在從人工決策的控制轉(zhuǎn)向先進(jìn)的過(guò)程控制����,其中以過(guò)程數(shù)據(jù)和建模軟件實(shí)現(xiàn)自動(dòng)控制過(guò)程化,以集成 PAT 方法為連續(xù)過(guò)程中的監(jiān)測(cè)工具��,進(jìn)一步將監(jiān)測(cè)數(shù)據(jù)整合到過(guò)程控制中����。當(dāng)連續(xù)過(guò)程與實(shí)時(shí)分布式控制系統(tǒng)集成時(shí)����,可參考其他化工行業(yè)中成功使用的“閉環(huán)過(guò)程”架構(gòu)�����,借助閉合循環(huán)過(guò)程系統(tǒng)可保證所需預(yù)定產(chǎn)品質(zhì)量的實(shí)現(xiàn)�。因此在前饋/反饋或閉環(huán)控制系統(tǒng)中�����,實(shí)現(xiàn)動(dòng)態(tài)調(diào)整關(guān)鍵工藝參數(shù)并回饋到控制器中�,確立過(guò)程保持在規(guī)格之內(nèi),可實(shí)時(shí)測(cè)量原始和中間 CMA����,CPP 和最終產(chǎn)品關(guān)鍵質(zhì)量屬性參數(shù)( 見(jiàn)圖 6) 。
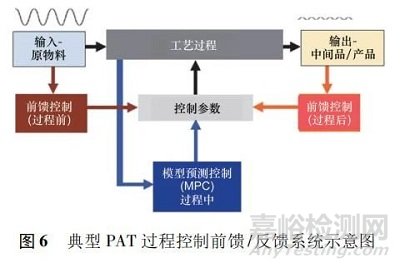
最近 Singh 等[13]在連續(xù)進(jìn)料器和攪拌器系統(tǒng)中設(shè)計(jì)了集成控制硬件和軟件���,在攪拌器出口處采用 PAT 系統(tǒng)讀取 NIR 譜數(shù)據(jù)并配合多變量分析模型執(zhí)行主成分分析和偏最小二乘法��,提供主成分濃度和相對(duì)標(biāo)準(zhǔn)偏差值�。這些關(guān)鍵質(zhì)量屬性作為過(guò)程控制系統(tǒng)中模型預(yù)測(cè)控制( model predictive control�,MPC) 的輸入值�����。在此設(shè)計(jì)中���,MPC 概念包括線性過(guò)程模型與當(dāng)前過(guò)程測(cè)量( 配合 PAT) 的組合,以預(yù)測(cè)未來(lái)既定步驟的過(guò)程輸出�。在此研究中使用2 組關(guān)鍵質(zhì)量屬性輸入值來(lái)驅(qū)動(dòng)進(jìn)料比例和攪拌器速度。MPC 的進(jìn)料比例輸出產(chǎn)生進(jìn)料器的流量設(shè)定值��,然后由從屬比例-積分-微分控制器( proportional integral derivative����,PID) 控制,最終實(shí)施的控制方案利用 PAT 數(shù)據(jù)管理系統(tǒng)來(lái)集成數(shù)字自動(dòng)化系統(tǒng)[13]����。
美國(guó)新澤西 Rutgers 大學(xué)特別成立 C-SOPS研究中心專(zhuān)注于與大型制藥公司合作運(yùn)行特定配方作為案例研究,以建立關(guān)于如何將光譜數(shù)據(jù)用于實(shí)時(shí)放行測(cè)試的知識(shí)工具箱���。他們與英國(guó) GSK 公司進(jìn)一步在進(jìn)料器和連續(xù)雙螺桿制粒機(jī)的單元操作上設(shè)計(jì)了控制回路�����,其中回饋線由內(nèi)置比例-積分-微分控制器和前饋/反饋控制器組成�����。設(shè)計(jì)重點(diǎn)是以前饋控制器排除對(duì)產(chǎn)品擾動(dòng)的影響�,同時(shí)再以反饋控制器糾正過(guò)程擾動(dòng)。自仿真研究證明��,基于在線NIR 測(cè)量 API 的 MPC 表現(xiàn)比 PID 控制器更好[14]��,因此整合過(guò)程控制的挑戰(zhàn)是確認(rèn) PAT 儀器 /設(shè)備數(shù)據(jù)可以無(wú)縫接軌閉環(huán)控制系統(tǒng)��。其目的是完全實(shí)現(xiàn)制藥智能化主動(dòng)控制��,確保預(yù)期生產(chǎn)結(jié)果并支持實(shí)時(shí)放行策略���。例如,美國(guó)輝瑞公司的 Chantix 藥品���,其申報(bào)的實(shí)時(shí)放行應(yīng)用程序已在所有主要市場(chǎng)和世界其他大部分地區(qū)完成����。輝瑞公司相信實(shí)時(shí)放行測(cè)試的價(jià)值在于取樣送到實(shí)驗(yàn)室的傳統(tǒng)測(cè)試將會(huì)減少����,降低人力與資源成本���,有助于實(shí)現(xiàn)供應(yīng)鏈現(xiàn)代化,靈活應(yīng)對(duì)市場(chǎng)操作���,并保持較低的庫(kù)存量�。
二�、固體制劑連續(xù)制造的 PAT 實(shí)施概況
通過(guò)連續(xù)過(guò)程制造固體口服藥物產(chǎn)品是歐美藥企新藥開(kāi)發(fā)與應(yīng)用的重點(diǎn),而國(guó)內(nèi)藥企也逐步展開(kāi)評(píng)估與應(yīng)用�����。在固體制劑連續(xù)制造中�����,物料將定期計(jì)量加入過(guò)程中�,并重復(fù)生成產(chǎn)品。進(jìn)入物料通常具有較短的停留時(shí)間( residence time) 以轉(zhuǎn)換成所需產(chǎn)品( 如藥物���、中間體�、藥物產(chǎn)品混合物�����、成品劑型) 。因此原物料的特性與進(jìn)料過(guò)程是關(guān)鍵操作���,其重點(diǎn)包括: ① 限制進(jìn)料在上限和下限附近��,以生產(chǎn)符合質(zhì)量的原料���。② 評(píng)估操作變化的影響( 例如,在進(jìn)料器補(bǔ)充期間從重量轉(zhuǎn)換為體積流量) ����。③ 評(píng)估輔料進(jìn)料變化對(duì)產(chǎn)品性能( 如溶出度) 的影響��。由于所需的物料是不間斷生產(chǎn)的���,因此進(jìn)料期間須不斷確認(rèn)物料質(zhì)量�����,必要時(shí)調(diào)整其工藝參數(shù)以保持一致的產(chǎn)品質(zhì)量�。通常整體系統(tǒng)中的傳送過(guò)程可能引起一定程度的擾動(dòng)( 如粉末的分離或聚集) �����,過(guò)程中物料沿著管線傳送后,系統(tǒng)中產(chǎn)生的擾動(dòng)將隨著傳送而趨于平緩�。在解決方案中,系統(tǒng)對(duì)擾動(dòng)的動(dòng)態(tài)行為除了利用在線光譜分析外����,尚可通過(guò)停留時(shí)間分布( residence time distribution,RTD) 方法評(píng)估物料流動(dòng)趨勢(shì)����,確定其數(shù)學(xué)機(jī)理模型。例 如����,Rehrla 等[15]開(kāi)發(fā)了 3 種常用連續(xù)工藝( 直接壓片、濕法制粒��、熱熔擠出) 的數(shù)學(xué)模型�,根據(jù)從進(jìn)料器數(shù)據(jù)計(jì)算的 API 濃度預(yù)測(cè)混合步驟后的 API 濃度。這項(xiàng)研究提出了一種軟傳感器( soft sensor) 模型�,該模型捕獲了上述 3 條生產(chǎn)線的混合步驟的停留時(shí)間分布,允許整體分析系統(tǒng)并支持整體控制策略的開(kāi)發(fā)����。

在適合條件下,開(kāi)發(fā)停留時(shí)間分布模型可替代昂貴的 NIR 設(shè)備,甚至可提供已裝置 NIR 儀器后可能的故障或信號(hào)漂移信息[15]��。使用 NIR 監(jiān)測(cè)旋轉(zhuǎn)式壓片機(jī)中的進(jìn)料架內(nèi)循環(huán)粉末的活性成分已成為新興的 PAT 應(yīng)用項(xiàng)目���,原因是可直接檢視粉末物料在壓片前的質(zhì)量情況����。設(shè)計(jì)上是將 NIR 探頭安裝在進(jìn)料架上��,緊接在壓片模具的填充器之前���,可在片劑壓片過(guò)程前進(jìn)行活性成分測(cè)定����,計(jì)算壓成片劑的物料測(cè)量值( 見(jiàn)圖 7) �����。美國(guó)禮來(lái)公司與輝瑞公司的研究報(bào)告發(fā)現(xiàn)���,壓片過(guò)程參數(shù)包括槳輪轉(zhuǎn)速和 NIR 探頭位置,必須針對(duì)不同的壓片機(jī)的幾何形狀進(jìn)行優(yōu)化�,以確保 NIR 過(guò)程信息可與片劑活性成分相關(guān)。他們認(rèn)為在線 NIR 技術(shù)可用于鑒定粉末從中間散裝容器( intermediate bulk container,IBC) 排放粉末期間的分離情況����,進(jìn)一步理解在進(jìn)料架內(nèi)粉末混合的動(dòng)力學(xué),并可成為壓片過(guò)程中故障檢測(cè)片劑的診斷工具��。該 PAT應(yīng)用還可以與壓片機(jī)控制系統(tǒng)集成���,成為片劑通過(guò)或拒絕的裝置�,也可以通過(guò)在進(jìn)料架內(nèi)連續(xù)監(jiān)測(cè)粉末循環(huán)中活性成分和均勻性的實(shí)時(shí)放行測(cè)試[16]��。
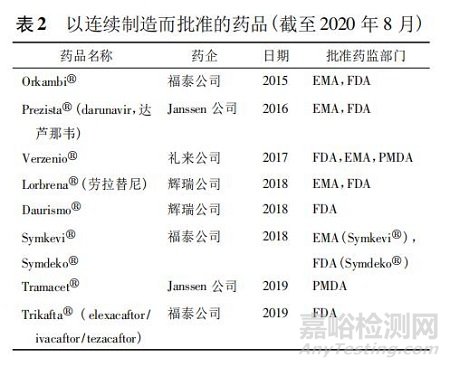
截至目前��,采用 PAT 技術(shù)的連續(xù)生產(chǎn)實(shí)施上���,至少已有 8 種新藥通過(guò)歐美或日本藥監(jiān)部門(mén)的審批程序( 見(jiàn)表 2) �����。2015 年美國(guó)福泰公司( Vertex) 提交第一個(gè)新藥申請(qǐng)( new drug application�,NDA) 批準(zhǔn)使用在連續(xù)制造技術(shù)生產(chǎn)����。為此還在美國(guó)波士頓附近建造了一個(gè)占地 370 平方米的連續(xù)生產(chǎn)車(chē)間���。申請(qǐng)的藥品 Orkambi 是基于 PAT 控制策略生產(chǎn)的連續(xù)制造藥物產(chǎn)品,含有 2 種活性藥物成分 lumacaftor和 ivacaftor 的固定劑量組合片劑�����。福泰公司以連續(xù)制造和 PAT 用于控制和實(shí)時(shí)產(chǎn)品放行��,已經(jīng)通過(guò)歐美藥監(jiān)部門(mén)檢查和審批��。此連續(xù)制造的工藝是將輔料連續(xù)分配����、混合、濕法制粒����、干燥、粉碎�、終混、壓片和薄膜包衣��。據(jù)報(bào)道有 3 項(xiàng)位置使用連續(xù)濕法制粒工藝生產(chǎn)藥品�����,系統(tǒng)和 PAT 功能在不同位置之間略有差異����。


圖 8 中顯示其中一個(gè)生產(chǎn)現(xiàn)場(chǎng)連續(xù)模式下操作的系統(tǒng),包含從單個(gè)組件進(jìn)料到薄膜包裝的藥片單元操作�。表 3 中也列出 PAT 工具和相關(guān)的測(cè)量結(jié)果與放行標(biāo)準(zhǔn)。福泰公司將各個(gè)測(cè)量結(jié)果組合在一個(gè)控制策略中���,該策略允許連續(xù)監(jiān)控整個(gè)過(guò)程���,這樣可以根據(jù)需要進(jìn)行工藝調(diào)整,以確保物料符合規(guī)范���,并可隔離不合格物料或中間產(chǎn)品�。此外福泰公司的囊性纖維化三聯(lián)療法 Trikafta( elexacaftor/ivacaftor/tezacaftor) 于 2019 年 10 月獲批�。在此申報(bào)中,采用PAT 技術(shù)有助于 FDA 認(rèn)同申報(bào)者的產(chǎn)品質(zhì)量一致性和即時(shí)控制能力���,可促使注冊(cè)流程的簡(jiǎn)化����,審評(píng)批準(zhǔn)時(shí)間從一般 10 個(gè)月降低至 3 個(gè)月��。
2016 年美國(guó) Janssen 公司出品的 Prezista 600 mg片劑是第一個(gè)從批次制造變更成連續(xù)制造過(guò)程的新藥補(bǔ)充批準(zhǔn)。Janssen 公司選擇直接壓片的連續(xù)制造技術(shù)����,藥片采用直接壓片的連續(xù)制造平臺(tái)生產(chǎn)。原物料通過(guò)真空輸送到進(jìn)料器�、混合、壓片和包衣的系統(tǒng)����,采用全自動(dòng)和 PAT 控制的連續(xù)過(guò)程中進(jìn)行,其中混合均勻度是由在線多探頭陣列 NIR 監(jiān)控���,含量均勻度由臨線 NIR 預(yù)測(cè)����。與批次生產(chǎn)比較���,連續(xù)制造產(chǎn)生 1 000 kg 所需的產(chǎn)品從傳統(tǒng) 13 d 縮短至2 d 內(nèi)�����,而設(shè)施面積僅占傳統(tǒng)批次生產(chǎn)的一半�����,其中測(cè)試和放行時(shí)間也從 30 d 縮短至 5 d[17]��,由此可證明連續(xù)制造的經(jīng)濟(jì)效益不容忽視�。
美國(guó)禮來(lái)公司的 Verzenio 產(chǎn)品則是在 2017 年獲得 FDA 批準(zhǔn)連續(xù)制造����。其系統(tǒng)是一個(gè)半集成的直接壓片連續(xù)制造平臺(tái),包括高精度的粉末進(jìn)料����、混合和壓片。獨(dú)特的創(chuàng)新升降系統(tǒng)支持主流程系列�����,便于操作����、清潔和轉(zhuǎn)換。禮來(lái)公司開(kāi)發(fā)并部署進(jìn)料架 PAT 工具����,達(dá)到實(shí)時(shí)確認(rèn)藥品連續(xù)制造過(guò)程時(shí) API 在最終混合物的濃度。此處的 PAT 工具是指能夠測(cè)量粉末形式的 API 濃度的 NIR 技術(shù)��,其實(shí)時(shí)放行測(cè)驗(yàn)的控制策略包括確保在進(jìn)料框架內(nèi)收集片劑并使片劑重量和NIR預(yù)測(cè)的API濃度( 混合均勻性) 處于預(yù)定限制內(nèi),超出這些限制的可疑藥片通過(guò)壓片機(jī)的卸料斜槽觸發(fā)自 動(dòng)清除�����。
美國(guó)輝瑞公司在 2015 年就開(kāi)發(fā)出原型階段的便攜式��、連續(xù)式��、微型和模塊化( portable���,continuous���,miniature and modular,PCMM) 連續(xù)制造系統(tǒng)����,使用GEA 藥機(jī)廠的 ConSigma 處理系統(tǒng),該系統(tǒng)可以使用 G-CON POD 預(yù)制潔凈室并安裝在“集箱”設(shè)施���。此設(shè)計(jì)連同需要的 PAT 儀器可以在一個(gè)地點(diǎn)快速安裝�,必要時(shí)將系統(tǒng)移動(dòng)到另一個(gè)地點(diǎn)�。輝瑞公司于2015 年在康涅狄格州格羅頓安裝了第一臺(tái) PCMM 裝置,2018 年在德國(guó)弗萊堡安裝了相同的加工設(shè)備。
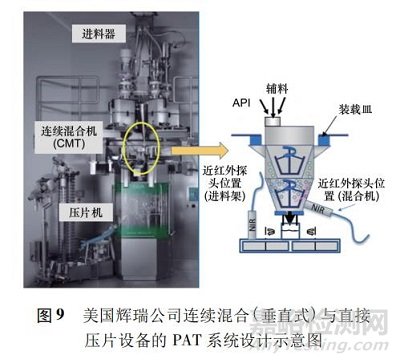
在 PAT 系統(tǒng)設(shè)計(jì)上��,輝瑞公司運(yùn)用近紅外光譜儀監(jiān)控連續(xù)混合過(guò)程與旋轉(zhuǎn)式壓片機(jī)進(jìn)料架內(nèi)粉末的活性成分���,從而保證所得片劑的含量均勻性( 圖 9) ���。他們也在 2018 年使 DaurismoTM ( glasdegib) 獲得美國(guó) FDA 新藥申請(qǐng)批準(zhǔn)����。
三、結(jié)論
連續(xù)制造比傳統(tǒng)的藥物批次生產(chǎn)具有顯著的自動(dòng)化監(jiān)控與質(zhì)量一致性?xún)?yōu)勢(shì)���,符合制藥工業(yè) 4.0的概念����。在歐美監(jiān)管部門(mén)�、高校研究中心、先進(jìn)制藥公司和藥機(jī)設(shè)備供應(yīng)商的共同努力下�,已激發(fā)了連續(xù)制造藥物的新范例。但是在連續(xù)制造的具體實(shí)施上必須調(diào)研配方選擇����、工藝設(shè)計(jì)、設(shè)備開(kāi)發(fā)、工藝放大�、過(guò)程控制、在線質(zhì)量保證以及新興技術(shù)的經(jīng)濟(jì)成本等因素����。但值得關(guān)注的連續(xù)制造控制策略必須配合PAT 技術(shù)的運(yùn)用,以完成工藝開(kāi)發(fā)�、質(zhì)量改進(jìn)和產(chǎn)品生命周期管理等關(guān)鍵要素。PAT 在連續(xù)制造中的核心角色為其工藝控制策略���,研究人員應(yīng)該評(píng)估最適合監(jiān)測(cè)所需關(guān)鍵屬性的 PAT 工具���,并熟悉其技術(shù)與商業(yè)化成熟度。而多變量數(shù)據(jù)分析��、過(guò)程模型的風(fēng)險(xiǎn)評(píng)價(jià)��、前饋/反饋或閉環(huán)監(jiān)控和大型數(shù)據(jù)庫(kù)管理來(lái)實(shí)時(shí)分析���,支持中控或?qū)崟r(shí)放行測(cè)驗(yàn)�����?��;旧?PAT涉及多元化的學(xué)科�,需要吸引具有許多科學(xué)和工程領(lǐng)域背景的專(zhuān)家���,以鼓勵(lì)當(dāng)前與未來(lái)的發(fā)展領(lǐng)域�,并依賴(lài)于軟/硬件的運(yùn)用與合規(guī)要求�����。預(yù)測(cè)未來(lái)PAT 應(yīng)用范例將會(huì)持續(xù)增長(zhǎng)且運(yùn)用經(jīng)驗(yàn)也更加成熟�,商業(yè)化硬件可以即插即用����,預(yù)測(cè)模型可以轉(zhuǎn)移,為制藥連續(xù)或批次制造工藝問(wèn)題上提供更專(zhuān)業(yè)的解決方案���。與此同時(shí)�,如何在國(guó)內(nèi)制藥行業(yè)中將 PAT變得更容易在車(chē)間實(shí)現(xiàn)�,并合規(guī)或符合標(biāo)準(zhǔn)要求,將會(huì)是行業(yè)��、監(jiān)管與學(xué)術(shù)界積極努力的方向�。
參考文獻(xiàn)
[1] CENTER FOR DRUG EVALUATION AND RESEARCH. Quality
considerations for continuous manufacturing guidance for industry
[EB/OL]. [2020 - 04 - 14]. https: / /www. fda. gov /Drugs/
GuidanceComplianceRegulatoryInformation /Guidances/default. htm.
[2] KHINAST J��,RANTANEN J. Continuous manufacturing of pharmaceuticals[M]. John Wiley & Sons Ltd�����,2017.
[3] LEE SL��,O'CONNOR TF����,YANG XC���,et al. Modernizing pharmaceutical manufacturing: from batch to continuous production
[J]. J Pharm Innov��,2015����,10: 191 - 199.
[4] 王芬���,徐冰����,劉雨���,等. 中藥質(zhì)量源于設(shè)計(jì)方法和應(yīng)用: 連續(xù)制
造[J]. 世界中醫(yī)藥�,2018,13( 3) : 566 - 573.
[5] CENTER FOR DRUG EVALUATION AND RESEARCH. Guidance for industry PAT-A framework for innovative pharmaceutical
development���,manufacturing��,and quality assurance[EB /OL].
( 2004 - 09) . https: / /www. fda. gov /media /71012 /download.
[6] 省盼盼�����,羅蘇秦����,尹利輝. 過(guò)程分析技術(shù)在藥品生產(chǎn)過(guò)程中的
應(yīng)用[J]. 藥物分析雜志�,2018����,38( 5) : 748 - 757.
[7] VARGASA JM,NIELSENB S�����,CRDENASA V�,et al. Process
analytical technology in continuous manufacturing of a commercial
pharmaceutical product[J]. Int J Pharm�����,2018�,538( 1 - 2) :
167 - 178.
[8] FONTEYNE M���,VERCRUYSSE J���,DE LEERSNYDER F,et al.
Process analytical technology for continuous manufacturing of solid-dosage forms[J]. Trends Anal Chem��,2015�,67: 159 - 166.
[9] SIERRA-VEGAA NO,ROMN-OSPINOB A���,SCICOLONEB J���,
et al. Assessment of blend uniformity in a continuous tablet manufacturing process[J]. Int J Pharm,2019�,560: 322 - 333.
[10] HETRICK EM,SHI ZQ�����,BARNES LE,et al. Development of
near infrared ( NIR) spectroscopy-based process monitoring methodology for pharmaceutical continuous manufacturing using an offline calibration approach[J]. Anal Chem���,2017����,89: 9175 -
9183.
[11] 常恩浩���,過(guò)芳�,陳宇雷���,等. 過(guò)程分析技術(shù)在流化床制粒�����,包衣
過(guò)程監(jiān)控中的應(yīng)用[J]. 今日藥學(xué)�����,2019,29( 12) : 857 - 860.
[12] ICH Q8 ( R2) . Pharmaceutical development[S]. 2009.
[13] SINGH R�,IERAPETRITOU M,RAMACHANDRAN R. Systemwide hybrid MPC-PID control of a continuous pharmaceutical tablet manufacturing process via direct compaction[J]. Eur J Pharm
Biopharm���,2013����,85( 3) : 1164 - 1182.
[14] PEREIRA GC,MUDDU SV��,ROMN-OSPINO AD�����,et al. Combined feedforward /feedback control of an integrated continuous
granulation process[J]. J Pharm Innov�,2018,14( 15) : 1 - 27.
[15] REHRLA J���,KARTTUNENB AP����,NICOLAC N���,et al. Control
of three different continuous pharmaceutical manufacturing processes: Use of soft sensors[J]. Int J Pharm�,2018����,543: 60 - 72.
[16] HOWARD W. WARDA��,DANIEL. BLACKWOODA��,MARK POLIZZI��,et al. Monitoring blend potency in a tablet press feed frame
using near infrared spectroscopy[J]. J Pharm Biomed Anal����,
2013����,80: 18 - 23.
[17] WARMAN M. Control strategy in continuous manufacturing of
drug product[C]. Washington,DC����,USA,2014.