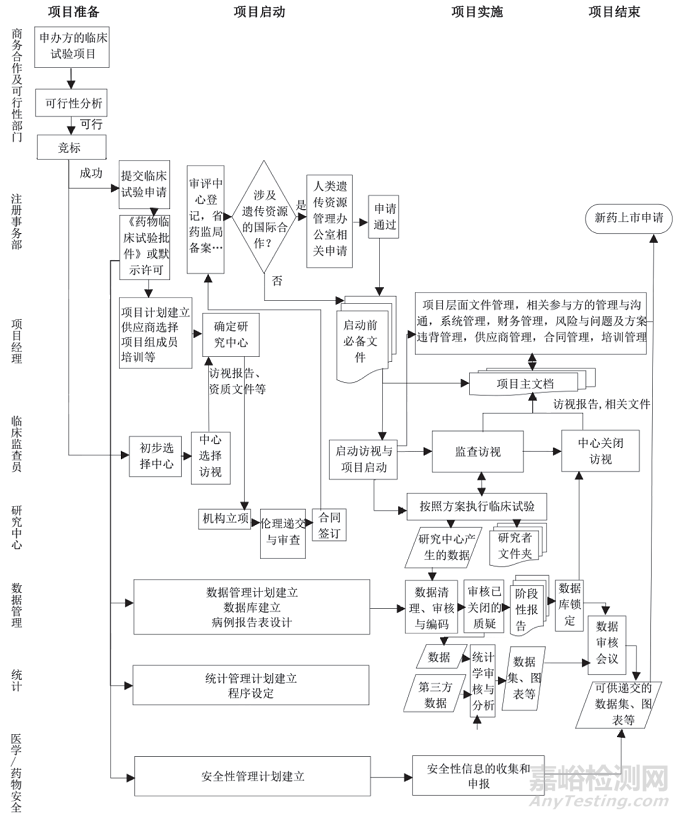
1、人類遺傳資源管理相關(guān)事務(wù)(涉及樣本和數(shù)據(jù)出口時)
《中華人民共和國人類遺傳資源管理條例》規(guī)定���,利用我國人類遺傳資源開展國際合作科學(xué)研究���,應(yīng)由國務(wù)院科學(xué)技術(shù)行政部門批準(zhǔn)。由于遞交相關(guān)申請時需要提供準(zhǔn)確的樣本與數(shù)據(jù)采集量��,因此需要進(jìn)行準(zhǔn)確的數(shù)據(jù)計算��,并對篩選失敗率���、訪視數(shù)量和樣本采集量等數(shù)據(jù)進(jìn)行合理估算����。如果涉及重要變更�����,如方案���、參與方變更�,或樣本采集即將超過批準(zhǔn)范圍時的樣本采集量變更等,需要及時獲知相關(guān)情況并提交變更申請�����;研究進(jìn)行過程中���,需要及時按照相關(guān)法規(guī)對數(shù)據(jù)進(jìn)行備份備案��。該流程發(fā)生風(fēng)險的可能性中等��,但對于在我國進(jìn)行的臨床試驗�����,其中的人類遺傳資源樣本�����、數(shù)據(jù)一旦在不符合要求的情況下出境�,流失到外國��,會產(chǎn)生潛在的生物威脅����,并影響受試者的隱私和數(shù)據(jù)安全,因此影響的嚴(yán)重程度高���。
此流程的風(fēng)險防范措施���,包括在就人類遺傳信息相關(guān)事務(wù)進(jìn)行初次申請時,應(yīng)對項目和中心的實際情況有全面且充分的了解�����,并依此確定合理的數(shù)據(jù)和樣本量��。在項目進(jìn)行的過程中�,申辦方及CRO 公司應(yīng)設(shè)置明確的責(zé)任人,如項目經(jīng)理或注冊事務(wù)部人員等����,定期對人類遺傳辦公室相關(guān)問題,如批件是否即將超期��,采集數(shù)量是否超過批件限制等進(jìn)行自查�。
2、研究中心監(jiān)查訪視和關(guān)閉訪視
研究中心監(jiān)查訪視通常是周期性發(fā)生的現(xiàn)場監(jiān)查活動�����,目的是對臨床試驗的進(jìn)展進(jìn)行監(jiān)督。進(jìn)行監(jiān)查訪視時���,監(jiān)查員需要在有限的時間內(nèi)完成多項訪視活動����,對研究中心試驗進(jìn)展情況進(jìn)行了解����、評估并對相關(guān)方進(jìn)行溝通與協(xié)調(diào)。訪視活動的流程具有一定的復(fù)雜性����,如在進(jìn)行原始數(shù)據(jù)核實與檢查、研究器械的清點等步驟時���,都需要交叉核對大量文件�。監(jiān)查訪視結(jié)束后����,會產(chǎn)生待解決問題和相關(guān)文件,存在問題被擱置�、遺忘、解決不充分��,及文件發(fā)送、歸檔不及時的風(fēng)險�。中心關(guān)閉訪視通常為項目的最后一次監(jiān)查訪視���,此時需要確保此前中心出現(xiàn)的問題已全部得到解決�����,研究中心已經(jīng)處于隨時可以進(jìn)行核查的狀態(tài)��,并明確研究者后續(xù)職責(zé)�,因此存在問題未得到充分解決等風(fēng)險��。
綜上�����,該流程風(fēng)險發(fā)生的可能性高���,影響的嚴(yán)重程度為中等���。 通過分析此過程問題發(fā)生的根本原因和流程中的薄弱環(huán)節(jié),我們得出的風(fēng)險防范措施可包括以下幾個方面:①人員方面���。項目經(jīng)理關(guān)注監(jiān)查員經(jīng)驗���,對經(jīng)驗不足的監(jiān)查員及時進(jìn)行培訓(xùn)和提供必要的幫助�����。②監(jiān)查訪視方面�。項目經(jīng)理關(guān)注訪視報告中的問題����,對于長時間(如 90 d 以上)仍未解決的困難問題,應(yīng)協(xié)助臨床監(jiān)查員進(jìn)行解決��。③研究中心管理方面����。TIMMERMANS 等曾提出使用統(tǒng)計學(xué)方法,通過監(jiān)測研究中心產(chǎn)生的明顯偏離于平均值的數(shù)據(jù)���,從而識別中心風(fēng)險并進(jìn)行管理���。根據(jù)此思路,對于出現(xiàn)入組較多、較快���,嚴(yán)重不良事件報告數(shù)量過少�,長時間未安排會見研究者等風(fēng)險信號的研究中心�����,項目經(jīng)理可以及時安排質(zhì)量管理人員或項目經(jīng)理與監(jiān)查員共同訪視�����。④時間安排方面���。項目經(jīng)理確認(rèn)訪視按照監(jiān)查計劃規(guī)定的時間按時進(jìn)行,對于高風(fēng)險中心可適當(dāng)提高監(jiān)查頻率�����。
3���、TMF的管理
TMF 是需要保存的臨床試驗的過程性文件�����。由于臨床試驗中的文件記錄具有重現(xiàn)臨床試驗過程的意義��,因此至關(guān)重要��,這也使得 TMF 成為稽查與核查中關(guān)注的重點�����。由于臨床試驗的每個步驟都需要詳細(xì)����、準(zhǔn)確地被記錄,TMF 具有文件數(shù)量大�,分類繁雜,涉及相關(guān)方多的特點���,有可能出現(xiàn)文件收集不完全��、質(zhì)量不合格���、回收時間過長等問題。該流程風(fēng)險發(fā)生的可能性高����。
該流程的風(fēng)險防范措施,包括:項目經(jīng)理及時建立負(fù)責(zé)項目的必備文件清單,供臨床監(jiān)查員和臨床試驗助理遵循使用����,以防文件缺失;明確每個文件的責(zé)任人��,建立相關(guān)問責(zé)機(jī)制�����;設(shè)置回收的關(guān)鍵時間節(jié)點�����,督促責(zé)任人及時回收相關(guān)文件����;建立完整可靠的質(zhì)量檢查流程�,如設(shè)置專門的人員進(jìn)行 TMF的質(zhì)量檢查工作。
4����、項目管理
項目管理人員需要提前結(jié)合標(biāo)準(zhǔn)操作規(guī)程(standard operation procedure, SOP),制定完善的項目管理計劃和監(jiān)查計劃等����,并監(jiān)督項目組成員嚴(yán)格執(zhí)行��;對于項目信息和項目文件(如方案���、研究者手冊和知情同意書等)的更新,需要及時與相關(guān)方進(jìn)行充分�、及時、有效地溝通�����;對于項目使用的系統(tǒng)�,需要確保其有效運行并持續(xù)被維護(hù);制定清晰����、準(zhǔn)確的財務(wù)管理流程;提前制定風(fēng)險管理計劃�����,并且針對項目進(jìn)程中出現(xiàn)的問題���,建立暢通有效的上報流程和制定有效的糾正預(yù)防措施����;選擇供應(yīng)商時,嚴(yán)格執(zhí)行資質(zhì)審核�����,必要時為其提供特定培訓(xùn)��,確保其符合方案和公司 SOP 要求���;與研究中心和申辦者簽訂合同前應(yīng)有審核步驟���,尤其是涉及相關(guān)服務(wù)范圍更新時,應(yīng)對合同進(jìn)行完整重審���;在項目組成員進(jìn)入項目前和項目信息有更新時應(yīng)及時對其進(jìn)行培訓(xùn)。
5�����、倫理委員會遞交與審查
進(jìn)行中心選擇訪視時����,提前了解研究中心倫理委員會召開倫理評審會議的頻率和審查流程���,選擇符合項目要求的中心;初次遞交時�,將遞交的文件與臨床試驗批件、人類遺傳資源辦公室批件���、合同等文件進(jìn)行交叉核對�,確保文件信息正確��;對于倫理委員會提出的問題�,CRO 公司應(yīng)與申辦方溝通,及時回復(fù)并作出相應(yīng)改進(jìn)措施�;由于倫理委員會審查是一個持續(xù)的過程,還需要及時設(shè)置時間點提醒��,在相關(guān)文件更新后或年度 / 其他周期性審查截止時間點前�����,及時將相關(guān)材料遞交給倫理委員會審查�。
6、數(shù)據(jù)管理
數(shù)據(jù)管理部門制定完善的數(shù)據(jù)管理計劃和各流程檢查表���;設(shè)置用戶權(quán)限控制清單�����,通過交叉核對����,以保證正確的用戶擁有正確的權(quán)限;根據(jù)實際操作流程���、法規(guī)及合同要求�,對數(shù)據(jù)錄入系統(tǒng)的使用人員進(jìn)行相關(guān)培訓(xùn)��;為病例報告表設(shè)置準(zhǔn)確的邏輯核查規(guī)則��;數(shù)據(jù)管理人員確認(rèn)數(shù)據(jù)錄入人員回復(fù)數(shù)據(jù)質(zhì)疑����,并檢查無誤后,方可關(guān)閉質(zhì)疑�;對于來自第三方和 / 或由第三方進(jìn)行處理的外部數(shù)據(jù),需要制定并執(zhí)行質(zhì)量檢查流程�;數(shù)據(jù)庫鎖定后如仍需解鎖���,需提供充足的理由并分析解鎖造成的影響�����。
7���、CRO運營臨床試驗全流程
CRO最顯著的特點是將臨床試驗專業(yè)化和高效率化�����。作為申辦方的一種可借用的外部資源���,可以幫助企業(yè)提高新產(chǎn)品上市的速度,降低企業(yè)的管理和研發(fā)費用投入��。以下是CRO運營臨床試驗全過程的流程圖��,希望可以幫助到大家圖片