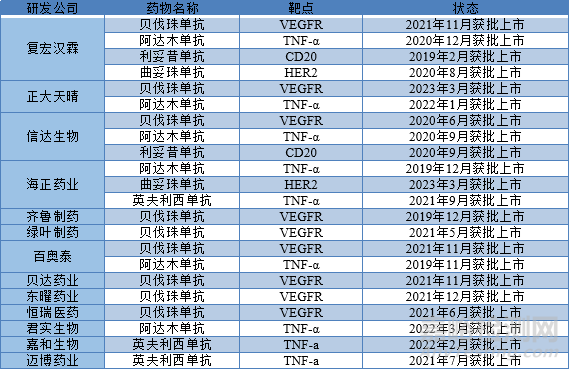
生物制藥特點(diǎn)之一就是藥品價(jià)格相對昂貴�����,經(jīng)濟(jì)發(fā)展較差地區(qū)那一負(fù)擔(dān)��。2005-2019年間已有55種生物類似藥在歐盟(EU)市場獲得批準(zhǔn)�����,其中包括生長激素��、促紅細(xì)胞生成劑(ESA)�����、粒細(xì)胞集落刺激因子(G-CSF)和單克隆抗體�����。歐洲藥品管理局(EMA)于2010年3月允許批準(zhǔn)符合FDA許可的原研藥的生物類似藥�����。2015年9月�����,F(xiàn)DA批準(zhǔn)了美國第一個(gè)生物類似藥����,Sandoz公司的filgrastim(Zarxio®)��。2016年4月,F(xiàn)DA批準(zhǔn)了第一個(gè)生物類似藥單克隆抗體�����,Celltrion公司的英夫利昔單抗(Inflectra®)�����。2019年2月國內(nèi)首個(gè)上市生物類似藥漢利康(利妥昔單抗)(復(fù)宏漢霖)獲批上市�����。下表為國內(nèi)生物類似藥上市情況及藥物名靶點(diǎn)�����。
專利方面的挑戰(zhàn)
生物類似藥主要挑戰(zhàn)之一是專利問題��。即使基本生物分子專利(主要專利)已經(jīng)過期����,但由于存在有效的二級專利,生物類似藥的開發(fā)不得不推遲����。二級專利主要是現(xiàn)有活性成分的新處方����、生產(chǎn)工藝��、新適應(yīng)癥以及活性成分的新組合相關(guān)的專利����。處方專利是一種重要的藥品生命周期管理策略�����,用于在原始專利到期后保持市場獨(dú)家性����。即使主要專利已過期,公司仍然可以通過獲得處方專利來保持市場獨(dú)家經(jīng)營權(quán)�����。截至2021年12月�����,F(xiàn)DA已批33種生物類似藥����,其中只有22種在市場上市����?����?梢娪捎诙墝@谋Wo(hù)�����,生物類似藥批準(zhǔn)后上市使用仍然有限��。為了避免侵犯這些專利��,生物類似藥開發(fā)公司可以利用原始處方開發(fā)替代處方�����,相應(yīng)的代價(jià)就是犧牲時(shí)間和成本����。此外還要考慮例如分子專利到期與處方專利之間的時(shí)間間隔等問題,避免侵犯二級專利�����,合理安排項(xiàng)目時(shí)間表。
單克隆抗體生物類似藥開發(fā)
處方開發(fā)主要目標(biāo)是為蛋白質(zhì)分子提供一個(gè)穩(wěn)定的環(huán)境�����,使其在整個(gè)生產(chǎn)��、運(yùn)輸�����、儲存和使用過程中保持穩(wěn)定����。對于新的分子����,產(chǎn)品開發(fā)需要經(jīng)歷初步的風(fēng)險(xiǎn)評估--識別和降低風(fēng)險(xiǎn)--穩(wěn)定的處方和工藝開發(fā)。
單克隆抗體(mAB)可能具有與化學(xué)和物理不穩(wěn)定性�����。最常見的化學(xué)降解途徑是氧化和脫酰胺��,其次是異構(gòu)化、去糖基化����、糖基化、碎片化和交聯(lián)�����。甲硫氨酸�����、半胱氨酸����、組氨酸、色氨酸和酪氨酸等易感氨基酸的氧化會影響單克隆抗體的結(jié)構(gòu)完整性�����、構(gòu)象穩(wěn)定性��、安全性和有效性��。為了減少蛋白質(zhì)氧化��,可以在處方開發(fā)過程中評估抗氧化劑的添加情況,例如甲硫氨酸����、EDTA(乙二胺四乙酸)和二乙烯三胺五乙酸(DTPA)。此外通過惰性氣體(氮?dú)猓﹣砣コ斂昭鯕饪赡苡行Х乐寡趸?/span>
聚集是生物藥物產(chǎn)品中最常見的物理不穩(wěn)定性�����,尤其是單克隆抗體(mAB)�����,會直接影響藥物的療效和安全性�����。在分子的重新設(shè)計(jì)過程中��,盡量識別和減少蛋白質(zhì)中的易聚集區(qū)(APR)�����。約15%FDA批準(zhǔn)的抗體藥物具有至少一個(gè)APR�����。屏蔽APR的處方成分有助于減少聚集��。通過與蛋白質(zhì)疏水表面競爭��,添加聚山梨醇酯(PS)80和PS20等非離子表面活性劑可以保護(hù)蛋白質(zhì)免受攪動引起的聚集��。
生物類似藥處方開發(fā)需選擇以及生產(chǎn)優(yōu)質(zhì)分子�����,即使處方不同�����,也要保證理化性質(zhì)和生物活性特征與原研藥高度相似�����。生物類似藥處方開發(fā)取決于多種因素��,例如專利��、現(xiàn)有處方的改進(jìn)空間��、公司平臺知識等��。
最優(yōu)處方開發(fā)思路:
處方設(shè)計(jì)主要依據(jù)先驗(yàn)知識和經(jīng)驗(yàn),黃金原則是組成盡量簡單��。限制于處方開發(fā)的時(shí)間和經(jīng)濟(jì)成本��,已上市的抗體藥物中僅使用了30種輔料(FDA已經(jīng)批準(zhǔn)1758種)����,有18種出現(xiàn)在十多種產(chǎn)品中。
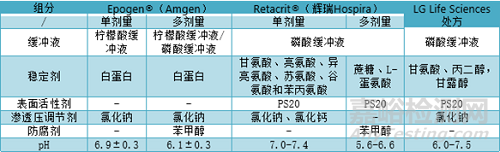
人血清白蛋白(HSA)很早就被用作疫苗和重組蛋白處方的賦形劑和穩(wěn)定劑�����。HSA是血漿衍生產(chǎn)品導(dǎo)致其安全性一直受到監(jiān)管機(jī)構(gòu)重視����。Amgen公司的Epogen®(Epoetin alfa)處方均以HSA作為穩(wěn)定劑�����。多劑量處方加入苯甲醇有導(dǎo)致局部蛋白質(zhì)區(qū)域展開的風(fēng)險(xiǎn)����,這會增加蛋白質(zhì)聚集并吸附到容器壁從而影響藥物的療效。為了防止這種情況�����,Epogen®使用含有等離子體衍生的HSA,減少蛋白的聚集��,Amgen公司已申請含HSA的二級專利(已于2015年到期)用以保護(hù)其市場份額��。因此�����,生物類似藥處方開發(fā)將HSA替換為其他更優(yōu)的穩(wěn)定劑����。
Bioceuticals公司開發(fā)出了不含HSA促紅細(xì)胞生成素處方,該處方含有氨基酸(甘氨酸��、亮氨酸����、異亮氨酸、蘇氨酸����、谷氨酸和苯丙氨酸)、絡(luò)合劑(氯化鈣)、滲透壓調(diào)節(jié)劑(氯化鈉)��、磷酸鹽緩沖液和表面活性劑(PS20)����。因此Bioceuticals公司也與輝瑞公司Hospira簽訂了獨(dú)家協(xié)議,在美國和加拿大開發(fā)��、生產(chǎn)和銷售促紅細(xì)胞生成素����,Retacrit®(Amgen公司Epogen® 和Procrit®(epoetin alfa)的生物類似藥)。Retacrit® 是美國市場上第一款獲得批準(zhǔn)的Epogen®生物類似藥����。LG Life Sciences 則使用協(xié)同組合穩(wěn)定劑開發(fā)出一種穩(wěn)定的促紅細(xì)胞生成素處方,其處方成分為:磷酸鹽緩沖液��、丙二醇��、甘氨酸��、氯化鈉和PS20����。各處方信息如下表。
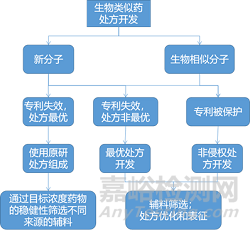
非侵權(quán)/可替換處方開發(fā)思路:
生物藥產(chǎn)品的處方很復(fù)雜�����,在開發(fā)非侵權(quán)替代處方時(shí)必須考慮多個(gè)變量�����,這些變量包括分子專利到期與處方專利到期之間的時(shí)間間隔�����、不侵犯其他二級專利以及合理安排項(xiàng)目時(shí)間表�����。生物類似藥的開發(fā)難點(diǎn)在于工藝��、處方和特殊器件的有效二級專利的復(fù)雜性��。原研公司會利用不同的策略來阻礙生物類似藥和后續(xù)生物制劑的申報(bào)上市��,這些策略可能包括為有償延遲����、專利和解����、產(chǎn)品更新和收購競爭對手等����。處方專利和產(chǎn)品更新是基于處方延遲生物類似藥競爭的方法。產(chǎn)品更新是原研公司在現(xiàn)有處方基礎(chǔ)上研制新處方��,從而提高治療效果或患者依從性����,使到期的專利處方轉(zhuǎn)向新處方。因此生物類似藥產(chǎn)品開發(fā)的第一步是審查有關(guān)分子����、工藝和藥物產(chǎn)品的知識產(chǎn)權(quán)。非侵權(quán)處方開發(fā)需要來自各方面(知識產(chǎn)權(quán)�����、處方工藝��、產(chǎn)品開發(fā)和項(xiàng)目管理)的意見����。決策如圖所示
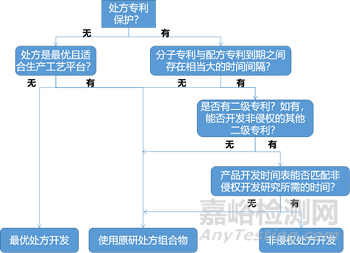
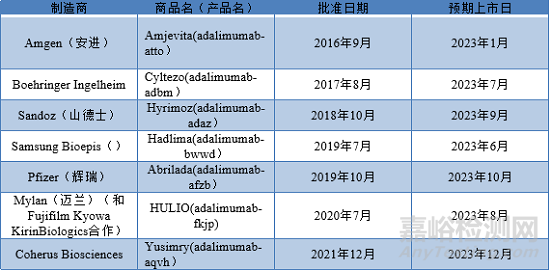
阿達(dá)木單抗(Humira®)(用于治療類風(fēng)濕性關(guān)節(jié)炎)的主要專利分別于2016和2018年在美國和歐洲到期����。但AbbVie公司擁有200多項(xiàng)與該藥物的處方和生產(chǎn)過程相關(guān)二級專利(“專利叢林”)����,這使其能夠在2023年之前保持其作為該行業(yè)壟斷地位��。AbbVie 與部分生物類似藥研發(fā)公司簽署了許可協(xié)議����,允許他們于2023年1月后推出產(chǎn)品,因此2023年1月前AbbVie在主要市場仍然擁有壟斷地位�����。
除了處方專利外��,AbbVie還擁有與類風(fēng)濕關(guān)節(jié)炎和炎癥性腸病的劑量方案相關(guān)的次要專利����。這種對處方和劑量專利侵權(quán)的不確定性導(dǎo)致生物類似藥研發(fā)公司對AbbVie提起了多項(xiàng)訴訟。
Humira®首個(gè)上市處方為:甘露醇��、氯化鈉��、PS 80、檸檬酸鹽�����、磷酸鹽緩沖液和50 mg/mL阿達(dá)木單抗�����。最新處方為:甘露醇�����、PS 80����、磷酸鹽緩沖液和100 mg/mL阿達(dá)木單抗。目前批準(zhǔn)的生物類似藥均是以50mg/m LHumira®為參考處方進(jìn)行開發(fā)的��。
開發(fā)替代處方需要篩選不同的緩沖液和穩(wěn)定劑等輔料��,從而使其與原研藥相比����,具有相似或更好的穩(wěn)定性。CoherusBiosciences公司的處方篩選研究發(fā)現(xiàn)組氨酸-組氨酸琥珀酸緩沖液在 pH 5.2 ± 0.2 時(shí)處方具有較好的穩(wěn)定性����。穩(wěn)定劑篩選結(jié)果顯示����,山梨糖����、海藻糖�����、甘露醇對處方穩(wěn)定性影響相近����,而甘氨酸和精氨酸對阿達(dá)木單抗穩(wěn)定作用較甘露醇更好。通常情況�����,氯化鈉在較高濃度下會降低蛋白穩(wěn)定����,但當(dāng)氯化鈉的水平控制在100 mM以下時(shí),氯化鈉對處方具有穩(wěn)定作用�����。與其他表面活性劑相比,PS 80 對處方具有較好的熱穩(wěn)定性����,凍融和攪拌對選定處方穩(wěn)定性幾乎沒有明顯影響。2021年12月��,F(xiàn)DA批準(zhǔn)了Coherus Biosciences的生物類似藥 Yusimry™��。Yusimry™ 的處方為:甘氨酸��、PS 80�����、氯化鈉����、組氨酸緩沖液和 50 mg/mL adalimumab-aqvh。
單克隆抗體(mAB)開發(fā)替代處方的過程����,為了避免侵犯與處方相關(guān)的專利,選擇輔料是一個(gè)極其重要的步驟。通常篩選已普遍認(rèn)為安全的賦形劑(GRAS)�����,并驗(yàn)證其對特定給藥途徑的適當(dāng)限值����。
生物類似藥處方開發(fā)要點(diǎn):
生物類似藥開發(fā)的早期階段需要思考擬定的生物類似藥產(chǎn)品的處方是否可以與原研產(chǎn)品不同。FDA關(guān)于“生物類似藥開發(fā)和BPCI法案的問答” 的行業(yè)指導(dǎo)文件指出����,只要生物類似藥申請人能夠證明這兩種產(chǎn)品在安全性��、純度和效力方面沒有臨床意義的差異��,擬議的生物類似藥和原研藥之間的其他差異是可以接受的�����。截至2021年12月��,28種生物類似藥產(chǎn)品(不包括胰島素生物類似藥)已在美國獲得批準(zhǔn)�����,50%的獲批生物類似藥產(chǎn)品至少具有一種與原研產(chǎn)品不同的處方屬性�����。說明生物類似藥在符合安全性、純度和效力要求的前提下��,其處方是可以與原液產(chǎn)品不同����。
貝伐珠單抗(bevacizumab)原研產(chǎn)品為Genentech公司的Avastin®,處方組成為海藻糖��、磷酸緩沖液�����、PS 20和貝伐珠單抗�����。已批準(zhǔn)生物類似藥有Mvasi® 和Zirabev™��,Amgen公司的Mvasi®具有與原研藥Avastin®(Genentech公司)相似的處方成分����,有兩種規(guī)格(100 mg/4 mL 和 400 mg/16 mL,單劑量)。輝瑞的生物類似藥Zirabev™ 與原研藥相比�����,其處方成分(包括pH)完全不同����,處方由蔗糖、依地酸二鈉 (EDTA) ����、琥珀酸鹽緩沖液 (pH 5.5和PS 80 組成。Mvasi® 和 Zirabev™ 的容器封閉系統(tǒng)和原研產(chǎn)品 Avastin®均由西林瓶�����、橡膠塞和帶鋁蓋組成�����。
貝伐珠單抗(bevacizumab-bvzr)的Fucosylation(巖藻糖基化)����、terminal gal-actosylation(terminal gal- actosylation)和mannose(甘露糖基化)含量決定其物理和體內(nèi)活性性質(zhì)����,抗體巖藻糖基化與效應(yīng)活性有關(guān)�����,甘露糖含量會影響產(chǎn)品的藥代動力學(xué)(PK)����,半乳糖水平會影響補(bǔ)體依賴性細(xì)胞毒性(CDC)活性��。因此��,強(qiáng)制降解研究��,將其作為評估不同候選產(chǎn)品的可生產(chǎn)性��、處方開發(fā)��、方法開發(fā)��、資格認(rèn)證和轉(zhuǎn)讓��、確定關(guān)鍵質(zhì)量屬性和可比性評估的工具��。在生物類似藥開發(fā)中����,需要暴露于包括高溫����、光照和過氧乙酸條件下進(jìn)行比較性強(qiáng)制降解研究��,以證明生物類似藥與原研藥具有相似的降解特征(美國和歐盟 Avastin® 批次中都觀察在高溫條件下��,貝伐珠單抗形成聚體和片段����,倒置該藥物失去了效力)。處方基質(zhì)不同����,生物類似藥產(chǎn)品的降解速率也可能不同。
脫酰胺涉及從氨基酸殘基中去除酰胺基團(tuán)(-NH2)�����,從而形成天冬氨酸殘基的新化學(xué)基團(tuán)��。CDR 區(qū)域(或互補(bǔ)性決定區(qū)域)是mAb分子中參與與靶分子(例如致病蛋白)結(jié)合的特定部分��。這些區(qū)域?qū)慰寺】贵w的治療活性至關(guān)重要�����,其結(jié)構(gòu)的任何變化都可能影響單克隆抗體與其靶標(biāo)結(jié)合的能力����。高pH條件可能導(dǎo)致mAb分子的CDR區(qū)域發(fā)生脫酰胺?���?赡馨l(fā)生在生產(chǎn)過程中或單克隆抗體產(chǎn)品的存儲過程中。
凍融過程會導(dǎo)致非共價(jià)聚集��,從而影響藥物的質(zhì)量����。聚集程度取決于溶液的pH值和緩沖液濃度。研究顯示當(dāng)溫度從+25°C降至-30°C時(shí)����,磷酸鹽緩沖液的pH值下降幅度最大(3.6個(gè)單位)。相比之下��,其他緩沖液��,如鹽酸組氨酸��、醋酸鈉、醋酸組氨酸����、檸檬酸和琥珀酸鹽的pH增加小于1。因此�����,建議在選擇替代緩沖液或穩(wěn)定劑的同時(shí)進(jìn)行凍融研究��,以避免非共價(jià)聚集����。在決定對生物類似藥產(chǎn)品使用不同的 pH/緩沖劑系統(tǒng)時(shí),應(yīng)考慮降解的pH值依賴性差異及其對安全性和有效性的影響��。
蔗糖和海藻糖是液體和凍干處方中常用的穩(wěn)定劑����。在酸性條件下,尤其是pH低于5�����,海藻糖是一種比蔗糖或棉子糖更有效的穩(wěn)定劑�����。這是因?yàn)檎崽呛兔拮犹堑乃鉃檫€原糖的速度比海藻糖更快����,更容易導(dǎo)致還原糖引起的降解。蔗糖和海藻糖在凍干產(chǎn)物中保持無定形狀態(tài)����,不會與蛋白質(zhì)分子相分離,因此凍干制劑通常選擇蔗糖和海藻糖作為穩(wěn)定劑或凍干保護(hù)劑��。在生物類似藥處方中選擇替代穩(wěn)定劑時(shí)�����,重要的是要考慮與藥物的儲存方面的相容性����,必要時(shí)要求類似藥與原研藥處方相當(dāng)或具有更好的穩(wěn)定性。
聚山梨酯是相容性較好和低毒性的表面活性劑�����。但是����,它們實(shí)際上是不穩(wěn)定的����,會發(fā)生氧化和水解��,通常水解速率比自動氧化的速度慢�����。PS80和PS20的降解方式不同����,PS80更容易氧化,而PS20更容易水解形成顆粒�����;研究發(fā)現(xiàn)與含有PS 20的處方相比�����,含有PS 80的溶液性處方過氧化物含量更高����。水解途徑導(dǎo)致形成難溶的游離脂肪酸����,從而形成可見和亞可見的顆粒����。
發(fā)展趨勢
2020年中國生物類似藥市場規(guī)模達(dá)到3870億元����,全球生物藥研發(fā)投入約為1610億美元,其中中國生物藥研發(fā)投入約為470億元�����,占全球的比例約為23%�����。未來����,隨著政策支持和市場需求的增加,生物類似藥的研發(fā)投入將繼續(xù)增加����。與原研藥相比生物類似藥的審批流程較為簡化����,審批速度相對較快��,同時(shí)《生物類似藥研發(fā)與評價(jià)技術(shù)指導(dǎo)原則》等政策的出臺也為生物類似藥的審批提供了有力保障�����。未來�����,隨著監(jiān)管體制的不斷完善和技術(shù)的不斷進(jìn)步�����,生物類似藥的審批速度將會進(jìn)一步加快����。目前,國內(nèi)已經(jīng)獲批上市的生物類似藥品種較少����,但隨著技術(shù)的不斷進(jìn)步和政策的不斷支持����,未來生物類似藥的品種數(shù)量和質(zhì)量將會不斷提高����,同時(shí)產(chǎn)品線的豐富度也將會不斷增加。
參考文獻(xiàn):
【1】https://www.accessdata.fda.gov/drugsatfda_docs/nda.
【2】Deechongkit S, Aoki KH, Park SS, Kerwin BA. Biophysical comparability of the same protein from different manufacturers: a case study using Epoetin alfa from Epogen and Eprex. J Pharm Sci. 2006 Sep;95(9):1931-43. doi: 10.1002/jps.20649. PMID: 16850392.
【3】Goli VAR, Butreddy A. Biosimilar monoclonal antibodies: Challenges and approaches towards formulation. Chem Biol Interact. 2022 Oct 1;366:110116. doi: 10.1016/j.cbi.2022.110116. Epub 2022 Aug 23. PMID: 36007632.
【4】Jones GH, Carrier MA, Silver RT, Kantarjian H. Strategies that delay or prevent the timely availability of affordable generic drugs in the United States. Blood. 2016 Mar 17;127(11):1398-402. doi: 10.1182/blood-2015-11-680058. Epub 2016 Jan 27. PMID: 26817958; PMCID: PMC4915805.
【5】Bjeloševi? M, Zvonar Pobirk A, Planinšek O, Ahlin Grabnar P. Excipients in freeze-dried biopharmaceuticals: Contributions toward formulation stability and lyophilisation cycle optimisation. Int J Pharm. 2020 Feb 25;576:119029. doi: 10.1016/j.ijpharm.2020.119029. Epub 2020 Jan 15. PMID: 31953087.
【6】https://biosimilarsrr.com/biosimilars-reviews-reports.
【7】https://www.accessdata.fda.gov/scripts/cder/daf/.