今日,美國FDA宣布���,批準(zhǔn)Seres Therapeutics公司口服微生物組療法Vowst(SER-109)上市���,用于在18歲以上成人中預(yù)防艱難梭菌感染(CDI)復(fù)發(fā)�����,這些患者曾經(jīng)接受過抗生素治療�。新聞稿指出�����,這是FDA批準(zhǔn)的首款口服糞便微生物組療法�����,代表著微生物組療法研發(fā)的重要里程碑�。這款療法在過去的十年里���,經(jīng)歷了一波三折�,如今終于碩果累累�。它的獲批歷程也印證了該公司聯(lián)合創(chuàng)始人,同時也是著名風(fēng)投公司Flagship Pioneering的創(chuàng)始人兼首席執(zhí)行官Noubar Afeyan博士的觀點:“創(chuàng)新科學(xué)研究需要經(jīng)歷不斷的挫敗與經(jīng)驗積累�����,方能成就輝煌�。”
人體的腸道中寄生著大量的微生物���,這一微生物生態(tài)系統(tǒng)與人體產(chǎn)生緊密的相互作用,影響到生理學(xué)的多個方面���。因此腸道菌群失調(diào)可能與多種疾病相關(guān)���,其中包括炎癥性腸病(IBD)�,癌癥,自閉癥�,以及包括糖尿病,心血管疾病和肥胖癥在內(nèi)的代謝類疾病���。有鑒于此���,我們能否揭示微生物組的奧秘,并利用它們改善人類健康呢�����?秉持這一使命���,F(xiàn)lagship Pioneering聯(lián)手創(chuàng)建了Seres Therapeutics公司���,于2012年嶄露頭角���。它的目標(biāo)是將對微生物組的洞見轉(zhuǎn)化為全新的口服療法類型,通過調(diào)節(jié)腸道微生物組治療或預(yù)防多種疾病�。
SER-109是該公司的研發(fā)重點之一,它由多種厚壁菌門菌種的純化細(xì)菌孢子組成�。這些微生物在調(diào)節(jié)艱難梭菌生命周期和CDI疾病發(fā)生方面具有重要作用。在1b期臨床試驗中�����,高達(dá)86.7%的患者達(dá)到試驗主要終點�����。2015年�����,美國FDA授予這一療法突破性療法認(rèn)定�����,意味著它與已有CDI療法相比�����,具有為患者提供顯著獲益的潛力�。
SER-109是一種口服、生物源性微生物組治療藥物�����,由多種厚壁菌門菌種的純化細(xì)菌抱子組成�,旨在減少艱難梭菌感染(CDI) 的復(fù)發(fā),使患者通過打破CDI復(fù)發(fā)的惡性循環(huán)�,恢復(fù)胃腸道微生物組多樣性,達(dá)到臨床緩解�。
適應(yīng)癥:復(fù)發(fā)性艱難梭菌感染
商品名:Vowst
上市申請方:Seres Therapeutics
作用機制:胃腸道微生物組調(diào)節(jié)劑
藥物類別:微生物藥物
FDA首次批準(zhǔn)日期:2023年4月26日
然而,2016年Seres宣布SER-109在2期臨床試驗的中期分析中未達(dá)到主要終點�,在接受治療8周之后,患者與對照組相比���,CDI復(fù)發(fā)風(fēng)險并未顯著降低�����。這一結(jié)果為SER-109的開發(fā)前景蒙上了一層陰影�����。
對臨床試驗數(shù)據(jù)的進(jìn)一步分析顯示���,對CDI患者的誤診和用藥劑量不足可能是導(dǎo)致試驗結(jié)果不如預(yù)期的原因�����。接下來是對療法漫長的進(jìn)一步優(yōu)化和啟動新一輪的臨床試驗�。在這個過程中�����,Seres公司經(jīng)歷了公司重組�����,在2019年不得不裁員30%���,將資源集中用于推動少數(shù)幾個后期臨床開發(fā)項目上。幸運的是�,研究人員始終對SER-109的潛力充滿信心,將其視為繼續(xù)研發(fā)的重點項目之一�����。
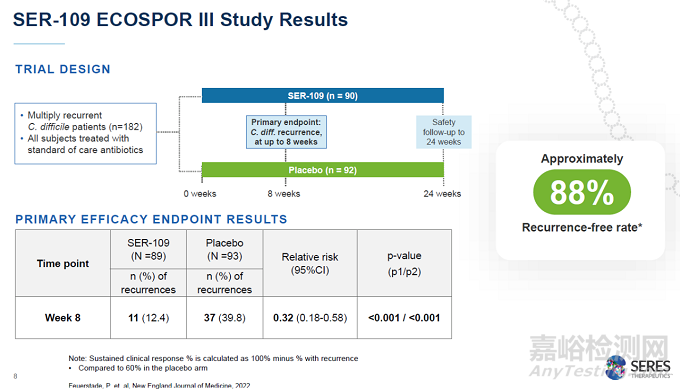
Seres公司的堅持在2020年終于收獲回報,在關(guān)鍵性3期臨床試驗ECOSPOR III中�����,SER-109達(dá)到試驗的主要終點���,接受治療8周后���,SER-109組患者的復(fù)發(fā)率為12.4%,而安慰劑患者為39.8%�����。與安慰劑組相比�����,SER-109治療組的疾病復(fù)發(fā)相對風(fēng)險為0.32(95% CI�����,0.18�,0.58)�����。這項臨床試驗的結(jié)果在著名醫(yī)學(xué)期刊《新英格蘭醫(yī)學(xué)雜志》和《美國醫(yī)學(xué)會雜志》上發(fā)表���。去年10月,SER-109的生物制品許可申請獲得美國FDA授予的優(yōu)先審評資格�。
▲SER-109的3期臨床試驗結(jié)果(圖片來源:Seres公司官網(wǎng))
Flagship Pioneering的創(chuàng)始人兼首席執(zhí)行官Noubar Afeyan博士在今年年初發(fā)表的公開信中表示,創(chuàng)新技術(shù)平臺的突破需要時間�。核聚變研究在經(jīng)過幾十年的挫折之后,在去年年底獲得突破���?��;趍RNA的新抗原癌癥疫苗去年首次在隨機對照臨床試驗中顯著降低黑色素瘤復(fù)發(fā)或死亡風(fēng)險,而Moderna的mRNA技術(shù)平臺也經(jīng)歷了近10年的優(yōu)化�����。Seres公司從創(chuàng)建至今�,其口服腸道微生物組平臺也經(jīng)歷了十余年的優(yōu)化�����。如今,SER-109不但為解決未竟醫(yī)療需求提供了新選擇�,也有望開啟微生物療法的新時代。
誠然�,將微生物療法推廣到治療其它疾病仍然有許多路要走,前途也充滿了各種挑戰(zhàn)���,近日���,Seres公司的另一款微生物組療法SER-287在治療潰瘍性結(jié)腸炎的臨床試驗中并未達(dá)到預(yù)期效果。然而���,Noubar Afeyan博士在公開信中堅定地表示�,面對挑戰(zhàn)的堅韌不拔是創(chuàng)新者必須具備的品質(zhì)���。這些突破的實現(xiàn)提醒我們�����,將目光專注于遠(yuǎn)在地平線上的終極目標(biāo)將帶來無限的可能性�����!
康德為全球生物醫(yī)藥行業(yè)提供一體化���、端到端的新藥研發(fā)和生產(chǎn)服務(wù)�����,服務(wù)范圍涵蓋化學(xué)藥研發(fā)和生產(chǎn)�、生物學(xué)研究�、臨床前測試和臨床試驗研發(fā)、細(xì)胞及基因療法研發(fā)�、測試和生產(chǎn)等領(lǐng)域。如您有相關(guān)業(yè)務(wù)需求�����,歡迎點擊下方圖片填寫具體信息�。
參考資料:
[1] Seres one step closer to bringing first oral microbiome therapy to market as FDA mulls approval. Retrieved April 26, 2023, from https://www.fiercebiotech.com/biotech/seres-step-closer-bringing-first-microbiome-therapy-market-fda-mulls-approval
[2] New CEO axes 30% of Seres’ workforce to refocus on ‘high priority’ late-stage efforts. Retrieved April 26, 2023, from https://www.fiercebiotech.com/biotech/new-ceo-axes-30-seres-workforce-to-refocus-high-priority-late-stage-efforts
[3] Seres Therapeutics. Retrieved April 26, 2023, from https://www.flagshippioneering.com/companies/seres-therapeutics#:~:text=Founded%20by%20Flagship%20Pioneering%20in,bacterial%20diversity%20and%20function%20is
[4] SERES THERAPEUTICS RECEIVES FDA BREAKTHROUGH THERAPY DESIGNATION FOR ITS LEAD PRODUCT CANDIDATE, SER-109. Retrieved April 26, 2023, from https://ir.serestherapeutics.com/news-releases/news-release-details/seres-therapeutics-receives-fda-breakthrough-therapy-designation
[5] Seres’ microbiome drug fails to reduce C. difficile recurrence risk. Retrieved April 26, 2023, from https://www.healio.com/news/gastroenterology/20160801/seres-microbiome-drug-fails-to-reduce-c-difficile-recurrence-risk
[6] FDA Approves First Orally Administered Fecal Microbiota Product for the Prevention of Recurrence of Clostridioides difficile Infection. Retrieved April 26, 2023, from https://www.prnewswire.com/news-releases/fda-approves-first-orally-administered-fecal-microbiota-product-for-the-prevention-of-recurrence-of-clostridioides-difficile-infection-301808930.html