摘 要Abstract
交叉污染是指不同原料����、輔料及產(chǎn)品之間發(fā)生的相互污染。當(dāng)使用共用設(shè)施設(shè)備生產(chǎn)不同藥品時����,潛在的交叉污染就成為了一項極其關(guān)鍵的風(fēng)險管控問題。近年來����,全球許多藥品監(jiān)管機(jī)構(gòu)或組織針對共用設(shè)施、共線生產(chǎn)質(zhì)量管理以及產(chǎn)生的交叉污染�����,更新發(fā)布了相關(guān)法規(guī)和指南�����。但目前��,共用設(shè)施下的交叉污染及相關(guān)缺陷項目(如多產(chǎn)品共線評估、清潔驗證有效性等)依然高頻出現(xiàn)在其發(fā)布的GMP 檢查不符合項中�����。本文從藥品共線生產(chǎn)質(zhì)量管理基本原則����,即法律法規(guī)要求、藥品上市許可持有人主責(zé)����、產(chǎn)品的生命周期和清潔驗證的生命周期,以及質(zhì)量風(fēng)險管理等方面�����,論述了全球不同藥品監(jiān)管機(jī)構(gòu)或組織對藥品共線生產(chǎn)質(zhì)量管理和交叉污染的監(jiān)管要求����,并匯總形成了相應(yīng)的管理流程和方法�����,以供相關(guān)監(jiān)管人員和藥品生產(chǎn)企業(yè)人員參考��。
Cross contamination is the mutual contamination of different raw materials, excipients and finished products.Potential cross contamination is a very critical risk control issue when different drug products are manufactured in shared facilities. In recent years, different regulatory authorities or organizations have issued and updated the regulations and guidelines against shared facilities, collinear production management and cross contamination. Cross contamination in shared facilities and related defect items (such as collinear production assessment and cleaning validation) still frequently appear in the Good Manufacturing Practice (GMP) non-conformance items issued by many drug regulatory agencies or organizations around the world. This paper discussed the regulatory requirements of different regulatory authorities or organizations on cross contamination and collinear production management mainly from the following aspects: requirements of laws and regulations, drug marketing authorization holder’s principle responsibility, product lifecycle, cleaning validation lifecycle and quality risk management. Besides, it also summarized relevant management procedures and methods, expecting to provide reference for relevant regulators and personnel of drug-manufacturing enterprises.
鑒于已知的藥品產(chǎn)品特性與風(fēng)險, 世界衛(wèi)生組織(World Health Organization����,WHO)、藥品檢查合作計劃(Pharmaceutical Inspection Co-operation Scheme�����,PIC/S)以及中國�����、美國�����、歐盟等國家和地區(qū)的藥品監(jiān)管機(jī)構(gòu)要求使用專用或隔離的獨立廠房設(shè)施設(shè)備生產(chǎn)部分特殊產(chǎn)品����,包括高致敏性藥品(如青霉素類)、生物制品(如卡介苗或其他用活性微生物制備而成的藥品)����、β- 內(nèi)酰胺結(jié)構(gòu)類藥品,以及某些激素類、細(xì)胞毒性類����、高活性化學(xué)藥品[1-3]。此外�����,如何在藥品共線生產(chǎn)質(zhì)量管理活動中有效識別多產(chǎn)品共線生產(chǎn)的交叉污染風(fēng)險(如生產(chǎn)設(shè)施�����、系統(tǒng)��、設(shè)備等共用風(fēng)險)�����,共線生產(chǎn)質(zhì)量管理體系需要包含的關(guān)鍵項目��,以及必須采取的合適的風(fēng)險控制和緩解措施等�����,始終是其GMP 關(guān)注的基本方面��。
我國國家藥品監(jiān)督管理局食品藥品審核查驗中心于2023 年3 月6 日發(fā)布了《藥品共線生產(chǎn)質(zhì)量風(fēng)險管理指南》[4](以下簡稱《指南》)����。《指南》的發(fā)布并非“新”的或是“額外”的要求�����,而是依托我國現(xiàn)行GMP 要求�����,結(jié)合我國現(xiàn)階段藥品共線生產(chǎn)質(zhì)量管理實際制定的一份細(xì)化文件����?�!吨改稀访鞔_了藥品共線生產(chǎn)質(zhì)量管理需要遵守的法律法規(guī)及規(guī)范要求��,明確了藥品上市許可持有人(marketing authorization holder,MAH)主責(zé)原則�����、生命周期原則��、質(zhì)量風(fēng)險管理原則、風(fēng)險控制措施與收益整體平衡原則�����,并要求構(gòu)建一套完整的基于產(chǎn)品知識�����、工藝知識的藥品共線生產(chǎn)質(zhì)量管理體系����。
廣大藥品生產(chǎn)企業(yè)應(yīng)當(dāng)結(jié)合國內(nèi)外藥品監(jiān)管機(jī)構(gòu)或組織對共線生產(chǎn)質(zhì)量管理的要求,建立完善的����、貫穿藥品全生命周期的共線生產(chǎn)質(zhì)量管理體系,采取有效的防止交叉污染的控制措施��,更好地保障藥品生產(chǎn)安全�����。
一�����、國內(nèi)外藥品共線生產(chǎn)質(zhì)量管理需要遵守的法律法規(guī)要求
筆者梳理了中國、美國����、歐盟藥品監(jiān)管機(jī)構(gòu)以及PIC/S 對于交叉污染和共線生產(chǎn)質(zhì)量管理的監(jiān)管要求如下����。
我國GMP 第四十六條明確了對藥品共線生產(chǎn)的要求,強(qiáng)調(diào)了多產(chǎn)品共線生產(chǎn)評估要點�����,包括藥品的特性�����、工藝����、預(yù)定用途、廠房設(shè)施設(shè)備等[1]�����。
美國現(xiàn)行GMP 為《動態(tài)藥品生產(chǎn)管理規(guī)范》(Current Good Manufacture Practices��,CGMP), 其中第C 子部分《廠房和設(shè)施》(Buildings and Facilities) 第211.42 節(jié)《設(shè)計與建造特點》(Design and Construction Features)(c)部分明確了對藥品生產(chǎn)操作區(qū)域�����、隔離區(qū)域��、相關(guān)控制系統(tǒng)等的要求��,以防止在操作過程中發(fā)生污染或混淆[3]����。
歐盟GMP 第一部分《藥品生產(chǎn)的基本要求》(Basic Requi rements for Medicinal Products)第三章《廠房與設(shè)備》(Premises and Equipment)3.6項規(guī)定,所有產(chǎn)品均應(yīng)當(dāng)通過恰當(dāng)?shù)脑O(shè)計與制造設(shè)施操作來避免交叉污染��;預(yù)防交叉污染的措施應(yīng)當(dāng)與風(fēng)險相適應(yīng)�����;應(yīng)當(dāng)使用質(zhì)量風(fēng)險管理基本原則來評估與控制風(fēng)險[4]��。
PIC/S 發(fā)布的043-1《共享設(shè)施交叉污染檢查備忘錄》(Aide-Memoire Cross-Contamination In Shared Facilities)提出�����,應(yīng)根據(jù)所處理材料的危害性確定風(fēng)險控制措施��,并通過由GMP、質(zhì)量控制(quality control����,QC)、質(zhì)量風(fēng)險管理(quality riskmanagement��,QRM) 三者有機(jī)結(jié)合的質(zhì)量保證系統(tǒng)(quality assurance system��,QAS)正確實施����;充分記錄控制措施并監(jiān)測其有效性��,并在考慮科技進(jìn)步的情況下進(jìn)行定期審查����;交叉污染風(fēng)險管理體系必須與患者保護(hù)明確關(guān)聯(lián)起來[5]。
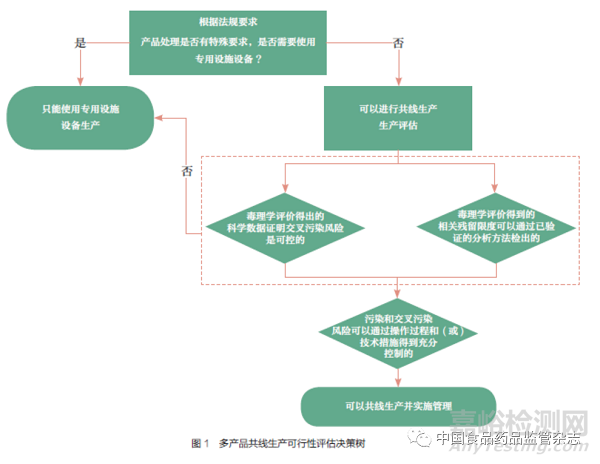
筆者結(jié)合上述針對交叉污染和共線生產(chǎn)質(zhì)量管理的監(jiān)管要求��,總結(jié)形成了多產(chǎn)品共線生產(chǎn)可行性評估決策樹����,如圖1 所示。除了決策樹中描述的情形��,即便經(jīng)過風(fēng)險評估得出可以共線生產(chǎn)的結(jié)論,也仍會有不可接受的風(fēng)險�����,還需要進(jìn)一步評估共線生產(chǎn)的可行性��。例如����,對于疫苗類產(chǎn)品,原液制備要求設(shè)施設(shè)備獨立����,灌裝工序可以共線生產(chǎn),但是用于共線生產(chǎn)的設(shè)備的關(guān)鍵部件����、器具等是否專用則仍需要進(jìn)一步評估論證。
二�����、國內(nèi)外藥品共線生產(chǎn)質(zhì)量管理需要依據(jù)的原則
(一)藥品上市許可持有人主責(zé)原則
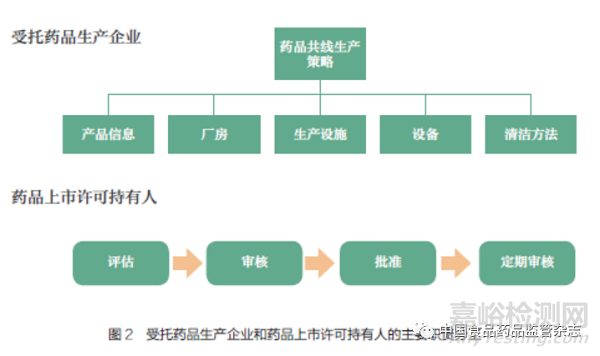
MAH 和受托藥品生產(chǎn)企業(yè)應(yīng)當(dāng)按照法律法規(guī)要求����,建立共線生產(chǎn)質(zhì)量管理體系����。雙方的主要職責(zé)分工應(yīng)在委托合同和質(zhì)量協(xié)議中明確說明����,如圖2 所示。
國家藥監(jiān)局發(fā)布的《藥品上市許可持有人檢查要點(征求意見稿)》針對共線生產(chǎn)評估提出“持有人應(yīng)當(dāng)對受托生產(chǎn)企業(yè)共線生產(chǎn)風(fēng)險控制措施的有效性進(jìn)行定期審核����,若共線生產(chǎn)品種發(fā)生變更,需重新進(jìn)行風(fēng)險評估”的要求[6]�����。
美國食品藥品監(jiān)督管理局(FDA)行業(yè)指南《藥品委托生產(chǎn)安排:質(zhì)量協(xié)議》(Guidance for Industry: Contract Manufacturing Arrangements for Drugs: Quality Agreements)規(guī)定�����,如果受托方為多個所有者生產(chǎn)藥品����,質(zhì)量協(xié)議應(yīng)指出各方要如何溝通關(guān)于防止交叉污染和維護(hù)可追溯性[7]����。
歐盟GMP 第一部分《藥品生產(chǎn)的基本要求》(Basic Requi rements for Medicinal Products) 第七章《外包活動》(Outsourced Activities)規(guī)定�����,委托方有最終責(zé)任確保通過相關(guān)程序使外包活動受控[3]����。
因此�����,針對受托方的共線生產(chǎn)活動����,MAH 的管理職責(zé)應(yīng)包含評估、審核��、批準(zhǔn)以及定期審核����、回顧、變更與風(fēng)險評估等�����,且相關(guān)內(nèi)容應(yīng)在委托合同和質(zhì)量協(xié)議中體現(xiàn)。受托方應(yīng)根據(jù)委托合同和質(zhì)量協(xié)議中的職責(zé)內(nèi)容積極執(zhí)行����。
(二)生命周期原則
藥品共線生產(chǎn)質(zhì)量管理策略中提及的生命周期涵蓋藥品研發(fā)、技術(shù)轉(zhuǎn)移�����、藥品生產(chǎn)����、上市后監(jiān)測四個階段。針對上述各階段����,共線生產(chǎn)質(zhì)量管理需要重點進(jìn)行的活動與數(shù)據(jù)收集工作如圖3 所示。
值得關(guān)注的是�����,共線生產(chǎn)質(zhì)量管理中的清潔驗證是針對藥品生命周期開展的����,即將清潔驗證分為清潔工藝設(shè)計和開發(fā)��、清潔工藝驗證、持續(xù)清潔工藝確認(rèn)三個階段�����。
1. 清潔工藝設(shè)計和開發(fā)
在共線生產(chǎn)的場景下�����,清潔工藝設(shè)計和開發(fā)階段是清潔驗證工作的重點����。其典型活動包括收集積累藥品藥理學(xué)和毒理學(xué)數(shù)據(jù),如基于健康的暴露限度(healthbased exposure limit�����,HBEL)數(shù)據(jù)����,制訂清潔工藝開發(fā)方案,選擇合適的清洗劑��,建立清潔劑殘留分析方法�����、清潔操作規(guī)程以及相應(yīng)的可接受標(biāo)準(zhǔn)。
2. 清潔工藝驗證
清潔工藝驗證主要包括確認(rèn)設(shè)備�����、公用工程與系統(tǒng)狀態(tài)����,創(chuàng)建清潔工藝驗證方案(包括選擇取樣點、取樣方法等)����,開展相關(guān)工作人員培訓(xùn),執(zhí)行清潔工藝驗證方案并形成最終的驗證報告�����。
3. 持續(xù)清潔工藝確認(rèn)
持續(xù)清潔工藝確認(rèn)主要包括建立定期評審制度�����,確定清潔工藝取樣和檢測的擴(kuò)展范圍��,監(jiān)控清潔工藝能力����,審核偏差和變更項目。
在清潔驗證方面��, 國際制藥工程協(xié)會(International Society for Pharmaceutical Engineering����,ISPE) 發(fā)布的指南《清潔驗證生命周期》(Cleaning Validation Lifecycle)[8] 可供藥品生產(chǎn)企業(yè)參考。
在藥品生命周期的各個階段�����,藥品生產(chǎn)企業(yè)均應(yīng)確保質(zhì)量管理體系有效運(yùn)行并實現(xiàn)持續(xù)改進(jìn)����, 尤其是針對生命周期中的變更管理。在共線生產(chǎn)的場景下��,藥品生產(chǎn)企業(yè)應(yīng)建立標(biāo)準(zhǔn)作業(yè)程序(standard operating procedure�����,SOP)����,對評估、批準(zhǔn)和實施建議的變更(如新產(chǎn)品引入�����、產(chǎn)品規(guī)格發(fā)生變化等)進(jìn)行描述和管理;對變更管理活動有清晰的職責(zé)描述(涉及MAH�����、受托藥品生產(chǎn)企業(yè)等)����;對實施變更的后續(xù)措施進(jìn)行檢查(如在每批產(chǎn)品生產(chǎn)結(jié)束后進(jìn)行殘留檢測)與回顧,最終確認(rèn)變更對于共線生產(chǎn)質(zhì)量管理是有效的�����。
(三)質(zhì)量風(fēng)險管理原則
ICH Q9《質(zhì)量風(fēng)險管理》(Quality Risk Management)[9] 概述了一個持續(xù)迭代的風(fēng)險管理過程�����,包括危害的識別�����、分析和評估����,以及對相關(guān)風(fēng)險的控制策略��。該指南鼓勵在藥品生命周期內(nèi)采用基于科學(xué)和風(fēng)險的方法。
在開展共線生產(chǎn)風(fēng)險評估時����,基于質(zhì)量風(fēng)險管理的原則,使用風(fēng)險管理工具評估潛在的風(fēng)險����,并通過風(fēng)險評估將所識別和分析的風(fēng)險與給定的風(fēng)險標(biāo)準(zhǔn)進(jìn)行對比,確定影響擬共線生產(chǎn)品種安全性和質(zhì)量的潛在因素����。
ISPE 基準(zhǔn)指南《基于風(fēng)險的藥品生產(chǎn)》(Risk-Based Manufacture of Pharmaceutical Products)[10] 提供了一系列基于風(fēng)險分析的方法,以管理所有級別藥品生產(chǎn)過程中交叉污染的風(fēng)險��, 從而保證將交叉污染維持或低于可接受限度����。該指南初始關(guān)注點是GxP(Good “x” Practice,良好管理規(guī)范)提到的交叉污染內(nèi)容��,且對工業(yè)衛(wèi)生(涉及操作人員安全)相關(guān)內(nèi)容也進(jìn)行了充分說明�����。
藥品生產(chǎn)企業(yè)在計劃實施共線生產(chǎn)質(zhì)量管理時, 應(yīng)當(dāng)基于質(zhì)量源于設(shè)計(Quality by Design��,QbD) 的原則����, 在廠房設(shè)施設(shè)計階段通過對擬共線生產(chǎn)品種的GMP 監(jiān)管因素可行性和環(huán)境健康安全(environment health safety,EHS)領(lǐng)域的職業(yè)健康衛(wèi)生因素可行性進(jìn)行分析����,對潛在風(fēng)險進(jìn)行識別分析并采取充分的控制措施,以及充分建立防止交叉污染的控制措施��, 保持交叉污染的風(fēng)險在可接受水平以下����。
歐盟GMP 第一部分《藥品生產(chǎn)的基本要求》(Basic Requi rements for Medicinal Products) 第五章《生產(chǎn)》(Production) 的5.21 部分明確表示:“應(yīng)根據(jù)質(zhì)量風(fēng)險管理過程的結(jié)果來決定用于控制交叉污染風(fēng)險所需的技術(shù)和組織方面的措施。”[3] 因此��,藥品生產(chǎn)企業(yè)應(yīng)從技術(shù)層面和組織層面對共用設(shè)施交叉污染控制措施進(jìn)行持續(xù)改進(jìn)和完善��。
在技術(shù)層面��,密閉技術(shù)是藥品生產(chǎn)過程中防止污染和交叉污染的重要措施��,密閉設(shè)備在控制交叉污染方面起著重要作用,有望成為制藥行業(yè)的應(yīng)用熱點�����。根據(jù)共線生產(chǎn)品種的危害程度��,ISPE 發(fā)布的良好實踐指南《強(qiáng)效化合物密閉》(Containment for Potent Compounds)[11] 推薦了以下控制措施��。
一級密閉是指從實際生產(chǎn)設(shè)備中減少物質(zhì)的擴(kuò)散的措施����,主要包括:為壓片機(jī)增加外殼和附加設(shè)備(如除塵單元)��;用于活性藥物成分(active pharmaceutical ingredient��,API)稱重的隔離器��;局部排風(fēng)系統(tǒng)�����。
二級密閉指的是減少在主要密閉隔離范圍以外的物質(zhì)擴(kuò)散的措施����,主要包括:潔凈室;在生產(chǎn)區(qū)和走廊之間的氣鎖系統(tǒng)和壓差。
在組織層面��,清潔工藝開發(fā)和驗證仍然是有效控制共線生產(chǎn)設(shè)施交叉污染的重要研究方向��。對于計劃開展藥品共線生產(chǎn)的企業(yè)而言��,共線生產(chǎn)風(fēng)險控制相關(guān)內(nèi)容都需要被納入到質(zhì)量管理體系相關(guān)文件中�����,如清場��、變更管理��、糾正和預(yù)防措施(corrective action and preventive action��,CAPA)��、培訓(xùn)和日常監(jiān)測等����。
計劃開展藥品共線生產(chǎn)的企業(yè)應(yīng)當(dāng)在項目早期(如概念設(shè)計階段),就開始考慮共線生產(chǎn)質(zhì)量管理的總體質(zhì)量策略�����,并設(shè)計建立設(shè)備密閉驗收標(biāo)準(zhǔn),在項目交付運(yùn)營之前建立共線生產(chǎn)質(zhì)量管理體系��,從而控制與廠房設(shè)施設(shè)計��、設(shè)備系統(tǒng)選型�����、日常監(jiān)測等方面相關(guān)聯(lián)的交叉污染風(fēng)險��。
(四)風(fēng)險控制措施與收益整體平衡原則
藥品生產(chǎn)企業(yè)人員普遍認(rèn)為�����,風(fēng)險幾乎是不能被完全消除的�����,風(fēng)險管理的參與者只能盡量減少風(fēng)險�����。部分企業(yè)人員已經(jīng)認(rèn)識到����,在進(jìn)一步采取措施控制風(fēng)險的過程中,當(dāng)風(fēng)險降低到一定程度時可能會達(dá)到收益遞減點����。因此,他們會保留那些對所分析的生產(chǎn)活動影響不大的低水平風(fēng)險�����,以求生產(chǎn)出符合質(zhì)量要求的產(chǎn)品�����。這些風(fēng)險被歸類為“低至合理可行”(as low as reasonably practicable��,ALARP)[12]�����, 企業(yè)人員會根據(jù)風(fēng)險及收益分析情況來選擇是否接受����。
一般情況下,針對高風(fēng)險無需考慮成本����,應(yīng)盡可能降低風(fēng)險����;而對于接近可接受區(qū)域的風(fēng)險�����,在技術(shù)與經(jīng)濟(jì)平衡方面則有較大的靈活性��。需要注意的是�����,藥品生產(chǎn)企業(yè)人員在沒有采取進(jìn)一步的控制措施或沒有進(jìn)行正式的風(fēng)險及收益分析時��,不應(yīng)當(dāng)接受不可容忍的風(fēng)險����。
三��、對藥品共線生產(chǎn)質(zhì)量管理的思考和建議
基于上述對國內(nèi)外共線生產(chǎn)質(zhì)量管理監(jiān)管要求的分析和比較�����,建議藥品生產(chǎn)企業(yè)制訂共線生產(chǎn)質(zhì)量管理總體規(guī)劃��,并建立適宜的風(fēng)險評估方法和控制措施,以確保交叉污染風(fēng)險得到有效控制��。具體措施和建議包括:為藥品共線生產(chǎn)策略的設(shè)計����、實施及改進(jìn)提供分析和指導(dǎo);基于質(zhì)量風(fēng)險管理的理念����,理解藥品共線生產(chǎn)可能存在的風(fēng)險,以及暴露和風(fēng)險的關(guān)系�����;科學(xué)確定殘留可接受限度��;建立殘留物的分析方法����;分析產(chǎn)生交叉污染的途徑;采取降低交叉污染的措施����;持續(xù)監(jiān)控交叉污染水平。
四��、結(jié)語
目前,國內(nèi)外許多藥品監(jiān)管機(jī)構(gòu)和組織都對藥品共線生產(chǎn)的交叉污染風(fēng)險給予了高度關(guān)注����,要求在GMP 檢查過程中關(guān)注藥品生產(chǎn)企業(yè)是否采取了針對交叉污染的風(fēng)險管理措施。藥品生產(chǎn)企業(yè)應(yīng)當(dāng)制訂共線生產(chǎn)質(zhì)量管理策略并加以文件化����,以確定藥品是否可以使用共用設(shè)施設(shè)備生產(chǎn),同時應(yīng)根據(jù)風(fēng)險評估的輸出結(jié)果確定必要的控制措施��,對共線生產(chǎn)的交叉污染風(fēng)險進(jìn)行管控��,科學(xué)��、合理地提供有效的共線生產(chǎn)管理措施��。同時�����,建議藥品監(jiān)管部門重點關(guān)注藥品生產(chǎn)企業(yè)在共線生產(chǎn)方面采取的實際控制措施和具體執(zhí)行情況����。