藥用輔料系指生產(chǎn)藥品和調(diào)配處方時使用的賦形劑和附加劑。是除活性成分或前體以外�����,在安全性方面已進(jìn)行合理的評估��,一般包含在藥物制劑中的物質(zhì)[1]�����。
藥品的細(xì)菌內(nèi)毒素檢查是確保藥品安全的重要檢查項(xiàng)目����,細(xì)菌內(nèi)毒素不符合規(guī)定的藥品在臨床應(yīng)用時可能產(chǎn)生熱原反應(yīng)而造成嚴(yán)重的不良反應(yīng)。對藥用輔料進(jìn)行細(xì)菌內(nèi)毒素控制的目的是為了保障藥品制劑中所含致熱物質(zhì)符合規(guī)定����。來源于革蘭陰性細(xì)菌細(xì)胞壁的細(xì)菌內(nèi)毒素是藥品中最主要的致熱物質(zhì),即便是細(xì)菌已經(jīng)死亡����,細(xì)菌內(nèi)毒素可能在細(xì)胞壁碎片中 保 持 活 性[2-3]����。由于細(xì)菌內(nèi)毒素性質(zhì)穩(wěn)定[4]����,在生產(chǎn)工藝中很難清除。因此����,確保藥品細(xì)菌內(nèi)毒素符合規(guī)定最有效的手段就是源頭控制各種原輔料、包材等細(xì)菌內(nèi)毒素污染在可以接受的范圍內(nèi)�����。
基于風(fēng)險管理的理念�����,根據(jù)藥品安全性的需求����,應(yīng)科學(xué)�����、合理地在藥用輔料標(biāo)準(zhǔn)中設(shè)立細(xì)菌內(nèi)毒素檢查項(xiàng)及限度。本研究對現(xiàn)有藥用輔料細(xì)菌內(nèi)毒素控制和標(biāo)準(zhǔn)制定存在的問題進(jìn)行了分析����,對藥用輔料細(xì)菌內(nèi)毒素標(biāo)準(zhǔn)設(shè)定、限值計(jì)算����、生產(chǎn)過程中藥用輔料細(xì)菌內(nèi)毒素控制策略等進(jìn)行了探討,并對如何收載藥用輔料細(xì)菌內(nèi)毒素檢查項(xiàng)提出了建議�����。本研究提出了藥用輔料細(xì)菌內(nèi)毒素質(zhì)量控制和標(biāo)準(zhǔn)研究的指導(dǎo)性意見和規(guī)范性要求�����,對原料藥����、藥用輔料的細(xì)菌內(nèi)毒素和熱原控制均有參考意義和實(shí)際應(yīng)用價值。希望能為我國原輔包與制劑關(guān)聯(lián)審評審批制度下��,進(jìn)一步完善藥用輔料標(biāo)準(zhǔn)體系提供幫助����。
1�����、 各國藥典藥用輔料細(xì)菌內(nèi)毒素檢查現(xiàn)狀
1. 1 《中國藥典》通用技術(shù)要求中的有關(guān)規(guī)定
2020 年版《中國藥典》通則 0251《藥用輔料》中規(guī)定用于靜脈用注射劑��、沖洗劑等的藥用輔料按細(xì)菌內(nèi)毒素檢查法或熱原檢查法檢查應(yīng)符合規(guī)定[1]�����,在通則 0102《注射劑》和 0128《沖洗劑》中將細(xì)菌內(nèi)毒素或熱原列為一般應(yīng)檢查的項(xiàng)目[1]��,由此可見用于靜脈用注射劑��、沖洗劑等的藥用輔料的細(xì)菌內(nèi)毒素控制的重要性����。
2020 年版《中國藥典》通則 1143 和 1142 收載了細(xì)菌內(nèi)毒素檢查法和熱原檢查法��,對檢驗(yàn)方法提出了具體要求[1]����。指導(dǎo)原則 9251《細(xì)菌內(nèi)毒素檢查法應(yīng)用指導(dǎo)原則》,對于細(xì)菌內(nèi)毒素限值設(shè)定����、檢查方法選擇、樣品處理等進(jìn)行了進(jìn)一步說明[1]�����。指導(dǎo)原則 9301《注射劑安全性檢查法應(yīng)用指導(dǎo)原則》中��,對于細(xì)菌內(nèi)毒素�����、熱原檢查項(xiàng)目的設(shè)定提供了一般參考要求�����,并特別指出“注射劑用輔料使用面廣�����、用量大����、來源復(fù)雜,與藥品的安全性直接相關(guān)����。在其質(zhì)量控制中�����,應(yīng)根據(jù)藥用輔料的來源��、性質(zhì)�����、用途�����、用法用量�����,配合理化分析方法�����,設(shè)立必要的安全性檢查項(xiàng)目”[1]��。
上述標(biāo)準(zhǔn)中����,除注射劑安全性檢查法應(yīng)用指導(dǎo)原則對于注射劑用輔料提出了設(shè)立必要的安全性檢查項(xiàng)目的原則要求,均未對藥用輔料內(nèi)毒素�����、熱原控制提出具體可操作性的指導(dǎo)要求����。
1. 2 《中國藥典》藥用輔料標(biāo)準(zhǔn)中的收載情況
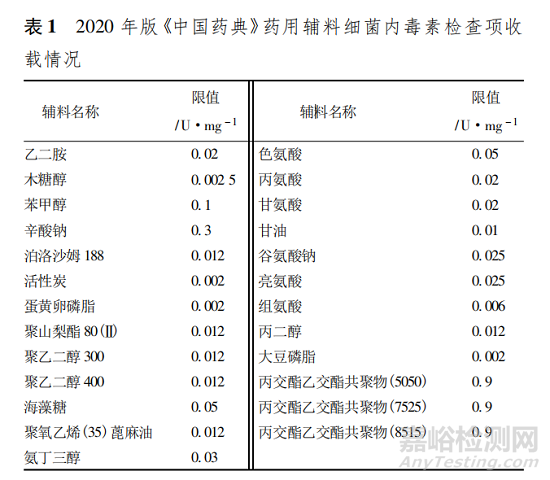
目前�����,藥用輔料標(biāo)準(zhǔn)大致有以下形式: 《中國藥典》收載的藥用輔料標(biāo)準(zhǔn)( 亦稱品種正文) �����、國家藥品監(jiān)管部門在實(shí)行原輔包與制劑關(guān)聯(lián)審評審批前批準(zhǔn)的藥用輔料的注冊標(biāo)準(zhǔn)�����、藥用輔料生產(chǎn)企業(yè)在生產(chǎn)藥用輔料時的內(nèi)控標(biāo)準(zhǔn)����、藥品生產(chǎn)企業(yè)為某藥用輔料建立的內(nèi)控標(biāo)準(zhǔn)、在原輔包登記平臺備案的標(biāo)準(zhǔn)等�����。2020 年版《中國藥典》有 25 個藥用輔料在品種標(biāo)準(zhǔn)中收載了供注射用藥用輔料的細(xì)菌內(nèi)毒素檢查項(xiàng),其內(nèi)毒素限值最小為 0. 002 U·mg - 1�����,最高為0. 9 U·mg - 1����,具體品種和限度見表 1。這些限度的設(shè)定參考了國外藥典��、注冊標(biāo)準(zhǔn)和部分收集到的企業(yè)內(nèi)控標(biāo)準(zhǔn)等����,在實(shí)際應(yīng)用中未必能符合各種制劑生產(chǎn)的需要。
1. 3 《中國藥典》藥用輔料細(xì)菌內(nèi)毒素標(biāo)準(zhǔn)設(shè)定
由于藥用輔料在制劑中用途廣泛��,用量也千差萬別����,這就給藥用輔料是否需要制定細(xì)菌內(nèi)毒素檢查項(xiàng)、如何確定細(xì)菌內(nèi)毒素檢查限值等帶來很大的挑戰(zhàn)����。存在的問題: 一是在原輔料與制劑關(guān)聯(lián)審評審批的政策下�����,如何更有效的通過控制原輔料的細(xì)菌內(nèi)毒素�����,以確保制劑最終符合規(guī)定。二是藥品生產(chǎn)企業(yè)如何針對制劑的需求����,正確制定某一藥用輔料細(xì)菌內(nèi)毒素限值,應(yīng)考慮哪些因素�����。三是作為通用的基礎(chǔ)性標(biāo)準(zhǔn)的《中國藥典》�����,藥用輔料細(xì)菌內(nèi)毒素限值一直以單一固定值的方式出現(xiàn)��,能否滿足不同制劑的不同需求�����,可能存在單一固定限值過嚴(yán)或者過松的問題。
1. 4 藥用輔料細(xì)菌內(nèi)毒素檢查新進(jìn)展
一些國際藥品標(biāo)準(zhǔn)中�����,已經(jīng)采用了基于風(fēng)險評估原則的原輔料細(xì)菌內(nèi)毒素污染控制理念�����?���!睹绹幍洹肥蛰d了細(xì)菌內(nèi)毒素檢查法指導(dǎo)原則,認(rèn)為控制原輔料細(xì)菌內(nèi)毒素污染水平可以最大限度的降低制劑的風(fēng)險�����。對于原輔料的細(xì)菌內(nèi)毒素限值計(jì)算提出了要求��。明確非藥典材料或物品在內(nèi)部檢測和放行時��,應(yīng)在徹底了解其對制劑的潛在貢獻(xiàn)后分配內(nèi)毒素限量����。從計(jì)算出的制劑的內(nèi)毒素量往回推算�����,可以為配方中的每一種成分分配限度��,并保證如果每種成分達(dá)到其限度����,不會超 過制劑的限度[5]��。
2�����、 藥用輔料細(xì)菌內(nèi)毒素控制及檢查法設(shè)定原則的思考
2. 1 藥用輔料設(shè)定細(xì)菌內(nèi)毒素檢查項(xiàng)的原則
對藥用輔料進(jìn)行細(xì)菌內(nèi)毒素( 或熱原) 檢查�����,目的是為了保證藥品的細(xì)菌內(nèi)毒素( 或熱原) 檢查符合規(guī)定��。一般情況下��,靜脈用注射劑����,椎管內(nèi)��、腹腔����、眼內(nèi)等特殊途徑的注射劑、沖洗液等所用藥用輔料��,以及用于其他對細(xì)菌內(nèi)毒素( 熱原) 有控制要求的藥品制劑生產(chǎn)的藥用輔料��,應(yīng)考慮在藥用輔料標(biāo)準(zhǔn)中制定細(xì)菌內(nèi)毒素( 或熱原) 檢查項(xiàng)��。
藥用輔料標(biāo)準(zhǔn)是否設(shè)立細(xì)菌內(nèi)毒素( 或熱原)檢查項(xiàng),應(yīng)基于風(fēng)險管理的理念��,采用“具體問題具體分析”的原則����,根據(jù)藥用輔料的來源��、性質(zhì)�����、用途����、用法用量等,并結(jié)合藥品生產(chǎn)工藝確定�����。
藥用輔料一般首選細(xì)菌內(nèi)毒素檢查法�����,部分中藥來源�����、多組分生化物質(zhì)����、生物技術(shù)來源的藥用輔料,或不能排除樣品對細(xì)菌內(nèi)毒素檢查法干擾作用的藥用輔料����,可選擇熱原檢查法。
無論《中國藥典》的藥用輔料標(biāo)準(zhǔn)中是否收載細(xì)菌內(nèi)毒素( 或熱原) 檢查項(xiàng)����,藥品研究者及上市許可持有人均應(yīng)在藥品研究和生產(chǎn)中選用能滿足藥品安全性和有效性的藥用輔料,并建立必要的內(nèi)控標(biāo)準(zhǔn)�����。
2. 2 基于制劑需求的藥用輔料細(xì)菌內(nèi)毒素檢查限度設(shè)定的思路
藥用輔料細(xì)菌內(nèi)毒素限值制定時����,應(yīng)確保制劑中來源于原料�����、各種藥用輔料及藥包材��、生產(chǎn)工藝過程中引入的內(nèi)毒素總量符合細(xì)菌內(nèi)毒素檢查法( 通則 1143) 的要求����。必要時不同輔料可以按照制劑配方比例混合后檢測��。藥用輔料用于制劑生產(chǎn)過程中需要進(jìn)行特殊處理的��,應(yīng)確保處理后的輔料細(xì)菌內(nèi)毒素污染符合制劑生產(chǎn)要求����。
藥用輔料的細(xì)菌內(nèi)毒素限值( L) 可參照公式 1確定。
公式中 L 為藥用輔料的細(xì)菌內(nèi)毒素限值��,一般以 U·mL - 1�����、U·mg - 1等表示; R 為藥品制劑生產(chǎn)過程中允許來源于該藥用輔料的細(xì)菌內(nèi)毒素占制劑的細(xì)菌內(nèi)毒素允許總量的比例,可參考該藥用輔料在藥品制劑中的占比����,并考慮藥品原料及其他輔料內(nèi)毒素控制情況����,適當(dāng)從嚴(yán)制定。生產(chǎn)過程中藥用輔料的允許內(nèi)毒素污染量可以根據(jù)產(chǎn)品處方工藝�����、輔料特點(diǎn)等反向指定�����,并保證每種成分來源的內(nèi)毒素總量不會超過制劑的內(nèi)毒素限度; K 取值同通則1143( 細(xì)菌內(nèi)毒素檢查法) ; M 為折合為人每千克體重每小時最大藥品劑量( 簡稱每劑藥品) 中對應(yīng)的藥用輔料用量。
同一藥用輔料在不同藥品中的用途����、用量差異可能較大,因此同一藥用輔料應(yīng)用于不同的藥品制劑生產(chǎn)時��,其內(nèi)控標(biāo)準(zhǔn)中的細(xì)菌內(nèi)毒素限值可能是不同的�����。
如經(jīng)過驗(yàn)證��,藥品制劑生產(chǎn)工藝過程可去除細(xì)菌內(nèi)毒素的,可根據(jù)細(xì)菌內(nèi)毒素清除情況�����,放寬藥用輔料內(nèi)控標(biāo)準(zhǔn)中細(xì)菌內(nèi)毒素檢查的限值或者不設(shè)定細(xì)菌內(nèi)毒素檢查項(xiàng)����。
2. 3 制劑生產(chǎn)過程中藥用輔料細(xì)菌內(nèi)毒素控制
通過一個實(shí)例,解釋藥用輔料細(xì)菌內(nèi)毒素限值制定的公式����,并說明藥品生產(chǎn)企業(yè)在實(shí)際生產(chǎn)過程中如何控制藥用輔料的細(xì)菌內(nèi)毒素��。
公式 1 中 R 值就是允許該部分藥用輔料中的內(nèi)毒素污染上限占制劑的內(nèi)毒素污染上限的比例�����。也就是該部分藥用輔料可以分配的內(nèi)毒素污染限額����。R 值可以參考不同組分在制劑中的質(zhì)量占比�����,但這只是其中的一個考慮因素��。
例如: 某靜脈注射途徑的藥品 S 的 60 kg 成人每 1 h 最大用量為50 mg�����,制劑規(guī)格為50 mg����,產(chǎn)品總質(zhì)量為 300 mg��,其中原料藥( API) 含量為 50 mg����,輔料 A 為 100 mg����,輔料 B 為 150 mg。
根據(jù)細(xì)菌內(nèi)毒素限值的制定要求�����,60 kg 人靜脈給藥時單次耐受的最大內(nèi)毒素量為 300 U����,因此規(guī)格為 50 mg 的制劑內(nèi)毒素限度為 300 U��。制劑內(nèi)毒素標(biāo)準(zhǔn)為: 取本品�����,依法檢查��,每 1 mg S 中含內(nèi)毒素的量應(yīng)小于 6. 0 U��。
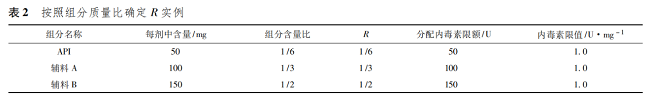
如果不考慮藥用輔料和生產(chǎn)工藝等因素��,原料藥的標(biāo)準(zhǔn)也會定為 6. 0 EU·mg - 1����,這樣��,所有藥用輔料等將無法制定內(nèi)毒素標(biāo)準(zhǔn)����。引入 R 的概念��,就是將產(chǎn)品中內(nèi)毒素限額合理的分配到制劑的各組分中����。假設(shè)原料藥和藥用輔料是同等重要的,在不考慮工藝�����、包材污染等情況下�����,就是按質(zhì)量占比分配內(nèi)毒素限額( 表 2) ����。
由表 2 可以看出����,計(jì)算出來的限度����,API 與不同的藥用輔料均相同��,各種組分內(nèi)毒素污染的最大限度和可以保證產(chǎn)品符合規(guī)定�����。實(shí)際工作中確定 R 值�����,不同組分的質(zhì)量比僅是參考�����,API 或者不同的藥用輔料對于內(nèi)毒素污染的貢獻(xiàn)可以是不同的����。一般認(rèn)為 API 是產(chǎn)品中最重要的組分�����,因此����,R 的分配可以多于質(zhì)量比。各種藥用輔料也可以根據(jù)用量��、內(nèi)毒素控制的難易程度等合理分配 R 值��。如上例中�����,如果指定 API 的 R 為 1 /2,則 API 內(nèi)毒素限值可以是 3. 0 U·mg - 1����。那么輔料A 和輔料 B 的 R 值和為 1 /2�����,按質(zhì)量比計(jì)算分別為1 /5 和3 /10����,計(jì)算二者內(nèi)毒素限值均為0. 6 U·mg - 1( 表 3) ��。如實(shí)際工作中�����,輔料 A 內(nèi)毒素?zé)o法控制到0. 6 U·mg - 1�����,只能控制到 1. 0 U·mg - 1��,那么可以調(diào)整輔料 B 的限值為 0. 33 U·mg - 1��。此時�����,相當(dāng)于指定 API��、輔料 A����、輔料 B 的 R 值分別為 1 /2��、1 /3�����、1 /6( 表 4) ����。
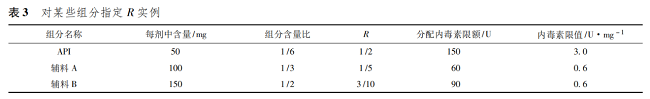
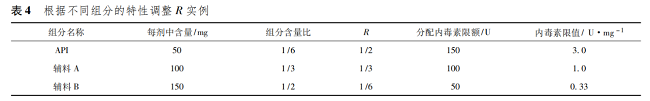
對于一些用量較小或者很難單獨(dú)進(jìn)行細(xì)菌內(nèi)毒素檢測的藥用輔料��,可以考慮將不同輔料按照配方的比例混合后進(jìn)行檢測�����。如表 3 中情況�����,可以將輔料 A 和輔料 B 按 2∶ 3 的比例混合后��,對混合物進(jìn)行檢測�����,限度為 0. 6 U·mg - 1。
實(shí)際生產(chǎn)過程中��,細(xì)菌內(nèi)毒素限額的分配,除了參考不同組分的細(xì)菌內(nèi)毒素限值外����,內(nèi)毒素實(shí)際污染情況也是重要的參考依據(jù)。例如��,某液體制劑中主要成分實(shí)際為注射用水����,其 內(nèi) 毒 素 限 度 為0. 25 U·mL - 1[6],但實(shí)際檢測內(nèi)毒素含量為0. 01 U·mL - 1�����。如每劑產(chǎn)品中注射用水的用量是250 mL��,內(nèi)毒素分配限額除了可以參考按標(biāo)準(zhǔn)限值計(jì)算的125 U外����,也可以參考實(shí)測值 2. 5 U 進(jìn)行��。但此時一定要基于風(fēng)險的原則��,從嚴(yán)考慮�����。考慮到內(nèi)毒素檢測方法本身的誤差范圍��,至少應(yīng)采用實(shí)測值的 2 ~ 4 倍扣除����。由于歷史原因,許多原料藥設(shè)定細(xì)菌內(nèi)毒素限值時�����,并沒有考慮藥用輔料����、包材等的使用情況����,這種情況下,實(shí)際生產(chǎn)時也可以參考原料藥中內(nèi)毒素污染的實(shí)際情況進(jìn)行控制��。
3�����、 藥用輔料標(biāo)準(zhǔn)中細(xì)菌內(nèi)毒素收載格式的思考
3. 1 《美國藥典》藥用輔料標(biāo)準(zhǔn)中細(xì)菌內(nèi)毒素收載格式
《美國藥典》的國家處方集部分 500 余個藥用輔料標(biāo)準(zhǔn)中僅有 17 個收載了細(xì)菌內(nèi)毒素相關(guān)要求��,可見《美國藥典》對于藥用輔料細(xì)菌內(nèi)毒素項(xiàng)目設(shè)定的基本思路為藥用輔料以滿足制劑生產(chǎn)需要為準(zhǔn)�����。具體分為以下幾種情況。
3. 1. 1 5 個品種規(guī)定了檢查項(xiàng)和限值
蔗糖( 用于制備大容量注射液時) 限值為 0. 25 U·mg - 1[7]; 蛋黃卵磷脂限值為 6 U·g - 1[8]; 二甲硅油( 用于注射用物品接觸的涂層) 限值為 10 U·mL - 1[9]; 重組人白蛋白限值為 0. 5 U·mL - 1[10]����。
較為特殊的是山梨醇[11]����,在標(biāo)準(zhǔn)制定時考慮了藥用 輔 料 的 含 量: 當(dāng)注射劑中山梨醇濃度小于100 g·L - 1時��,限值為 46 U·g - 1; 當(dāng)注射劑中山梨醇濃度大于等于 100 g·L - 1時�����,限值為 2. 56 U·g - 1�����。
3. 1. 2 11 個品種列出了檢查項(xiàng)和標(biāo)示項(xiàng)要求
這些品種基本采取了相同的體例,標(biāo)準(zhǔn)正文中進(jìn)行了細(xì)菌內(nèi)毒素要求��,但不確定限值����,而是規(guī)定應(yīng)符合制劑生產(chǎn)的需要�����,同時要結(jié)合標(biāo)示項(xiàng)的描述。如辛酸[12] �����,細(xì)菌內(nèi)毒素: 細(xì)菌內(nèi)毒素含量應(yīng)符合使用辛酸的相關(guān)劑型各論的要求��。如果標(biāo)示中注明在制備注射劑過程中辛酸須經(jīng)過進(jìn)一步處理��,則( 處理后) 細(xì)菌內(nèi)毒素的含量應(yīng)符合各論的要求��。標(biāo)示:當(dāng)辛酸用于注射劑生產(chǎn)時應(yīng)在標(biāo)示中注明。
3. 1. 3 1 個品種僅在標(biāo)示項(xiàng)中提到相關(guān)要求[13]
馬來酸標(biāo)示項(xiàng)中規(guī)定��,當(dāng)馬來酸用于注射劑的生產(chǎn)時�����,應(yīng)在標(biāo)示中注明。在注射劑生產(chǎn)過程中,如馬來酸必須經(jīng)過進(jìn)一步的處理�����,以確保細(xì)菌內(nèi)毒素的可接受水平����,應(yīng)在標(biāo)示中注明����。
3. 1. 4 特殊品種在檢查項(xiàng)中描述供試品處理方法
如二甲硅油和殼聚糖[14-15]����。其中殼聚糖進(jìn)行內(nèi)毒素檢查時供試品處理方式為: 取 0. 5 g 殼聚糖置50 mL 量瓶中,加入細(xì)菌內(nèi)毒素檢查用水和 4. 6 mL1 當(dāng)量濃度鹽酸����,用細(xì)菌內(nèi)毒素檢查用水定容�����,混勻����。在 40 ℃水浴中孵育 48 h 后作為儲備液�����。試驗(yàn)時用細(xì)菌內(nèi)毒素檢查用水稀釋 50 倍后檢查( 包括用 β-葡聚糖阻斷劑稀釋 2 倍) 。
3. 2 《歐洲藥典》藥用輔料標(biāo)準(zhǔn)中細(xì)菌內(nèi)毒素收載格式
《歐洲藥典》在編寫體例指導(dǎo)原則中�����,對于在特定條件下需要進(jìn)行細(xì)菌內(nèi)毒素檢查的品種給出了體例要求����。并且要求可在標(biāo)示項(xiàng)中注明用于注射劑生產(chǎn)����,以 及 細(xì) 菌 內(nèi) 毒 素 限 值��。其基本表達(dá)方式如下[16-17]�����。
細(xì)菌內(nèi)毒素: 如用于注射劑生產(chǎn)����,且沒有進(jìn)一步去除內(nèi)毒素過程的�����,應(yīng)小于 2 U·mg - 1��。例 2����,細(xì)菌內(nèi)毒素: 如果用于注射劑生產(chǎn)�����,且沒有進(jìn)一步去除內(nèi)毒素過程的����,如制劑中本品含量小于 100 g·L - 1時����,應(yīng)小 于 4 U · g - 1; 如制劑中本品含量大于等于100 g·L - 1時,應(yīng)小于 2. 54 U·g - 1�����。
3. 3 《中國藥典》藥用輔料標(biāo)準(zhǔn)中細(xì)菌內(nèi)毒素收載格式的建議
鑒于《中國藥典》中收載的藥用輔料標(biāo)準(zhǔn)是對該藥用輔料質(zhì)量控制的基本標(biāo)準(zhǔn)����,即便某些藥用輔料會用于需控制細(xì)菌內(nèi)毒素的制劑��,直接在《中國藥典》中對其設(shè)定單一固定的細(xì)菌內(nèi)毒素限值并不能充分體現(xiàn)嚴(yán)謹(jǐn)性����。借鑒國外藥典的制定方式���,按照《中國藥典》藥用輔料標(biāo)準(zhǔn)的體例格式要求[18]���,建議藥用輔料標(biāo)準(zhǔn)的細(xì)菌內(nèi)毒素檢查項(xiàng)采用如下原則和方式體現(xiàn)。
3. 3. 1 標(biāo)準(zhǔn)中收載檢查項(xiàng)及限值
對于有安全性控制需要���、在制劑中用法用量比較明確且擬定的限度普遍認(rèn)可的藥用輔料,在《中國藥典》相應(yīng)藥用輔料標(biāo)準(zhǔn)中收載細(xì)菌內(nèi)毒素檢查項(xiàng)及限值( 例 1) ����。某些藥用輔料的細(xì)菌內(nèi)毒素檢查操作較為復(fù)雜或特殊�,可在檢查項(xiàng)中詳述具體方法( 例 2) ����。
例 1: 細(xì)菌內(nèi)毒素( 供注射用)取本品����,依法檢查( 通則 1143) �,每 1 mg 樣品中含內(nèi)毒素的量應(yīng)小于 0. 012 U���。
例 2: 細(xì)菌內(nèi)毒素( 供注射用) 取本品,先加 1%無內(nèi)毒素的碳酸鈉溶液將供試品溶解并稀釋制成每1 mL 中含 80 mg 的溶液���,再用內(nèi)毒素檢查用水稀釋至所需濃度���,依法檢查( 通則1143) ����,每1 mg 樣品中含內(nèi)毒素的量應(yīng)小于 0. 10 U。
3. 3. 2 標(biāo)準(zhǔn)中收載檢查項(xiàng)不統(tǒng)一規(guī)定限值
對于明確需要進(jìn)行細(xì)菌內(nèi)毒素控制���,但限值不宜統(tǒng)一要求的藥用輔料�,在《中國藥典》相應(yīng)藥用輔料標(biāo)準(zhǔn)中將細(xì)菌內(nèi)毒素作為檢查項(xiàng)收載���,在標(biāo)示項(xiàng)以 U 為單位標(biāo)明每 1 mL( mg 等) 本品中含細(xì)菌內(nèi)毒素的限值或含量( 例 3) �。某些藥用輔料的細(xì)菌內(nèi)毒素檢查操作較為復(fù)雜或特殊�,可在檢查項(xiàng)中詳述具體方法( 例 4) �。藥品生產(chǎn)企業(yè)按照制劑生產(chǎn)需求制定內(nèi)控標(biāo)準(zhǔn)。
例 3: 細(xì)菌內(nèi)毒素( 供注射用)取本品����,依法檢查( 通則 1143) ����,每 1 mg 樣品中含內(nèi)毒素的量應(yīng)小于標(biāo)示值。
[標(biāo)示]應(yīng)標(biāo)明每 1 mg 樣品中含內(nèi)毒素的量應(yīng)小于的標(biāo)示值或每 1 mg 樣品中含內(nèi)毒素的量����。
例 4: 細(xì)菌內(nèi)毒素( 供注射用) 取本品���,先加 1%無內(nèi)毒素的碳酸鈉溶液將供試品溶解并稀釋制成每1 mL 中含 80 mg 的溶液�,再用內(nèi)毒素檢查用水稀釋至所需濃度,依法檢查( 通則 1143) �,每 1 mg 樣品中含內(nèi)毒素的量應(yīng)小于標(biāo)示值。
[標(biāo)示]應(yīng)標(biāo)明每 1 mg 樣品中含內(nèi)毒素的量應(yīng)小于的標(biāo)示值或每 1 mg 樣品中含內(nèi)毒素的量����。
《中國藥典》通則 0251 藥用輔料中規(guī)定“標(biāo)示項(xiàng)下規(guī)定應(yīng)標(biāo)明的內(nèi)容應(yīng)在產(chǎn)品標(biāo)簽����、包裝����、質(zhì)量標(biāo)準(zhǔn)或檢驗(yàn)報(bào)告書( 其中至少一個) 中標(biāo)明”,以便藥用輔料的生產(chǎn)環(huán)節(jié)和使用環(huán)節(jié)( 藥品生產(chǎn)企業(yè)) 可以進(jìn)行約定與查驗(yàn)����,第三方( 如監(jiān)管部門) 也可以進(jìn)行必要的抽查檢驗(yàn)。
4����、 結(jié)語
隨著原輔包與制劑關(guān)聯(lián)審評審批政策在我國的實(shí)施���,如何科學(xué)合理地制定原料藥�、藥用輔料、包材等質(zhì)量標(biāo)準(zhǔn)���,還存在一些亟需解決的問題[19-22]����。國家藥典委也在積極推動標(biāo)準(zhǔn)研究適應(yīng)關(guān)聯(lián)審評等新要求���,致力于建立既符合藥品質(zhì)量控制的基本要求�,又能切實(shí)有效指導(dǎo)生產(chǎn)實(shí)際的標(biāo)準(zhǔn)研究規(guī)則和體系�。
本研究從藥用輔料細(xì)菌內(nèi)毒素控制的角度進(jìn)行了探討�,采用了以滿足制劑需求為核心的輔料質(zhì)量控制理念,這也是被歐美等先進(jìn)國家所接受的�。但標(biāo)準(zhǔn)變化在一定時間內(nèi)也會給行業(yè)帶來一定的挑戰(zhàn)�,如輔料生產(chǎn)企業(yè)如何能生產(chǎn)出滿足不同制劑生產(chǎn)需求的輔料產(chǎn)品,藥品監(jiān)管部門如何加強(qiáng)輔料生產(chǎn)的監(jiān)督管理等���。這有待于監(jiān)管部門與相關(guān)企業(yè)等共同努力,推動原料藥���、藥用輔料和藥品標(biāo)準(zhǔn)的研究更加規(guī)范�、有效����,促進(jìn)藥品生產(chǎn)企業(yè)落實(shí)主體責(zé)任,確保人民群眾用藥安全����。致謝: 高華研究員、唐黎明主任藥師����、袁耀佐主任藥師等專家指導(dǎo)和幫助; IPEC 中國�、北京藥檢院�、天津藥檢院、湖州展望藥業(yè)�、齊魯制藥等單位提供建議����。