【摘要】基于各省市第二類創(chuàng)新醫(yī)療器械的審批公示現(xiàn)狀���,尤其在分析上海市第二類創(chuàng)新醫(yī)療器械審查中發(fā)現(xiàn)的問題及影響創(chuàng)新醫(yī)療器械上市進程的因素后�,該研究通過建立健全制度規(guī)章�����,轉變審評審批思路���,將服務延伸至創(chuàng)新醫(yī)療器械產(chǎn)品研發(fā)及臨床試驗方案制定等環(huán)節(jié)��,提出監(jiān)管的幾點思考供參考�����。
引言
醫(yī)療器械作為國家現(xiàn)代化醫(yī)療衛(wèi)生體系建設中的基礎裝備����,直接關系到人民群眾的生命安全和健康福祉。在過去的幾十年里�,我國逐漸躋身為醫(yī)療器械進口、制造��、出口大國�����。中國醫(yī)療衛(wèi)生事業(yè)和龐大人口的醫(yī)療保健服務�,不可能完全依賴進口產(chǎn)品,尤其在重大公共衛(wèi)生危機狀態(tài)下�,醫(yī)療器械具有顯著的“卡脖子”效應,高端進口醫(yī)療器械市場長期被跨國公司壟斷��,國產(chǎn)醫(yī)療器械競爭力薄弱,人民群眾醫(yī)療費用居高不下的問題仍待解決��。為了擺脫這種狀況��,近年我國愈發(fā)重視醫(yī)療器械行業(yè)創(chuàng)新[1]�。特別在高端醫(yī)療器械領域提出了國產(chǎn)替代,并發(fā)布了創(chuàng)新醫(yī)療器械審批程序[2]�����,醫(yī)療器械的自主創(chuàng)新及相關產(chǎn)品的國產(chǎn)化����,國民健康保障具有極其重要的意義����。
1、第二類創(chuàng)新醫(yī)療器械審批現(xiàn)狀
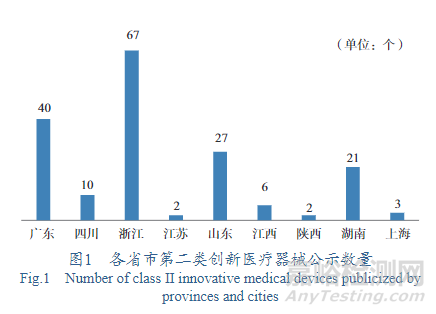
2015年后��,廣東�����、浙江���、山東�、江蘇、四川��、江西��、陜西���、湖南����、河南等地分別出臺了第二類創(chuàng)新醫(yī)療器械特別審批程序��,截至目前�����,各省市擬進入第二類創(chuàng)新醫(yī)療器械公示數(shù)量如圖1所示(數(shù)據(jù)來源于各省市局網(wǎng)站公示)��。
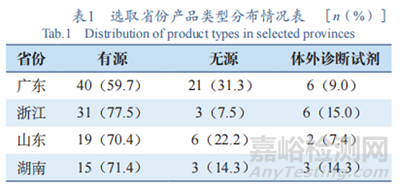
選取廣東��、浙江�����、山東、湖南為例對進入創(chuàng)新醫(yī)療器械公示產(chǎn)品進行類型分布分析����,由表1可以看出,有源醫(yī)療器械在第二類創(chuàng)新醫(yī)療器械中的占比遠高于無源醫(yī)療器械和體外診斷試劑�。通過對上海第二類創(chuàng)新醫(yī)療器械的申報情況梳理,有源醫(yī)療器械(包括醫(yī)用軟件)在第二類創(chuàng)新醫(yī)療器械申報產(chǎn)品中占比為54.2%�����,與其他省市情況類似�,占比較高。有源醫(yī)療器械申報量的大幅上漲����,主要是數(shù)字化轉型帶來的改變。隨著大數(shù)據(jù)����、人工智能及穿戴式設備的發(fā)展��,未來該類產(chǎn)品的創(chuàng)新比例可能會進一步上升��。
2020年2月��,上海市藥品監(jiān)督管理局對外發(fā)布了《上海市第二類創(chuàng)新醫(yī)療器械特別審查程序》[3],為第二類創(chuàng)新醫(yī)療器械開辟了專用通道��,企業(yè)創(chuàng)新積極性高漲�����,產(chǎn)業(yè)迅速發(fā)展����。目前第二類創(chuàng)新醫(yī)療器械的來源主要有臨床實踐創(chuàng)新、新技術在醫(yī)療器械上的應用及已有醫(yī)療器械迭代新技術后的換代產(chǎn)品等3個方面����。
自2020年2月至今,共計收到第二類創(chuàng)新醫(yī)療器械審批申請24件�,其中有源醫(yī)療器械13件,占比54.2%�;無源醫(yī)療器械10件,占比41.6%�;體外診斷試劑1件,占比4.2%����。24件中符合形式審查要求予以受理15件,不予受理9件�����,主要原因是申報資料不齊全和申報產(chǎn)品管理類別存疑。
受理的第二類創(chuàng)新醫(yī)療器械���,目前僅有3件(2件有源醫(yī)療器械��,1件無源醫(yī)療器械)第二類創(chuàng)新醫(yī)療器械產(chǎn)品獲批進入創(chuàng)新醫(yī)療器械通道��。通過分析本市的第二類創(chuàng)新醫(yī)療器械審查情況����,發(fā)現(xiàn)通過率比較低的原因主要有以下幾點:
(1)產(chǎn)品主要的作用原理/作用機理經(jīng)審查后屬于非國內首創(chuàng)產(chǎn)品����。
(2)產(chǎn)品的性能或安全性有改進,但無根本改進���,不能判斷技術上是否處于國際領先水平�。
(3)申報產(chǎn)品提交的發(fā)明專利不是產(chǎn)品的核心技術或提交的核心發(fā)明專利與申報產(chǎn)品無明顯關聯(lián)性�����。
(4)申報創(chuàng)新醫(yī)療器械與已在臨床應用的同類產(chǎn)品相比��,或者與臨床的“金標準”相比����,無顯著的臨床應價值,或通過引進國外成熟產(chǎn)品進行升級���,但未提交升級后相關臨床前研究和臨床試驗資料����,缺乏證明申報產(chǎn)品具有顯著臨床應用價值的證據(jù)��。
綜上�,不予通過創(chuàng)新醫(yī)療器械審批一方面是因為注冊申請人申報產(chǎn)品本身不符合該程序規(guī)定的相關要求;另一方面是因為注冊申請人提交的申報材料不足以證明其滿足該程序的要求�。
2、創(chuàng)新研究成果轉化為醫(yī)療器械上市的難點
大量現(xiàn)代科學技術前沿成果的匯集�����,使醫(yī)療器械創(chuàng)新產(chǎn)品不斷涌現(xiàn)�,但創(chuàng)新研究成果在轉化為產(chǎn)品時仍遇到不少難點,一定程度上導致創(chuàng)新醫(yī)療器械上市進程緩慢���。
2.1產(chǎn)品技術要求制定環(huán)節(jié)面臨的難點
對于創(chuàng)新醫(yī)療器械��,由于沒有公認的評價思路和方法可參考��,也沒有相應的國家標準或行業(yè)標準�,注冊申請人需通過研發(fā)設計確定產(chǎn)品的性能指標,導致制訂產(chǎn)品技術要求��、性能指標和確定檢驗方法周期過長����,如在設計開發(fā)時未考慮部分安全風險點,審評環(huán)節(jié)可能面臨補充檢測���,會進一步導致上市進程緩慢�。
2.2臨床評價環(huán)節(jié)面臨的難點
對于創(chuàng)新醫(yī)療器械�,由于其在結構與工作原理、材料構成與特性�、軟件算法等方面與已獲批上市醫(yī)療器械存在明顯差異,有些創(chuàng)新醫(yī)療器械甚至開創(chuàng)了某一領域的全新治療方向����,按照《醫(yī)療器械臨床評價技術指導原則》的規(guī)定,只能通過臨床試驗路徑進行臨床評價����,導致成本上升、產(chǎn)品上市進程延長��。
2.3質量管理體系面臨的難點
醫(yī)療器械注冊質量管理體系�,決定了產(chǎn)品是否能夠注冊上市,也承擔著保證上市產(chǎn)品真實安全和穩(wěn)定可靠�。創(chuàng)新醫(yī)療器械的注冊申請人一般為初創(chuàng)企業(yè)、醫(yī)療機構�����、科研機構����,重視樣品實物,忽略質量管理體系的建立���,缺少專業(yè)的質量體系管理人員����,導致不能提供樣品在質量管理體系下運行的相關記錄�����,可能會在注冊核查時無法提供注冊檢驗用樣品的生產(chǎn)記錄和檢驗記錄��,導致無法得出申請產(chǎn)品樣品的真實性結論。
3�、第二類創(chuàng)新醫(yī)療器械監(jiān)管的幾點思考
依據(jù)本市以往第二類創(chuàng)新醫(yī)療器械的審批經(jīng)驗,針對創(chuàng)新醫(yī)療器械審批建議可通過建立健全制度規(guī)章��,轉變審評審批思路����,將服務延伸至創(chuàng)新醫(yī)療器械產(chǎn)品研發(fā)及臨床試驗方案制訂等環(huán)節(jié)[4],進一步推進創(chuàng)新醫(yī)療器械上市進程����,促進科研成果的快速轉化。
(1)提前布局��,提高能力�。提高創(chuàng)新醫(yī)療器械提前服務能力,通過預測未來幾年具有戰(zhàn)略性���、前瞻性的醫(yī)療器械關鍵技術點����,設立科研項目�;同時引導和鼓勵有條件的科研院所、高等院校和臨床醫(yī)院的專家,積極與創(chuàng)新企業(yè)開展合作�,共同探索產(chǎn)品的技術要求和檢測方法制訂,以期提高申報資料的質量�����。
(2)強化綠色通道����,落實提前介入服務�,加大技術審評與注冊核查的同步機制。對進入創(chuàng)新審批程序的醫(yī)療器械指定專人負責對接��,開展提前介入服務����,如對注冊申報資料開展審查,同時積極開展上門調研�����、法規(guī)宣貫��、辦理流程介紹����、生產(chǎn)質量管理體系指導�、企業(yè)問題咨詢解答等服務�����,助力企業(yè)更好地了解法規(guī)�、流程,提前做好準備��,少走彎路�,縮減審評核查耗時。
(3)拓展咨詢服務渠道�����,優(yōu)化現(xiàn)場咨詢機制����。以臨床需求為導向,對醫(yī)療機構為主導研發(fā)的創(chuàng)新醫(yī)療器械���,積極參與產(chǎn)品技術要求的制訂研究工作中的答疑解惑����,深入醫(yī)療機構探討醫(yī)療器械創(chuàng)新產(chǎn)品的研發(fā)和驗證工作,切實幫助臨床機構解決研發(fā)中遇到的困難和問題��。主動聯(lián)系各創(chuàng)新醫(yī)療器械服務站和相關園區(qū)��,提前了解擬申報創(chuàng)新醫(yī)療器械企業(yè)的各種需求����,對企業(yè)開展相關業(yè)務指導,側面提高申報資料的質量�。
(4)加強創(chuàng)新醫(yī)療器械事中事后監(jiān)管制度銜接��。依據(jù)創(chuàng)新醫(yī)療器械的特點��,探索定期提交創(chuàng)新醫(yī)療器械客戶投訴記錄�����、年度不良事件報告�����、臨床使用情況報告及召回情況報告��;監(jiān)管部門適時以數(shù)據(jù)庫的方式公布創(chuàng)新醫(yī)療器械使用的相關信息��。由于創(chuàng)新醫(yī)療器械在使用上也具有獨特性和創(chuàng)新性,為了做好使用環(huán)節(jié)的監(jiān)管���,建議制定創(chuàng)新醫(yī)療器械使用質量監(jiān)督管理辦法�����,規(guī)范創(chuàng)新醫(yī)療器械的使用�����。
監(jiān)管部門可通過不定期走訪企業(yè)��,了解企業(yè)存在的問題及困惑����,定期總結��,適時調整監(jiān)管政策�����。隨著醫(yī)療器械監(jiān)管政策的不斷完善����,創(chuàng)新醫(yī)藥器械未來的方向將會以高端醫(yī)療設備國產(chǎn)化�、高端醫(yī)療設備的短板為重心�,突破技術裝備瓶頸,實現(xiàn)高端醫(yī)療器械的自主可控����,也為人民群眾的生命安全和健康造福。
參考文獻
[1]王蘭明,趙陽.深化醫(yī)療器械審評審批制度改革,促進醫(yī)療器械產(chǎn)業(yè)高質量發(fā)展——中國醫(yī)療器械審評審批制度改革概述[J].中國食品藥品監(jiān)管,2021,204(1):16-27.
[2]國家藥品監(jiān)督管理局.國家藥監(jiān)局關于發(fā)布創(chuàng)新醫(yī)療器械特別審查程序的公告(2018年第83號)[EB/OL].(2018-11-02)[2022-03-02].https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20181105160001106.html.
[3]上海市藥品監(jiān)督管理局.上海市藥品監(jiān)督管理局關于印發(fā)《上海市第二類創(chuàng)新醫(yī)療器械特別審查程序》的通知[EB/OL].(2020-01-22)[2022-03-02].https://yjj.sh.gov.cn/zx-ylqx/20200204/66fb53483b6342718afb9bfcbe56600a.html.
[4]塔娜,王涵,李耀華.中美對創(chuàng)新和臨床急需醫(yī)療器械的審評審批途徑簡介與思考[J].中國藥事,2019,33(4):470-474.