摘 要 Abstract
目的:基準評估作為一種提升監(jiān)管能力的手段����,已經(jīng)被監(jiān)管機構(gòu)廣泛運用于推進藥品監(jiān)管能力建設(shè)����。本研究旨在基于國際監(jiān)管能力基準評估方法和工具,系統(tǒng)性地梳理推進藥品監(jiān)管能力的評估指標和分析相關(guān)的國際應(yīng)用經(jīng)驗����。方法:將發(fā)布了具體的監(jiān)管能力基準評估方法或工具的世界衛(wèi)生組織、歐洲藥品監(jiān)管機構(gòu)負責(zé)人組織����、經(jīng)濟合作與發(fā)展組織、國際監(jiān)管科學(xué)創(chuàng)新研究中心����、美國政府問責(zé)辦公室納入研究,分析上述組織/ 機構(gòu)官網(wǎng)報告和相關(guān)文獻����,采集、剖析相關(guān)數(shù)據(jù)����。結(jié)果與結(jié)論:本研究綜合對比、分析了現(xiàn)有的基準評估指標體系���,建立了全面評估框架及指標�,為藥品監(jiān)管機構(gòu)建立基準評估工具提供重要的參考依據(jù)����。藥品監(jiān)管能力基準評估工具通過多元化指標體系�,整體評估國家監(jiān)管體系�、利益攸關(guān)方參與、監(jiān)管效果評估和事后行為����,同時從藥品全生命周期中各運營層面細化評估注冊及上市批準、上市后監(jiān)測���、藥物警戒����、許可申請及發(fā)放�、監(jiān)管稽查、實驗室規(guī)范�、臨床試驗監(jiān)管和批簽發(fā)。從應(yīng)用層面看���,不同發(fā)展階段的國家監(jiān)管機構(gòu)已分別運用不同的基準評估工具進行內(nèi)部基準評估����、外部基準評估����、職能基準評估或流程基準評估識別監(jiān)管績效���,從而提升監(jiān)管實踐���?��;诨鶞试u估結(jié)果,有針對性地配置資源進行持續(xù)的質(zhì)量改進�,對推進監(jiān)管能力建設(shè)至關(guān)重要。
Objectives: As a means to enhance regulatory capacity, benchmarking has been widely used by drug regulatory agencies (DRAs) to promote regulatory capacity building. This study is aimed at systematically analyzing the regulatory capacity benchmarking indicators and exploring international benchmarking experiences in advancing drug regulatory capacity. Methods: The relevant initiatives from the World Health Organization (WHO), Heads of Medicines Agencies (HMA), Organization for Economic Cooperation and Development (OECD), Center for Innovation in Regulatory Science (CIRS) and U.S. Government Accountability Office (U.S. GAO) were thoroughly studied to analyze the specific regulatory capacity benchmarking programs or tools, together with a literature review to collect and analyze the latest data on the utilization of benchmarking by DRAs. Results and Conclusion: This study comprehensively compared and analyzed the existing benchmarking indicators system and a systematic assessment framework was proposed to provide a reference basis for DRAs to develop their own benchmarking tools. The comprehensive collection of benchmarking indicators of the drug regulatory capacity is mainly used to assess the national drug regulatory system, stakeholder engagement, regulatory impact assessment, and ex-post evaluations at a system level covering major functionalities throughout a drug life cycle such as drug administration and marketing authorization, post-market surveillance and control, pharmacovigilance, license application approval, regulatory inspections, laboratory practices, supervision of clinical trials, and lot release at the operational level. Furthermore, different DRAs have used different benchmarking tools for internal, external, functional or process benchmarking to identify the performance of their regulatory practices. For DRAs to achieve the goal of benchmarking, continuous assessment to identify areas of improvement to inform targeted resource allocation and actions is critical to advancing regulatory capacity building.
1����、 背景
近年來,我國藥品監(jiān)管改革持續(xù)推進����,堅持改革創(chuàng)新和科學(xué)發(fā)展,推動出臺及修訂多部藥品監(jiān)管法規(guī)���?��!吨腥A人民共和國國民經(jīng)濟和社會發(fā)展第十四個五年規(guī)劃和2035 年遠景目標綱要》[1]和《“十四五”國家藥品安全及促進高質(zhì)量發(fā)展規(guī)劃》[2] 均明確提及促進藥品高質(zhì)量發(fā)展����,推進藥品監(jiān)管體系和監(jiān)管能力現(xiàn)代化����,表明黨中央、國務(wù)院高度重視藥品監(jiān)管工作和監(jiān)管能力建設(shè)�。2021 年2 月,習(xí)近平總書記主持召開中央全面深化改革委員會第十八次會議����,會議審議通過了《關(guān)于全面加強藥品監(jiān)管能力建設(shè)的實施意見》(以下簡稱《實施意見》)[3]?��!秾嵤┮庖姟肥鞘讉€專門針對藥品監(jiān)管能力建設(shè)的文件���,強調(diào)了6 個方面工作和18 項重點任務(wù),旨在破解藥品監(jiān)管體系和監(jiān)管能力存在的瓶頸制約問題�,促進藥品監(jiān)管事業(yè)對標國際通行規(guī)則,進一步提升藥品監(jiān)管工作科學(xué)化�、法治化、國際化�、現(xiàn)代化水平。
自《實施意見》發(fā)布以來���,我國藥品監(jiān)管部門持續(xù)加強藥品監(jiān)管體系和監(jiān)管能力建設(shè)�,但與發(fā)達國家相比,我國藥品監(jiān)管水平和醫(yī)藥產(chǎn)業(yè)發(fā)展仍存在差距�。基準評估(benchmarking) 是持續(xù)提升監(jiān)管能力的一種有效方法����,已廣泛應(yīng)用于藥品監(jiān)管機構(gòu)的能力建設(shè)與評估中�。隨著全球藥品監(jiān)管趨同的快速發(fā)展,基準評估及相關(guān)工具已被國際上多個監(jiān)管機構(gòu)采用����,對各國藥品監(jiān)管措施進行評估和優(yōu)化。因此����,本研究基于國際監(jiān)管能力基準評估方法或工具,系統(tǒng)性地梳理推進藥品監(jiān)管能力的相關(guān)衡量指標�,比較、分析相關(guān)的國際應(yīng)用經(jīng)驗�,以進一步提升我國藥品監(jiān)管能力建設(shè)現(xiàn)代化、國際化�,持續(xù)推進藥品監(jiān)管創(chuàng)新。
2���、監(jiān)管能力基準評估
國家藥品監(jiān)管機構(gòu)在醫(yī)藥體系中發(fā)揮著不可或缺的作用����,旨在確保公平,獲得質(zhì)量���、安全性����、有效性和成本效益有保證的醫(yī)藥產(chǎn)品或醫(yī)療技術(shù)�,保障科學(xué)合理并具有成本效益的使用[4]。運用基準評估����,能夠使相關(guān)組織/ 機構(gòu)通過衡量和比較關(guān)鍵規(guī)范指標,了解在管理流程中需要改變什么�、如何改變以及從哪些方面著手改進以提高績效。
2.1 基準評估的起源和目的
基準評估的概念來源于企業(yè)管理行為中的“標桿管理”(又稱“基準管理”)����。事實上,“標桿管理”是一種通過不斷將組織流程與公認標桿企業(yè)比較���,利用標桿企業(yè)的最佳實踐來改善自己公司績效的方法[5-6]�。1979 年,美國施樂公司最先提出了“標桿管理”的概念���,即“參照行業(yè)內(nèi)最強的競爭對手或行業(yè)領(lǐng)導(dǎo)者�,不斷地測試產(chǎn)品���、服務(wù)和實踐”[7]。從1983 年開始�,該方法被廣泛應(yīng)用在多個方面,如工程制造質(zhì)量改進����、員工培訓(xùn)效率提升�、計算機性能評估等方面,甚至在亞洲進行企業(yè)績效比較[8-11]����。在“標桿管理”概念的基礎(chǔ)和實踐運用上,給予“基準評估”更具有操作性的定義——“認定和實施最佳實踐”�,即通過學(xué)習(xí)其他機構(gòu)的“最佳實踐”來改進實踐、服務(wù)或產(chǎn)品[12]�。
自1987 年以來,基準評估一直是馬爾科姆· 波多里奇國家質(zhì)量獎(Malcolm Baldrige National Quality Award) 標準的主要組成部分����,在總共1000個馬爾科姆·波多里奇國家質(zhì)量獎評價要素中�,“標桿管理”的概念一直影響著500 多個核心要素[13]���。此外���,在對管理工具和趨勢多年的調(diào)查中,基準評估一直保持在前十位���,在最受關(guān)注的20個管理工具中排名第四[14]���。除此之外,基準評估在六西格瑪過程�、準時制系統(tǒng)、ISO9000 認證和供應(yīng)鏈管理中得到了廣泛應(yīng)用[15-18]�。過去40 余年,基準評估已經(jīng)應(yīng)用于企業(yè)�、政府、醫(yī)院和教育等各個領(lǐng)域[7]���。
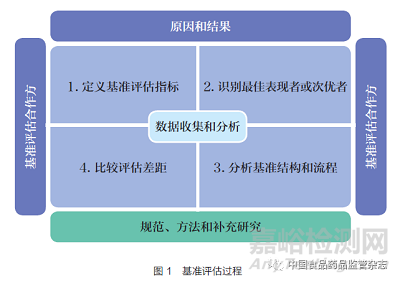
基準評估的目的是建立更可靠的目標和追求持續(xù)的改進�,尤其是發(fā)現(xiàn)和理解實現(xiàn)新目標所需方法的過程,如圖1 所示[19]����。基準評估是全面質(zhì)量管理和持續(xù)質(zhì)量改進的基礎(chǔ)之一����,在外部導(dǎo)向的基礎(chǔ)上,基準評估建立了相應(yīng)的目標和方向�,即評價內(nèi)部過去做法和預(yù)測未來趨勢。由于外部環(huán)境的變化速度遠遠快于預(yù)期���,既定的目標往往會失敗或難以達成�。因此����,基準評估強調(diào)應(yīng)持續(xù)關(guān)注外部環(huán)境���,以更好地滿足不斷變化的需求���。總體來看����,基準評估非常有助于一個組織進行行為改變���,且可以衡量這些改變的有益影響,因而被廣泛用作解決問題�、改進質(zhì)量和優(yōu)化團隊管理等場景。
2.2 藥品監(jiān)管能力基準評估
基準評估被越來越多的國家藥品監(jiān)管機構(gòu)所采用���,以強化藥品監(jiān)管和實現(xiàn)全民健康[20]�。借鑒基準評估方法和公共部門基準評估的經(jīng)驗[21-23]�,藥品監(jiān)管能力基準評估的做法很復(fù)雜。藥品監(jiān)管機構(gòu)無論是作為降低與藥品相關(guān)的公共風(fēng)險的守護者����,還是促進藥品創(chuàng)新和發(fā)展的推動者,監(jiān)管者為了取得有意義的基準評估結(jié)果���,必須對藥品監(jiān)管機構(gòu)的目標終點做出切實可行的決策���。
基準評估在藥品監(jiān)管領(lǐng)域中的應(yīng)用主要分為兩種途徑:一種是從應(yīng)用于評估藥品監(jiān)管的某一個環(huán)節(jié)或某一個技術(shù)要點開始,以達到全行業(yè)統(tǒng)一的監(jiān)管要求和技術(shù)標準���;另一種是應(yīng)用于整體藥品監(jiān)管框架的評估�,以提升監(jiān)管部門整體監(jiān)管質(zhì)量,進而實現(xiàn)全球監(jiān)管趨同���。創(chuàng)新和技術(shù)進步以及重大公共衛(wèi)生事件等因素帶來了諸多挑戰(zhàn)���,進一步提高了對監(jiān)管實踐的要求。通過將績效能力與衡量指標進行比較����,國家監(jiān)管機構(gòu)可以確定監(jiān)管行動的績效、弱點和優(yōu)勢����,以及如何確定行動的優(yōu)先順序,以根據(jù)當?shù)貙嶋H情況不斷提高藥品的高質(zhì)量使用[24]���。
3�、藥品監(jiān)管能力基準評估工具及其評估指標
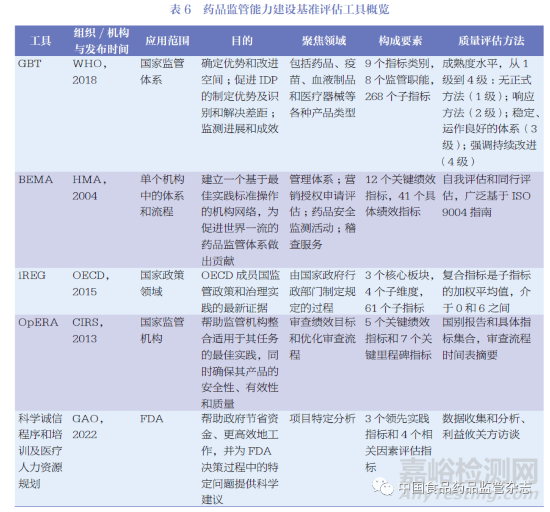
世界衛(wèi)生組織(World Health Organization����,WHO)���、歐洲藥品監(jiān)管機構(gòu)負責(zé)人組織( Heads of Medicines Agencies���,HMA)�、經(jīng)濟合作與發(fā)展組織(Organisation for Economic Cooperation and Development����,OECD)、國際監(jiān)管科學(xué)創(chuàng)新研究中心(Center for Innovation in Regulatory Science����,CIRS) 和美國政府問責(zé)辦公室(Government Accountability Office, GAO)均正式發(fā)布了全面或?qū)m椀谋O(jiān)管能力衡量工具����。本研究將上述組織/ 機構(gòu)納入涵蓋范圍,并對相關(guān)政府文件和文獻進行系統(tǒng)性的分析和審查�,以獲取相關(guān)基準評估工具、衡量指標和評估方法���。監(jiān)管能力衡量工具均從對應(yīng)管理機構(gòu)的官方網(wǎng)站上找到公開信息:WHO( https://www.who.int/)�,OECD (https: //www.oecd.org/)���,HMA(https://www.hma.eu/)����,CIRS(https://www.cirsci.org/),GAO (https://www.gao.gov/)���。
3.1 WHO 發(fā)布的全球基準評估工具
WHO 從1997 年開始關(guān)注醫(yī)藥產(chǎn)品監(jiān)管體系的評估�,采用了一套評估疫苗監(jiān)管計劃的指標對監(jiān)管體系進行審查���。隨后�,對監(jiān)管體系的評價指標系統(tǒng)不斷地演進和優(yōu)化����,并引入了多種工具,在150 多個國家或地區(qū)的監(jiān)管體系進行了基準評估和應(yīng)用���。按照世界衛(wèi)生大會67.20 號決議(WHA67.20)的要求����,WHO 出臺了一系列加強監(jiān)管體系結(jié)構(gòu)化的循證方法����,為醫(yī)藥產(chǎn)品監(jiān)管體系的基準化、制定監(jiān)管機構(gòu)發(fā)展計劃的決策或規(guī)劃提供了明確的指南���。
2013 年����,WHO 開始制定統(tǒng)一的全球基準評估工具(Global Benchmarking Tool����,GBT),旨在評估國家整體監(jiān)管體系和相關(guān)組成部門的監(jiān)管職能����,以確定監(jiān)管體系的成熟度。2015 年1 月與12 月����,WHO 召開兩次國際會議,共同磋商GBT 制定的方法與基本原則����。經(jīng)過多次修訂與完善,GBT 已覆蓋了藥品���、疫苗����、血液制品和醫(yī)療器械的基準評估����。如今���,GBT 已成為WHO 評估醫(yī)藥產(chǎn)品監(jiān)管體系的重要工具,可以實現(xiàn)對國家���、省���、州或聯(lián)邦層級的監(jiān)管機構(gòu)進行評估。
GBT 有效幫助監(jiān)管機構(gòu)確定優(yōu)勢領(lǐng)域和需要改進的領(lǐng)域����, 并利用已有優(yōu)勢制定適宜的機構(gòu)發(fā)展計劃(Institutional Development Plan,IDP)����,同時明確IDP 的資源規(guī)劃、投資順序�, 并監(jiān)控IDP 實施進度。GBT 中評估指標主要分為4 個層次���,即國家監(jiān)管體系和監(jiān)管職能板塊���、相關(guān)指標���、子指標、概況介紹�。
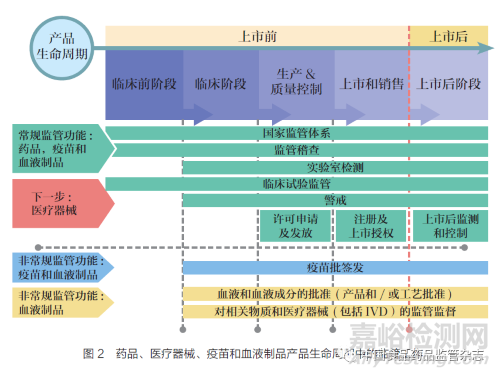
除國家監(jiān)管體系(National Regulatory System�,RS)板塊外,GBT 還包括以下監(jiān)管職能板塊:注冊和上市許可(Registration and Marketing Authorization���,MA)�、藥物警戒(Vigilance���,VL)���、市場監(jiān)管(Market Surveillance and Control,MC)�、機構(gòu)許可(Licensing Establishments,LI)�、監(jiān)督檢查(Regulatory Inspection,RI)���、實驗室檢測(Laboratory Testing����,LT)、臨床試驗監(jiān)管(Clinical Trials Oversight���,CT)�、批簽發(fā)(NRA Lot Release����,LR)。這些板塊涵蓋了藥品全生命周期管理�, 如圖2 所示。此外�,GBT的評價指標主要有九大類別,其涵蓋內(nèi)容如表1 所示�。根據(jù)GBT 的評價要求, 且對應(yīng)于ISO 9004:2018����,按成熟度(maturity level,ML) 將國家監(jiān)管體系劃分為4 個等級����, 分別是:ML1 僅存在某些監(jiān)管要素的國家監(jiān)管體系;ML2 部分實現(xiàn)基本監(jiān)管職能的國家監(jiān)管體系����;ML3 穩(wěn)定�、運作良好����、完整的國家監(jiān)管體系;ML4 以先進水平運行和持續(xù)改進的國家監(jiān)管體系���。
3.2 HMA 建立的基準評估程序
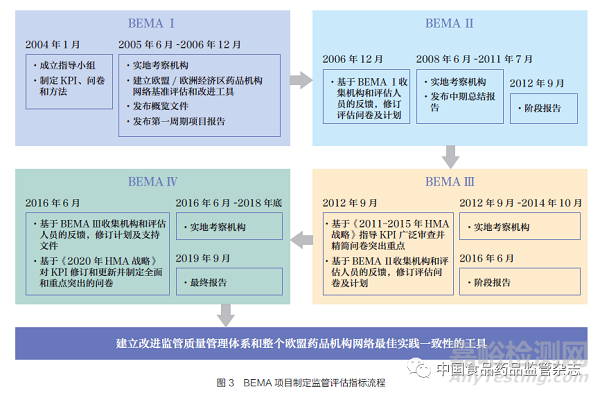
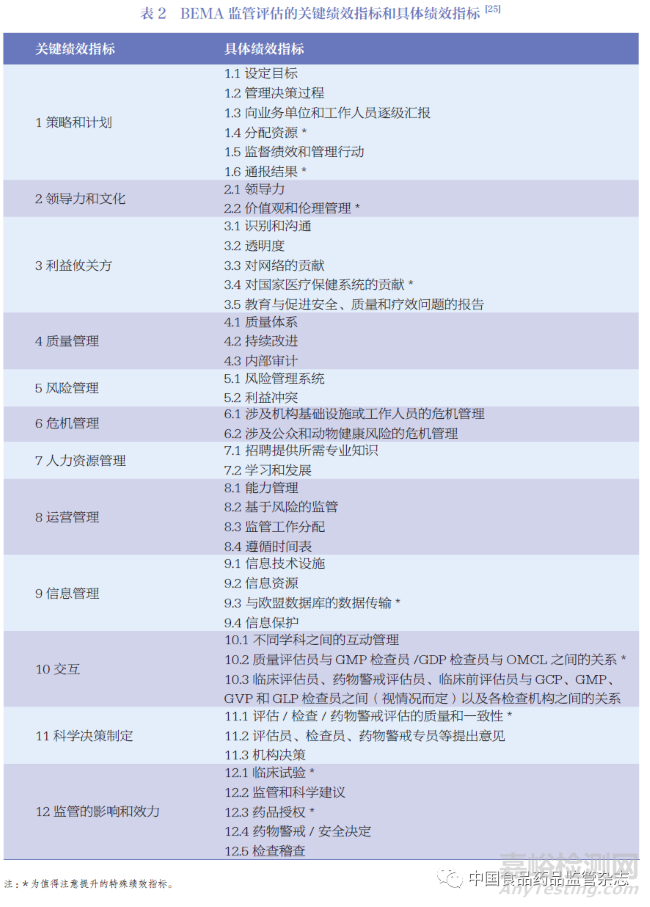
HMA 在人用和獸用藥物機構(gòu)建立了一個基準評估程序,即歐洲藥品管理局基準評估(Benchmarking of European Medicines Agency����,BEMA)。BEMA 目標旨在推動按照最佳實踐標準運作的全球藥品監(jiān)管體系的發(fā)展做出貢獻����。BEMA 基于各個監(jiān)管機構(gòu)的體系和流程的評估,已在監(jiān)管體系���、上市許可申請評估���、藥物警戒和檢查稽查領(lǐng)域達成一致,并形成一組成熟的指標����。BEMA 制定監(jiān)管評估指標擁有一套嚴格的流程����,以保證指標的科學(xué)性和有效性如圖3 所示���。在最終報告中�,BEMA 報告了其關(guān)鍵績效指標(key performance indicator����,KPI)和值得提升的特殊績效指標,如表2 所示����。
BEMA 評估監(jiān)管的方法包括自我評估和同行評審評估,并廣泛基于ISO 9004 指南�。自我評估使機構(gòu)能夠評估自身在績效指標所針對的領(lǐng)域方面的優(yōu)勢和劣勢。同行評審評估允許受過專門培訓(xùn)的評估團隊訪問每個機構(gòu)(如從其他機構(gòu)的志愿者中抽取相關(guān)評估人員)����,以根據(jù)績效指標進行獨立評估。評估小組將征得被訪問機構(gòu)同意���,把每次訪問結(jié)果制作成匿名報告����。所有結(jié)果均存儲于中央數(shù)據(jù)庫,并匯總成一份報告供各機構(gòu)使用�,確定最佳實踐。
BEMA 是在整個歐洲范圍內(nèi)分享監(jiān)管機構(gòu)評價工作中的最佳實踐工具���,幫助能力欠佳的藥品監(jiān)管機構(gòu)找到最為適用的方式來優(yōu)化其監(jiān)管職能���。在歐盟,應(yīng)用該工具的主要目標是創(chuàng)造一個高質(zhì)量的監(jiān)管環(huán)境����,使歐盟成員國的監(jiān)管機構(gòu)都能接受和認可其他成員國的監(jiān)管工作���,以節(jié)省資源���,并最終為在歐洲建立一個融合的藥品市場創(chuàng)造先決條件,從而在歐盟范圍內(nèi)營造出充分保護公眾健康的藥品監(jiān)管環(huán)境�。
3.3 OECD 建立的衡量監(jiān)管績效計劃
OECD 是一個致力于制定更好的全球化政策以改善公眾生活的國際組織[26]。OECD 建立了衡量監(jiān)管績效計劃�,旨在通過兩種方式幫助OECD 成員國提高監(jiān)管質(zhì)量,一種是改進評估監(jiān)管績效的政策���、計劃和工具���,另一種是展示監(jiān)管治理的改進����,以保障企業(yè)和公民的利益����。
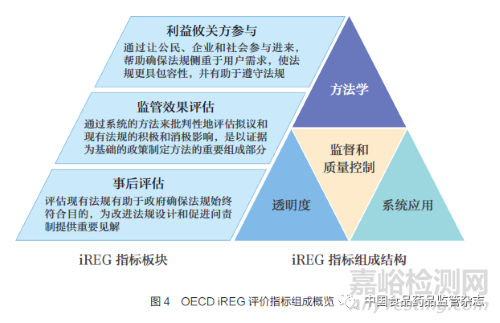
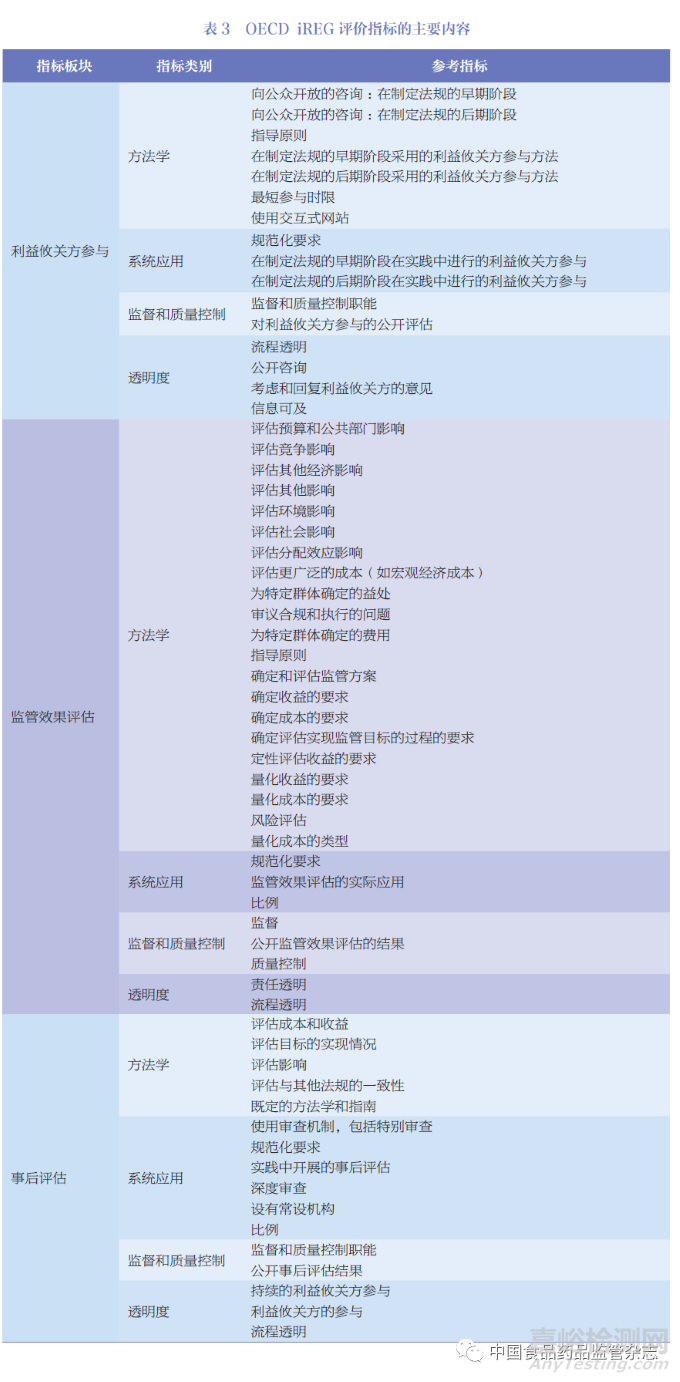
衡量監(jiān)管績效主要依賴于OECD 發(fā)布的監(jiān)管政策和治理指標(Indicators of Regulatory Policy and Governance ,iREG)����,通過關(guān)鍵指標的評估得出監(jiān)管治理的建議, 為OECD成員國監(jiān)管政策和治理實踐提供最新證據(jù)�。此外,OECD 基于iREG 定期發(fā)布監(jiān)管政策展望系列白皮書���,以介紹成員國提高監(jiān)管治理的努力并分享良好的監(jiān)管實踐�。iREG 包括3 個綜合板塊���,為利益攸關(guān)方參與(Stakeholder Engagement�,SE)���、監(jiān)管效果評估(Regulatory Impact Analysis����,RIA) 和事后評估(Ex-post Evaluation,ePE)���。每個綜合板塊由4 個同等加權(quán)的類別組成���,如圖4 所示:①系統(tǒng)應(yīng)用(systematic adoption),記錄正規(guī)要求以及這些要求在實踐中執(zhí)行的頻率����;② 方法學(xué)(methodology), 收集每個領(lǐng)域所用方法的信息的方法����, 如評估的影響類型或使用不同形式協(xié)商的頻率���;③ 監(jiān)督和質(zhì)量控制(oversight and qualitycontrol)���, 記錄監(jiān)管機構(gòu)的作用和公開的評價;④ 透明度(transparency)����,記錄與政府信息公開有關(guān)的問題等���。OECD 報告羅列了iREG 的主要評價指標,如表3 所示���。
3.4 CIRS 啟動監(jiān)管機構(gòu)效率優(yōu)化項目
科睿唯安旗下的CIRS 是一家獨立運營的中立國際會員組織。CIRS 為各利益攸關(guān)方提供了一個溝通對話的平臺���,通過監(jiān)管科學(xué)的創(chuàng)新應(yīng)用來討論和制定監(jiān)管政策����,并通過這些活動提高醫(yī)藥產(chǎn)品的可及性�,其已成為監(jiān)管績效分析和政策改革的中心之一。
科學(xué)的監(jiān)管系統(tǒng)是確保監(jiān)管機構(gòu)為其利益攸關(guān)方提供高效服務(wù)的關(guān)鍵�。在過去的20 年里,CIRS 通過收集績效指標并將質(zhì)量納入審查流程�,在藥品審查領(lǐng)域發(fā)揮了積極作用?��;趯CH成員和觀察員的多家監(jiān)管機構(gòu)早期基準研究的成功經(jīng)驗����,2013年CIRS 與來自亞洲、拉丁美洲�、非洲和中東的機構(gòu)啟動了一項獨特的指標收集計劃,稱為監(jiān)管機構(gòu)效率優(yōu)化項目(optimising efficiencies in regulator yagencies����,OpERA), 后來在比爾及梅琳達· 蓋茨基金會(Bill and Melinda Gates Foundation�,BMGF)的資助下擴展了規(guī)模。
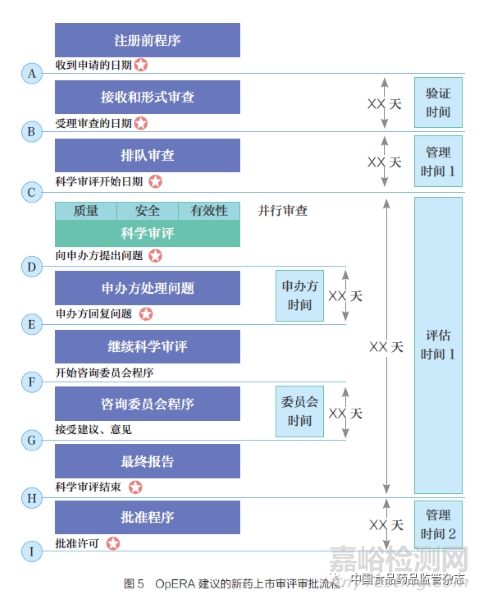
OpERA 目標在于推動評估和批準時間的監(jiān)管流程���、鼓勵對藥品批準過程開展系統(tǒng)的重新評估����、為上市許可審查中使用的不同流程提供比較基礎(chǔ)����、提供簡化流程來采集注冊審評和評估流程的基準數(shù)據(jù)、鼓勵開發(fā)系統(tǒng)的自我監(jiān)控和持續(xù)改進的方法����、幫助監(jiān)管機構(gòu)整合適合其授權(quán)范圍內(nèi)的最佳實踐�,以及確保相關(guān)產(chǎn)品的安全性、有效性和質(zhì)量等���。自2013 年OpERA 啟動以來����,已有30 多個國家和多個區(qū)域計劃參與其中。該項目成功地在參與機構(gòu)中建立了衡量和改進的基礎(chǔ)����, 幫助參與機構(gòu)定義審查績效目標、優(yōu)化審評流程���。OpERA 對于審評審批流程中的關(guān)鍵績效指標及流程如表4 和圖5 所示���。
3.5 GAO 發(fā)布對FDA科學(xué)誠信程序和培訓(xùn)及醫(yī)療人力資源規(guī)劃評估的關(guān)鍵要素
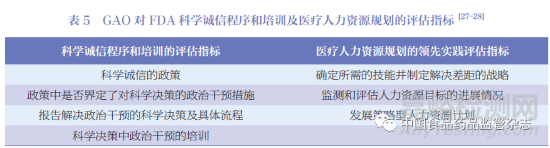
GAO 是美國國會的下屬機構(gòu),負責(zé)調(diào)查���、監(jiān)督聯(lián)邦政府的規(guī)劃和支出����。GAO 對美國食品藥品監(jiān)督管理局(Food and Drug Administration���,F(xiàn)DA) 監(jiān)管過程中遇到的問題或沖突進行對應(yīng)的評估����,并給出相應(yīng)的改進建議。FDA 則基于相關(guān)建議進行改善�,并在GAO 的網(wǎng)站上公布及更新工作進度。在GAO 官網(wǎng)檢索對FDA 的主要評估報告后�,可以發(fā)現(xiàn)GAO 對FDA 的評估幾乎涵蓋了藥品全生命周期,包括藥品上市后安全���、應(yīng)對全球化����、藥物濫用和藥品短缺防范等���。GAO 發(fā)布的FDA 科學(xué)誠信程序和培訓(xùn)及醫(yī)療人力資源規(guī)劃的評估中包含了具體的基準評估指標���,表5 對評估指標進行了具體地描述。
3.6 基準評估工具綜合對比
本研究選取了5 個監(jiān)管能力基準評估工具及其評估指標進行橫向?qū)Ρ?。從發(fā)布組織/ 機構(gòu)來看,涵蓋了國際組織�、第三方專業(yè)組織和獨立政府部門。除評估國家監(jiān)管體系外�,BEMA 和GAO 發(fā)布的評估工具亦可用于對具體機構(gòu)中監(jiān)管體系和監(jiān)管流程的評估。盡管不同的基準評估工具的目的不同���,但都致力于促進科學(xué)決策和推進監(jiān)管治理實踐����。此外�,每個評估工具都由不同的衡量指標構(gòu)成,并輔以獨立的衡量方法進行量化評估���。具體比較內(nèi)容如表6 所示�。
4���、 藥品監(jiān)管能力基準評估工具應(yīng)用現(xiàn)狀
藥品監(jiān)管能力基準評估工具已經(jīng)在全球范圍內(nèi)進行了不同程度的應(yīng)用���。本研究根據(jù)基準評估的4 個發(fā)展過程(即內(nèi)部基準、外部基準�、職能基準和流程基準),對基準評估工具應(yīng)用現(xiàn)狀進行梳理���,從文獻����、政府報告����、評價組織報告等資源搜集與藥品監(jiān)管能力基準評估工具有關(guān)的資料����,以分析目前全世界范圍內(nèi)藥品監(jiān)管部門對上述工具的應(yīng)用現(xiàn)狀���。
4.1 內(nèi)部基準
內(nèi)部基準評估指基于基準評估工具����,對國家或地區(qū)現(xiàn)階段藥品監(jiān)管能力建設(shè)現(xiàn)狀進行評估����。內(nèi)部評估可以是由監(jiān)管機構(gòu)自己發(fā)起的,也可以是由國際組織或第三方評估機構(gòu)發(fā)起的�。
截至2019 年12 月底, 已有26 個國家利用WHO 的GBT進行了正式的內(nèi)部基準評估����,另有54 個國家在WHO 的協(xié)助下使用GBT 進行了內(nèi)部評估[29]。此外����, 馬來西亞國家藥品管理局(National Pharmaceutical Regulatory Agency,NPRA)通過CIRS 發(fā)布的OpERA 確定了NPRA 審評審批流程中的時間花費[30]���,并為其提供了衡量績效改進的基線時間����。參與OpERA不僅幫助NPRA 了解其監(jiān)管績效,而且還發(fā)現(xiàn)了NPRA 需要努力解決的弱點和能力不足的領(lǐng)域����。例如����,NPRA 基于科學(xué)的目標路徑開始審評,并將申請人的響應(yīng)時間限制為6 個月���。
4.2 外部基準
外部基準評估是指將國家藥品監(jiān)管能力建設(shè)現(xiàn)狀與其他國家進行比較�,以了解其與良好監(jiān)管實踐國家的差距�。此處主要通過WHO 和OECD 兩個國際組織對諸多國家的監(jiān)管能力評估,以明晰監(jiān)管能力基準評估工具外部基準的應(yīng)用現(xiàn)狀�。
根據(jù)WHO 監(jiān)管體系數(shù)據(jù)庫顯示,在其194 個成員國中���,只有50 個國家擁有被認為成熟的監(jiān)管機構(gòu)( 成熟度ML4 或ML3)����,而其他144 個國家的監(jiān)管體系仍不完善[31]。其中����,99 個國家處于ML1 成熟度,45 個國家處于ML2 成熟度�。2022 年3月,新加坡衛(wèi)生科學(xué)局(Health Sciences Authority����,HSA) 成為全球首個取得WHO 最高評級的國家監(jiān)管機構(gòu)[32]。WHO 于2021 年10 月25 日至11 月5日派4 名官員及15 名國際評估員����,使用GBT 對HSA 進行評估并認定為成熟度ML4。ML4 意味著HSA 必須公布評估報告���,詳細說明注冊藥物和疫苗的安全性����、有效性和質(zhì)量����,以及利益風(fēng)險分析,這也進一步提高HSA 監(jiān)管決策的透明度�,也能協(xié)助其他國際醫(yī)藥監(jiān)管機構(gòu)使用新加坡的報告來審查相關(guān)產(chǎn)品����。HSA 的創(chuàng)新監(jiān)測系統(tǒng)也在本次評估中取得了良好的評價���,這套創(chuàng)新系統(tǒng)利用全國電子醫(yī)療健康記錄以及本地醫(yī)療專業(yè)人員網(wǎng)絡(luò)���,對與藥物和疫苗相關(guān)的不良反應(yīng)進行監(jiān)測,并通過數(shù)據(jù)分析讓監(jiān)管機構(gòu)能夠迅速采取行動�,保護公眾健康和安全���。2022 年11 月�,WHO 宣布韓國食品藥品安全部(Ministry of Food and Drug Safety�,MFDS) 已達到ML4, 標志著MFDS 正在以先進的績效水平運作�,并不斷改進監(jiān)管質(zhì)量[33]。
截至2021 年1 月�,OECD已經(jīng)收集到39 個國家和地區(qū)的數(shù)據(jù)?���!禣ECD 監(jiān)管政策展望2021》( OECD Regulatory Policy Outlook 2021)中提及在成員國評估報告中,iREG 指標得分近年來有所提升但進展緩慢����,事后評估和利益攸關(guān)方參與的審查結(jié)果仍有待改進����,監(jiān)管重點依舊在于對監(jiān)管效果評估的質(zhì)量審查[34]�。雖然對監(jiān)管的事后評估的總體進展緩慢,但一些OECD 成員國仍提供了可以借鑒的經(jīng)驗����。例如,德國在2019 年采用了一種更加全面和系統(tǒng)的方法���,要求對所有內(nèi)部事后評估和所有年度合規(guī)成本的立法提案進行獨立質(zhì)量保證���。盡管監(jiān)管效果評估是多數(shù)國家進行監(jiān)管的基石,但是監(jiān)管效果評估績效衡量仍不完全透明和系統(tǒng)化���, 大約1/3 成員國的司法機構(gòu)尚未發(fā)布有關(guān)監(jiān)管效果評估體系的報告���, 同時通過績效指標和調(diào)查意見來監(jiān)測監(jiān)管效果評估系統(tǒng)的作用也仍需完善。
4.3 職能基準
職能基準評估是指將與本行業(yè)外具有相同職能的監(jiān)管機構(gòu)的職能板塊進行評估對比����, 涵蓋藥品全生命周期����, 包括注冊和上市許可����、藥物警戒、市場監(jiān)管等���。我國也利用WHO 的GBT 對疫苗監(jiān)管進行了基準評估����。2022 年8 月23 日�, 我國正式通過WHO 疫苗國家監(jiān)管體系評估且達到三級成熟度(ML3)[35]����。這表示我國企業(yè)生產(chǎn)的疫苗產(chǎn)品具備申請WHO 產(chǎn)品預(yù)認證(Prequalification,PQ)的資質(zhì)���,預(yù)認證通過后���,產(chǎn)品可進入聯(lián)合國等國際組織采購清單,也表明我國疫苗監(jiān)管能力和水平穩(wěn)定和持續(xù)進步[36]���。WLA 框架的實施促進監(jiān)管機構(gòu)依賴國際可信任的產(chǎn)品和決策優(yōu)化使用有限資源����,同時促進全球或區(qū)域性監(jiān)管趨同、監(jiān)管方法協(xié)調(diào)和國際合作�,進一步改進良好監(jiān)管實踐[37]。
4.4 流程基準
流程基準評估是指將監(jiān)管機構(gòu)評估流程與其他擁有創(chuàng)新�、示范工作流程的機構(gòu)進行對比。藥品監(jiān)管能力基準評估中的流程基準多體現(xiàn)在對藥品審評審批流程的基準中�,CIRS 與沙特阿拉伯食品藥品監(jiān)督管理局(Saudi Food and Drug Authority,SFDA)合作�,對其審查流程和實踐進行表征,并與加拿大���、新加坡和澳大利亞的監(jiān)管體系進行比較[38]���。該研究不僅確定了 SFDA 的關(guān)鍵里程碑和時間表,還強調(diào)了改進的機會�,包括探索新加坡所使用的依賴模型,以及發(fā)布透明地傳達機構(gòu)決策理由的批準摘要���。此后����,SFDA 根據(jù)該研究的建議,在其審查過程中實施了風(fēng)險分層模型����。除此之外,CIRS 組織的年度OpERA 論壇為國家監(jiān)管機構(gòu)提供了聚在一起共同分享經(jīng)驗的重要機會���。該論壇可幫助與會者確定提高組織效率的新方法����,了解建立最佳監(jiān)管評估實踐的工具和流程����。
5、 藥品監(jiān)管能力建設(shè)基準評估綜合框架
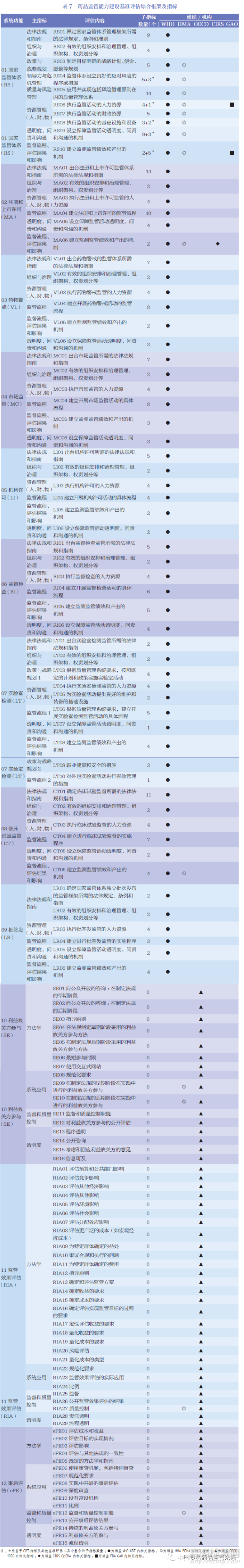
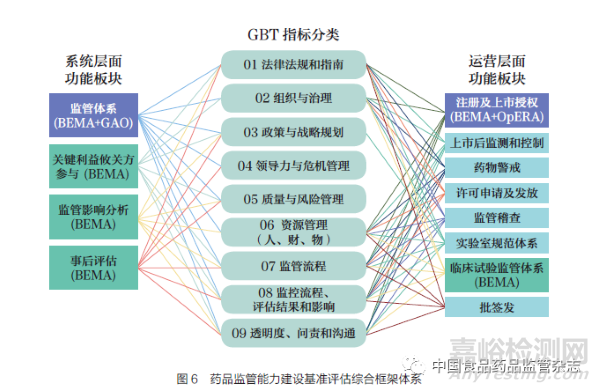
由于各國藥品監(jiān)管體系評估要素和選擇的基準評估工具各不相同�,根據(jù)同一衡量工具中預(yù)定的衡量指標收集數(shù)據(jù)以及進一步分析比較的過程, 增加了不同測量國家監(jiān)管能力的基準復(fù)雜性���。本研究結(jié)合WHO 的GBT、HMA 的BEM A���、OECD 的iREG 構(gòu)建了藥品監(jiān)管能力綜合評估基礎(chǔ)體系����。為了更完整地體現(xiàn)監(jiān)管能力建設(shè),本研究還結(jié)合第三方獨立評估機構(gòu)所提及的藥品監(jiān)管能力建設(shè)評估相關(guān)指標�,即CIRS-OpERA 對審評審批的評估指標和GAO 對FDA 科學(xué)誠信程序和培訓(xùn)及醫(yī)療人力資源規(guī)劃的評估指標。最終���,形成了適用于國際藥品監(jiān)管能力建設(shè)評價的綜合框架及指標體系����,所有指標分類后的匯總結(jié)果如表7所示���。
綜合框架包含了GBT 和iREG 的所有指標����。GBT 使用9個指標類別�,概述了268 個子指標,以衡量整個國家監(jiān)管體系框架和監(jiān)管職能的能力�。iREG 的3 個核心板塊涵蓋了61 個子指標。BEMA 的關(guān)鍵績效指標和特殊績效指標沒有單獨列出����,因為它們都涵蓋在GBT 和iREG 的指標中。OpERA 中關(guān)于藥品審評審批監(jiān)管過程的5 個關(guān)鍵指標與GBT MA 06(監(jiān)測監(jiān)管績效和產(chǎn)出的機制)重復(fù)�,而包含在科學(xué)誠信程序和培訓(xùn)及醫(yī)療人力資源規(guī)劃中的指標被納入GBTRS 06(執(zhí)行監(jiān)管活動的人力資源)和RS 10(監(jiān)測監(jiān)管績效和產(chǎn)出的機制)�。根據(jù)整合所有評估工具中衡量指標的對應(yīng)關(guān)系����,每個核心功能中子指標的對應(yīng)關(guān)系如圖6 所示?��?梢钥吹?���,iREG的3 個核心板塊被評估為全面覆蓋了GBT 的9 個指標類別�。
6、 結(jié)語
基準評估已在國際上被廣泛應(yīng)用于監(jiān)管機構(gòu)的能力評估���,尤其是在藥品監(jiān)管領(lǐng)域���。持續(xù)改進績效、不斷優(yōu)化決策是基準評估的根本目的[39]����,其有助于藥品監(jiān)管機構(gòu)進行內(nèi)部自評以發(fā)現(xiàn)自身問題,有助于通過外部對比來找到與其他監(jiān)管部門的差距����,有助于通過設(shè)定職能基準來明確需要重點關(guān)注的監(jiān)管內(nèi)容,也可以通過設(shè)定通用流程基準來完善監(jiān)管流程����。基準評估在藥品監(jiān)管領(lǐng)域的應(yīng)用趨于國際化�,促進了全球藥品監(jiān)管水平的提升,使得“制藥大國”“制藥強國”的先進經(jīng)驗可以系統(tǒng)地分享給監(jiān)管能力建設(shè)較為滯后的國家���。一方面提升了監(jiān)管績效優(yōu)秀的國家和地區(qū)的國際影響力����,助力醫(yī)藥產(chǎn)業(yè)發(fā)展����;另一方面也促進了國際監(jiān)管協(xié)同,保障患者可以及時獲得有質(zhì)量保障的藥品[40]�。
已有的基準工具被廣泛應(yīng)用于不同場景和需求下的藥品監(jiān)管能力建設(shè),覆蓋全球范圍�。各個評估工具的內(nèi)容側(cè)重有所不同,如WHO 近年來對中低收入或發(fā)展中國家的監(jiān)管能力建設(shè)有較多評估����,CIRS 則是更偏向于總結(jié)發(fā)達國家監(jiān)管經(jīng)驗來優(yōu)化成員國的審評審批,iRGE 則是強調(diào)從事前事后的模式下評估監(jiān)管對社會整體的影響�。除此之外���,HMA的BEMA 更注重分析當下的優(yōu)勢與劣勢,從而進一步提高監(jiān)管能力���;GAO 則是主要通過對具體項目實施過程中的問題提出建議���,來優(yōu)化監(jiān)管部門的決策制定過程。由于基準評估工具的側(cè)重點不同�,導(dǎo)致了相關(guān)工具的局限性。因此監(jiān)管機構(gòu)需要根據(jù)自身訴求選擇適用工具及相關(guān)指標���,即選擇適當?shù)幕鶞首鳛閰⒖?��,以提升自身藥品監(jiān)管能力。本研究提出了融合國際經(jīng)驗的綜合基準評估工具�,有助于借鑒國際經(jīng)驗推進制定更具國際視野的監(jiān)管實踐戰(zhàn)略,同時進一步促進跨國藥品監(jiān)管協(xié)調(diào)����、依賴和認可的監(jiān)管實踐標準,以及在國家層面彈性應(yīng)對藥品全球化趨勢所帶來的挑戰(zhàn)[41-42]���。
基準評估并非短暫����、階段性的評估計劃����,而是通過持續(xù)建立更可靠、更科學(xué)的監(jiān)管目標�,對標先進實踐,以達到長期的�、可持續(xù)的質(zhì)量改進的目的,形成成熟的質(zhì)量管理體系����。
根據(jù)我國目前的監(jiān)管能力現(xiàn)狀分析來看,需要加強基礎(chǔ)能力����、技術(shù)監(jiān)督、行政監(jiān)管����、信息化水平等方面的工作[43-44]。因此�,可以參考本研究提出的基準評估綜合框架,以法律法規(guī)����、監(jiān)管流程�、人力資源管理�、財政資源管理、信息溝通為一級監(jiān)管基礎(chǔ)構(gòu)建指標���;輔以上市注冊監(jiān)管���、上市后市場監(jiān)管、藥物警戒����、臨床試驗、疫苗批簽發(fā)等業(yè)務(wù)實操指標����;并增加事前、事后評估的利益攸關(guān)方參與�、政策影響、事后評估指標���。以基礎(chǔ)����、實操和評價三位一體的指標體系,全方位評估我國藥品監(jiān)管能力建設(shè)����,助力藥品監(jiān)管國際化、現(xiàn)代化�、科學(xué)化。