摘要
腸溶制劑的生物等效性試驗(yàn)是仿制藥質(zhì)量和療效一致性評價(jià)的難點(diǎn)之一。本文以質(zhì)子泵抑制劑類代表藥物奧美拉唑?yàn)槔?,總結(jié)和分析了奧美拉唑腸溶制劑通過仿制藥質(zhì)量和療效一致性評價(jià)的生物等效性試驗(yàn)情況,就試驗(yàn)內(nèi)容��、試驗(yàn)設(shè)計(jì)及樣本量等提出一些建議����,旨在為今后開展奧美拉唑腸溶制劑生物等效性試驗(yàn)提供參考。
根據(jù)《國務(wù)院關(guān)于改革藥品醫(yī)療器械審評審批制度的意見(國發(fā)[2015]44號)》��、《國務(wù)院辦公廳關(guān)于開展仿制藥質(zhì)量和療效一致性評價(jià)的意見(國發(fā)[2016]8號)》����,藥品生產(chǎn)企業(yè)原則上應(yīng)采用體內(nèi)生物等效性試驗(yàn)的方法進(jìn)行一致性評價(jià)�。奧美拉唑腸溶制劑作為目前有效的抗?jié)儾∷幬?�,臨床上應(yīng)用廣泛�,并被列入2018年版國家基本藥物目錄。生物等效性試驗(yàn)是仿制藥質(zhì)量和療效一致性評價(jià)的重要內(nèi)容��,奧美拉唑腸溶制劑生物等效性試驗(yàn)有一定的特殊性且不容易得到生物等效性的結(jié)果��,本文總結(jié)��、分析已經(jīng)通過仿制藥一致性評價(jià)的奧美拉唑腸溶制劑的生物等效性試驗(yàn)情況��,提出一些建議����,旨在為今后開展奧美拉唑腸溶制劑生物等效性試驗(yàn)提供參考。
一����、資料與方法
1、研究資料
在國家藥品監(jiān)督管理局藥品審評中心仿制藥一致性評價(jià)的信息公開欄目中�,檢索通過仿制藥一致性評價(jià)的奧美拉唑腸溶制劑的生物等效性試驗(yàn)情況。
2�、研究方法
對于二交叉試驗(yàn),按Schütz[1]的方法����,根據(jù)樣本量、受試制劑與參比制劑藥動學(xué)參數(shù)幾何均數(shù)比值(GMR)的90%置信區(qū)間(90% CI)估算個(gè)體內(nèi)變異系數(shù)(CVintra%)��。對于三周期部分重復(fù)試驗(yàn)和四周期完全重復(fù)試驗(yàn)����,根據(jù)信息公開欄中參比制劑個(gè)體內(nèi)標(biāo)準(zhǔn)差(SWR)計(jì)算CVintra% [2]。
二����、結(jié)果
1、公示信息
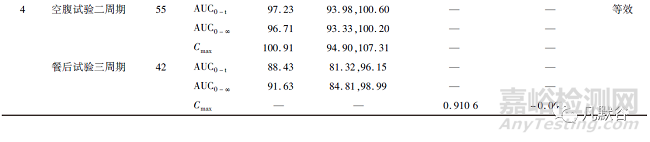
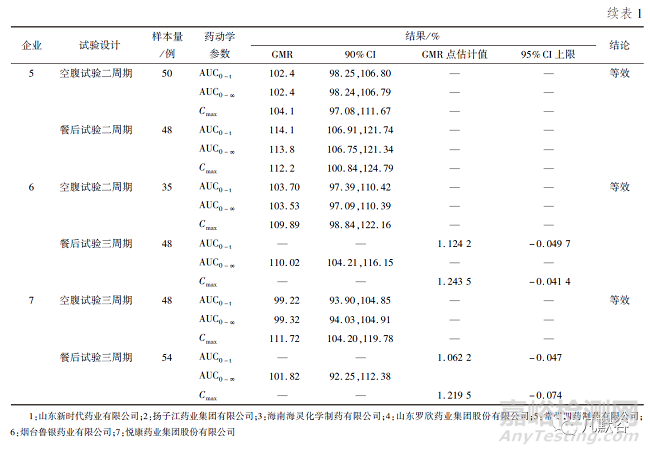
截至2022年3月26日����,在國家藥品監(jiān)督管理局藥品審評中心仿制藥一致性評價(jià)的信息公開欄中顯示共有1家企業(yè)的奧美拉唑腸溶片和6家企業(yè)的奧美拉唑腸溶膠囊通過了一致性評價(jià),主要信息總結(jié)如下:奧美拉唑腸溶片規(guī)格為10mg�,奧美拉唑腸溶膠囊規(guī)格均為20mg;均以健康受試者為試驗(yàn)對象�;試驗(yàn)內(nèi)容均包括空腹和餐后用藥試驗(yàn);空腹用藥試驗(yàn)的試驗(yàn)設(shè)計(jì)為二交叉試驗(yàn)或三周期部分重復(fù)試驗(yàn)����,餐后用藥試驗(yàn)的試驗(yàn)設(shè)計(jì)為二交叉試驗(yàn)��、三周期部分重復(fù)試驗(yàn)或四周期完全重復(fù)試驗(yàn)����;試驗(yàn)設(shè)計(jì)為二交叉試驗(yàn)時(shí)��,采用平均生物等效性(ABE)的方法進(jìn)行生物等效性評價(jià)�,試驗(yàn)設(shè)計(jì)為三周期部分重復(fù)試驗(yàn)或四周期完全重復(fù)試驗(yàn)時(shí),當(dāng)SWR≥0.294時(shí)采用參比制劑標(biāo)度的平均生物等效性(RSABE)的方法進(jìn)行生物等效性評價(jià)����,當(dāng)SWR<0.294時(shí)采用ABE的方法進(jìn)行生物等效性評價(jià);空腹用藥試驗(yàn)樣本量為27~55例�,餐后用藥試驗(yàn)樣本量為38~58例;檢測物質(zhì)均為血漿中奧美拉唑�;評價(jià)指標(biāo)均為AUC和Cmax;空腹用藥試驗(yàn)均采用ABE的方法進(jìn)行生物等效性評價(jià)����;餐后用藥試驗(yàn)中4家企業(yè)的AUC0-t、6家企業(yè)的AUC0-∞和1家企業(yè)的Cmax采用ABE的方法進(jìn)行生物等效性評價(jià)�,3家企業(yè)的AUC0-t、1家企業(yè)的AUC0-∞和6家企業(yè)的Cmax采用RSABE的方法進(jìn)行生物等效性評價(jià)�。評價(jià)結(jié)果詳見表1。
2、生物等效性評價(jià)結(jié)果分析
空腹用藥試驗(yàn)均是采用ABE的方法進(jìn)行生物等效性評價(jià)�。AUC0-t 的GMR為97.23%~104.47%,最低的90% CI下限為93.81%��,最高的90% CI上限為111.37%����;AUC0-∞的GMR為 96.71%~106.66%����,最低的90%CI下限為93.33%,最高的90%CI上限為111.78%�;Cmax的GMR為 95.74%~111.72%,最低的90%CI下限為86.48%����,最高的90%CI上限為122.56%。由此可見��,空腹用藥試驗(yàn) AUC0-t����,AUC0-∞和Cmax的GMR接近1,AUC0-t和AUC0-∞的90%CI較窄�,而Cmax的90%CI較寬。
餐后用藥試驗(yàn)中4家企業(yè)的AUC0-t�、6家企業(yè)的AUC0-∞和1家企業(yè)的Cmax采用ABE的方法進(jìn)行生物等效性評價(jià)��。AUC0-t的GMR為88.43%~114.1%�,最低的90%CI下限為81.32%��,最高的90%CI上限為121.74%��;AUC0-∞的GMR為91.63%~113.8%�,最低的90%CI下限為84.81%,最高的90%CI上限為121.34%��;Cmax的GMR為112.2%�,90%CI為100.84%~124.79%。餐后用藥試驗(yàn)中3家企業(yè)的AUC0-t��、1家企業(yè)的AUC0-∞和6家企業(yè)的Cmax采用RSABE的方法進(jìn)行生物等效性評價(jià)�。AUC0-t的點(diǎn)估計(jì)值(point estimate)為1.05~1.1242,AUC0-∞的點(diǎn)估計(jì)值為1.09����,Cmax的點(diǎn)估計(jì)值為0.9106~1.2435。由此可見����,餐后用藥試驗(yàn)AUC0-t,AUC0-∞和Cmax的GMR或點(diǎn)估計(jì)值范圍偏大,且其90%CI也較寬����。
3、CVintra%分析
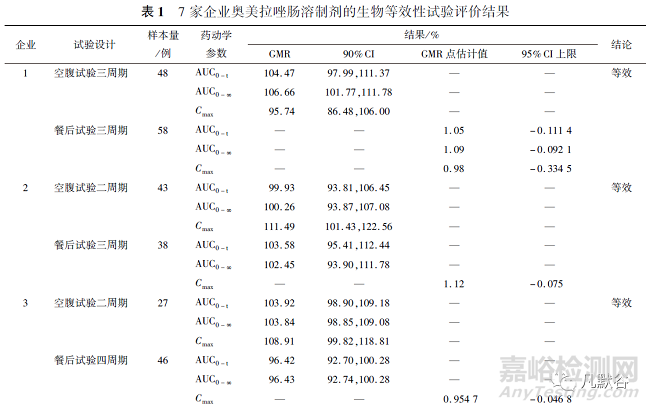
試驗(yàn)設(shè)計(jì)為二交叉試驗(yàn)時(shí)�,根據(jù)樣本量、受試制劑與參比制劑藥動學(xué)參數(shù)GMR的90%CI估算CVintra%����。試驗(yàn)設(shè)計(jì)為三周期部分重復(fù)試驗(yàn)或四周期完全重復(fù)試驗(yàn)時(shí)����,根據(jù)信息公開欄中SWR計(jì)算CVintra%,當(dāng)SWR<0.294時(shí)(相當(dāng)于CVintra%<30%)��,部分品種未提供SWR����,其CVintra%未知,結(jié)果見表2����。
空腹用藥試驗(yàn)結(jié)果表明,7家企業(yè)奧美拉唑藥動學(xué)參數(shù)AUC0-t��,AUC0-∞和Cmax的CVintra%均<30%,其中5家企業(yè)試驗(yàn)設(shè)計(jì)為二交叉試驗(yàn)�,可以估算CVintra%,其AUC0-t和AUC0-∞的CVintra%均<20%�,其Cmax的CVintra%在18.9%~26.6%。餐后用藥試驗(yàn)結(jié)果表明��,3家企業(yè)奧美拉唑藥動學(xué)參數(shù)AUC0-t的CVintra% >30%(32.9%~46.57%)��,其余4家企業(yè)奧美拉唑藥動學(xué)參數(shù)AUC0-t的CVintra%均<30%(1家企業(yè)為19.1%��,另3家企業(yè)未知)�;1家企業(yè)奧美拉唑藥動學(xué)參數(shù)AUC0-∞ 的CVintra%>30%(44.65%),其余6家企業(yè)奧美拉唑藥動學(xué)參數(shù)AUC0-∞的CVintra%均<30%(2家企業(yè)為18.8%~28.7%��,另4家企業(yè)未知)��;7家企業(yè)奧美拉唑藥動學(xué)參數(shù)Cmax的CVintra%均>30%(30.3%~86.70%)��。
三��、討論
1����、臨床試驗(yàn)現(xiàn)狀
奧美拉唑是質(zhì)子泵抑制劑類代表藥物,通過特異性抑制胃壁細(xì)胞的H+?K+ATP酶(質(zhì)子泵)��,從而阻斷胃酸分泌終端步驟,產(chǎn)生強(qiáng)力的抑制胃酸分泌作用�。國產(chǎn)奧美拉唑腸溶制劑價(jià)格相對低廉,占據(jù)了較大的市場份額����,由于國內(nèi)生產(chǎn)廠家眾多,競爭較為激烈��。在藥物臨床試驗(yàn)登記與信息公示平臺上檢索“奧美拉唑腸溶膠囊”��,目前共36項(xiàng)藥物臨床試驗(yàn)����,試驗(yàn)狀態(tài)除了35項(xiàng)在進(jìn)行中或已完成外��,還有1項(xiàng)試驗(yàn)為申辦方主動終止����。在藥物臨床試驗(yàn)登記與信息公示平臺上檢索“奧美拉唑腸溶片”,共4項(xiàng)藥物臨床試驗(yàn)����,試驗(yàn)狀態(tài)除了3項(xiàng)已完成外,還有1項(xiàng)試驗(yàn)為申辦方主動終止����。
本文中總結(jié)的7個(gè)奧美拉唑腸溶制劑的生物等效性試驗(yàn)均采用LC?MS/MS檢測血漿中奧美拉唑��;受試者空腹口服奧美拉唑腸溶膠囊參比制劑后奧美拉唑的Cmax為(436±46)ng·mL-1�,RSD僅為10.6%�;受試者餐后口服奧美拉唑腸溶膠囊參比制劑后奧美拉唑的Cmax為(262±58)ng·mL-1,RSD僅為22.3%��,不同試驗(yàn)得到的Cmax比較接近��,這說明臨床操作��、生物分析方面的誤差大大降低�,相對于前些年試驗(yàn)的質(zhì)量有明顯提高[3]。
2�、試驗(yàn)設(shè)計(jì)及樣本量
奧美拉唑腸溶制劑空腹用藥試驗(yàn)的試驗(yàn)設(shè)計(jì)為經(jīng)典的二交叉試驗(yàn)或三周期部分重復(fù)試驗(yàn),二交叉試驗(yàn)樣本量為27~55例����,三周期部分重復(fù)試驗(yàn)樣本量為48例,Cmax的CVintra%均低于30%(18.9%~26.6%)����。基于Cmax的CVintra%較低����,推薦采用經(jīng)典的二交叉試驗(yàn)����,按GMR為0.95或1.05����,根據(jù)Cmax的CVintra%計(jì)算的二交叉試驗(yàn)樣本量不超過32例。奧美拉唑腸溶制劑餐后用藥試驗(yàn)的試驗(yàn)設(shè)計(jì)為經(jīng)典的二交叉試驗(yàn)��、三周期部分重復(fù)試驗(yàn)或四周期完全重復(fù)試驗(yàn)��,二交叉試驗(yàn)樣本量為48例��,三周期部分重復(fù)試驗(yàn)樣本量為38~58例����,四周期完全重復(fù)試驗(yàn)樣本量為46例����,Cmax的CVintra%均高于30%(30.3%~86.70%),如果采用經(jīng)典的二交叉試驗(yàn)評價(jià)其與參比制劑是否具有生物等效性����,則需要較大的樣本量�,推薦采用重復(fù)試驗(yàn)設(shè)計(jì)�,按GMR為0.90或1.10,根據(jù)Cmax的CVintra%估算的三周期部分重復(fù)試驗(yàn)樣本量不超過45例��,按此估算的四周期完全重復(fù)試驗(yàn)樣本量不超過30例[2]�。
3、試驗(yàn)內(nèi)容
奧美拉唑?yàn)樯锼巹W(xué)分類系統(tǒng)(BCS)Ⅱ類的化合物[4]��,且奧美拉唑腸溶制劑為遲釋制劑����,吸收過程容易受進(jìn)食和食物的影響;另外��,奧美拉唑腸溶制劑說明書中規(guī)定的服用方法為口服�,1~2次·d-1,可每日晨起或早晚各1次��,表明患者可能會涉及空腹和飲食2種條件下服藥��,因此其生物等效性試驗(yàn)應(yīng)進(jìn)行空腹和餐后用藥試驗(yàn)��。
4�、試驗(yàn)結(jié)果
由于試驗(yàn)結(jié)果來自多個(gè)品種,且臨床試驗(yàn)質(zhì)量明顯提高�,綜合分析其結(jié)果后可得到一些有價(jià)值的信息����,匯總?cè)缦拢孩偕鲜銎贩N在空腹和高脂飲食條件下均等效����。空腹條件下��,AUC0-t�,AUC0-∞和Cmax的GMR接近1,AUC0-t和AUC0-∞的90%CI較窄����,而Cmax的90%CI較寬。高脂飲食條件下�,AUC0-t,AUC0-∞和Cmax的GMR或點(diǎn)估計(jì)值范圍偏大�,且其90%CI也較寬,說明高脂飲食條件下試驗(yàn)失敗的風(fēng)險(xiǎn)較高����。②空腹條件下�,不同試驗(yàn)得出的CVintra%差別較小,Cmax的CVintra%在18.9%~26.6%范圍內(nèi)��。高脂飲食條件下,不同試驗(yàn)得出的CVintra%差別較大��,Cmax的CVintra%在30.3%~86.70%范圍內(nèi)����,且CVintra%較空腹條件下明顯增加。分析原因����,奧美拉唑腸溶制劑為遲釋制劑且低溶解性藥物制劑,飲食因素對奧美拉唑的CVintra%影響較大[5]����。③高脂飲食可使奧美拉唑腸溶制劑的AUC和Cmax分別降低約16%和40%。奧美拉唑的理化性質(zhì)偏堿性����,不耐酸,因此奧美拉唑應(yīng)做成腸溶制劑��,其腸溶制劑能夠避免受到胃酸的破壞�,進(jìn)入腸道之后,當(dāng)pH值接近6.8時(shí)快速崩解釋放�。空腹條件下能夠較好地完成這個(gè)過程,但餐后條件下受食物pH的影響��,部分奧美拉唑釋放將受到胃酸的破壞而影響其吸收�。因此通常建議奧美拉唑腸溶制劑最好在飯前至少0.5h或飯后2h服用。
5��、其他
在人體內(nèi)奧美拉唑主要由CYP2C19代謝�,形成主要代謝產(chǎn)物羥基奧美拉唑;次要經(jīng)CYP3A4代謝�,生成奧美拉唑砜。奧美拉唑的藥動學(xué)受CYP2C19基因多態(tài)性等因素的影響�,表現(xiàn)為個(gè)體間差異較大。文獻(xiàn)報(bào)道�,45例黃種人和36例白種人口服奧美拉唑腸溶膠囊參比制劑后奧美拉唑的Cmax和AUC0-t個(gè)體間差異均較大[6-7]。在交叉設(shè)計(jì)的生物等效性試驗(yàn)中�,若有受試者只完成部分周期的試驗(yàn),其Cmax����,AUC0-t非常高或非常低,如果納入生物等效性分析��,可能會引起生物等效性評價(jià)結(jié)果產(chǎn)生較大偏差�。因此,對于在交叉設(shè)計(jì)的生物等效性試驗(yàn)中只完成了部分周期的受試者��,建議我國不將其納入生物等效性評價(jià)[8-9],美國最近頒布的指導(dǎo)原則未對此進(jìn)行明確規(guī)定[10]����。
參考文獻(xiàn):《中國新藥雜志》2023年第32卷第6期