一���、引言
藥品的微生物限度檢查是涉及藥品質(zhì)量和安全的重要項目�����,各國法規(guī)和技術(shù)指南對非無菌產(chǎn)品以及原輔料污染微生物的控制要求中���,均需要檢查不可接受微生物�,期望減少不可接受微生物對產(chǎn)品質(zhì)量以及患者安全帶來的風(fēng)險���,確保產(chǎn)品有效性和安全性�����,但實際執(zhí)行中重視程度和可操作性不強���,且歷史上非無菌產(chǎn)品中檢出控制菌以外的不可接受微生物導(dǎo)致召回的事件時有發(fā)生[1-5]。其主要原因為目前各國藥典中雖有原則性要求�,但在實際工作中,哪些產(chǎn)品需要進行不可接受微生物檢測�����,如何進行決策�����,目前沒有清晰�、明確的規(guī)定。另外���,從非無菌制劑���、原輔料中分離的微生物種類繁多,實際工作中不可能將所有的不可接受微生物全部列舉出來�,需要評估人員針對具體產(chǎn)品或者輔料進行分析,故如何準(zhǔn)確地判斷和決策在實際工作中有一定的困難�。
本文基于《中華人民共和國藥典》(以下簡稱《中國藥典》)[6]、美國藥典[7]和歐洲藥典[8]以及《中華人民共和國藥品管理法》(以下簡稱《藥品管理法》)等關(guān)于藥品質(zhì)量安全要求�����,研討不可接受微生物判斷標(biāo)準(zhǔn)�����;同時結(jié)合三部藥典以及ICHQ6A關(guān)于質(zhì)量標(biāo)準(zhǔn)中新原料藥和制劑的檢測以及可接受標(biāo)準(zhǔn)���、化學(xué)藥物中不同劑型以及原輔料的微生物限度的要求�����,分析非無菌產(chǎn)品以及原輔料中不可接受微生物控制策略���,以期為今后在實踐工作中能夠準(zhǔn)確地確認(rèn)不可接受微生物�,分析識別其風(fēng)險提供參考�����。
二���、不可接受微生物判斷標(biāo)準(zhǔn)
《中國藥典》�����、美國藥典以及歐洲藥典中關(guān)于不可接受微生物描述和判斷標(biāo)準(zhǔn)的比對見表1�����。
表1表明���,《中國藥典》以“具有潛在危害的微生物”形式描述,美國藥典和歐洲藥典均以檢出“other microorganisms”形式描述�,三部藥典均只有框架性的定義和評估內(nèi)容���,沒有具體的判定標(biāo)準(zhǔn)�����,所以需要生產(chǎn)企業(yè)結(jié)合法規(guī)要求以及制劑本身特性給出具體的判定標(biāo)準(zhǔn)�,實現(xiàn)對不可接受微生物的控制。
王似錦等[9]對不可接受微生物定義進行了梳理�,并給出了不可接受微生物的兩個特征:(1)可在藥品中繁殖,并對其化學(xué)�����、物理性質(zhì)產(chǎn)生不利影響�����,且破壞該藥品的功能及療效的微生物�;(2)當(dāng)藥品中存在的數(shù)量以及致病性會導(dǎo)致特定給藥途徑下適用該藥品治療的患者發(fā)生感染的微生物。此為基于微生物危害性評估給出的定義�����,本文結(jié)合上述定義以及《藥品管理法》[10]要求對于藥品定義和特殊要求�,從不同角度給出不可接受微生物判斷標(biāo)準(zhǔn)。
首先不可接受微生物屬于非藥典規(guī)定在產(chǎn)品或者原輔料中不得檢出的控制菌���,其次存在于非無菌產(chǎn)品且符合以下特征中的任何一項的微生物�����,可判定為不可接受微生物:(1)分離的微生物造成藥品理化特性發(fā)生改變�����;(2)分離的微生物對患者造成危害�����;(3)分離的微生物干擾藥品治療效果�。以上判斷標(biāo)準(zhǔn),既符合不可接受微生物評估的目的���,又能夠幫助評估人員簡單易行地判斷分離的微生物是否是不可接受微生物���。
三、不可接受微生物的控制策略
目前各國藥典僅有不可接受微生物評估內(nèi)容�,沒有給出不同的藥品以及原輔料的不可接受微生物的控制策略,故需要生產(chǎn)企業(yè)依據(jù)產(chǎn)品以及原輔料的微生物風(fēng)險給出具體的控制策略�,方便檢驗人員以及評估人員了解執(zhí)行。本文比較了ICH Q6A[1]�����、《中國藥典》[6]�、美國藥典[7]以及歐洲藥典[8]關(guān)于微生物限度檢查要求,梳理出不可接受微生物控制策略���。不可接受微生物評估需要針對具體產(chǎn)品以及原輔料進行分析�����,必要時結(jié)合微生物在非無菌產(chǎn)品中污染的可能性以及歷史召回事件分析���,給出非無菌產(chǎn)品和原輔料在不可接受微生物評估時需要關(guān)注的風(fēng)險點。
3.1 非無菌產(chǎn)品不可接受微生物控制決策樹
基于ICH Q6A[1](決策樹8:非無菌藥品的微生物檢查)�,《中國藥典》[6]、美國藥典[7]以及歐洲藥典[8]關(guān)于微生物限度檢查要求分別給出圖1�����、圖2和圖3中的產(chǎn)品不可接受微生物策略�����,通過比對找出共性的特征���,最終梳理出非無菌產(chǎn)品不可接受微生物決策樹�。
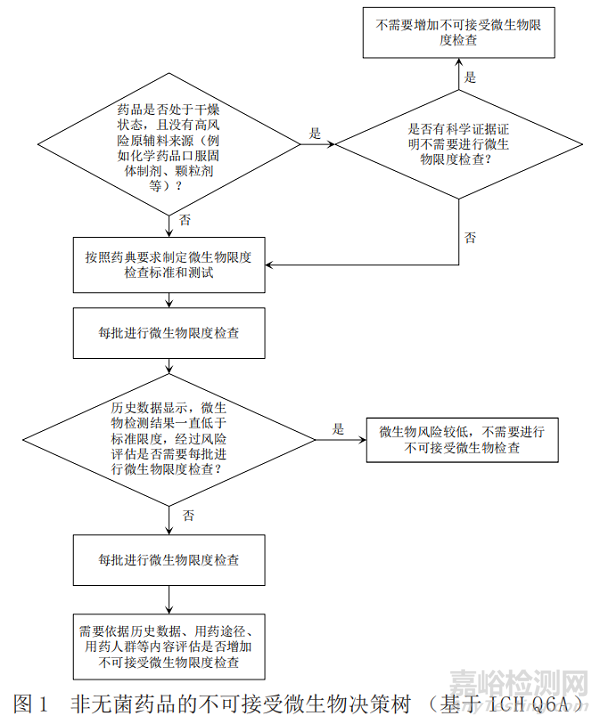
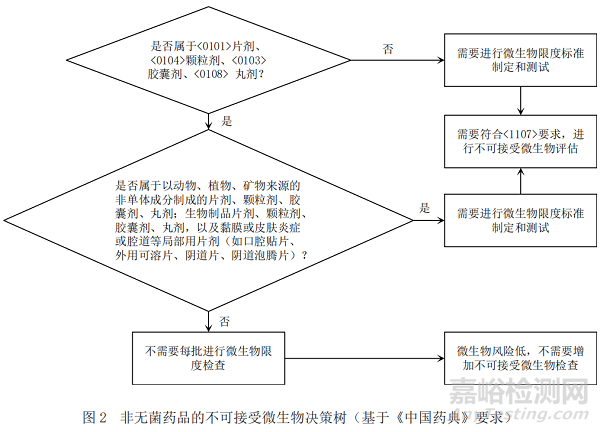
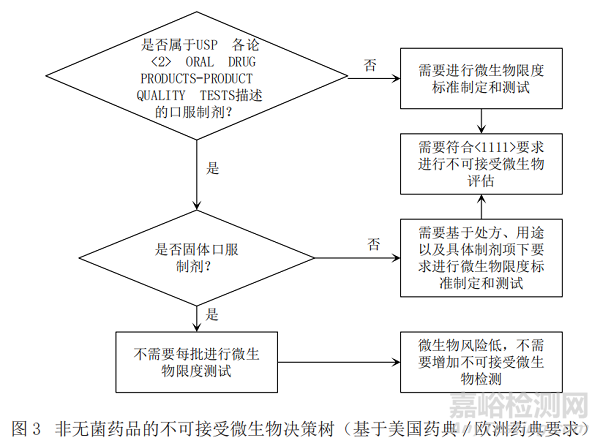
通過比對,依據(jù)ICH Q6A所作的決策樹可以涵蓋中�、美、歐三方藥典項下的要求�,強調(diào)了歷史數(shù)據(jù)在決策中的重要性;依據(jù)藥典所作的決策樹明確了各具體劑型要求���,故本文形成的決策樹主要依據(jù)ICH Q6A所作的不可接受微生物風(fēng)險控制決策樹�,同時兼顧《中國藥典》中的具體劑型要求�,可以快速準(zhǔn)確地幫助相關(guān)人員進行不可接受微生物評估和決策,具體的策略見圖4�。
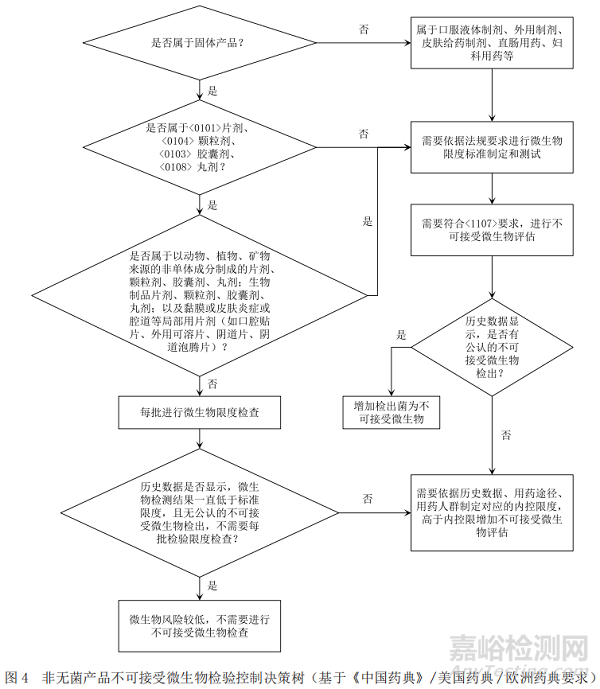
對于具體的每一種產(chǎn)品,不可接受微生物風(fēng)險僅考慮以上因素遠遠不夠�����,即使水分活度低的固體產(chǎn)品���,雖不利于微生物的生長繁殖[3]�,但是生產(chǎn)中污染的微生物有可能穩(wěn)定地存在于產(chǎn)品中���,超過一定的數(shù)量�����,就有可能增加不可接受微生物的風(fēng)險���;即使同一種制劑,檢出同一種微生物�����,但因用藥人群的不同�����,其風(fēng)險有可能不同�����。故在不可接受微生物評估時還需要基于產(chǎn)品工藝���、特征�、污染微生物的可能性�����、污染水平以及潛在危害等因素進行識別和評估,給出產(chǎn)品不可接受微生物的內(nèi)控限和必須控制的不可接受微生物���。內(nèi)控限的設(shè)定需要企業(yè)根據(jù)產(chǎn)品特性是否有利于微生物生長繁殖���,產(chǎn)品生產(chǎn)中需要的原材料引入不可接受微生物種類、數(shù)量以及生產(chǎn)過程中工藝用水���、生產(chǎn)環(huán)境���、工藝過程中不可接受微生物可能的生長繁殖情況等綜合評估產(chǎn)品整個生命周期內(nèi)污染狀況以及污染特性,綜合評估得出[4]���。在內(nèi)控限設(shè)置時���,還需要考慮產(chǎn)品的用藥人群。對于用藥人群為健康非免疫力低下人群的產(chǎn)品���,內(nèi)控限相比用于免疫力低下或者免疫系統(tǒng)不全的人群的產(chǎn)品高�����,例如有些企業(yè)對于非無菌化學(xué)制劑同一種產(chǎn)品�,當(dāng)用藥人群為非新生兒、嬰幼兒及體弱者等非免疫力低下人群時�,將內(nèi)控限設(shè)置為100 cfu·g-1;當(dāng)用于免疫力低的人群時���,內(nèi)控限設(shè)定為50 cfu·g-1���,當(dāng)檢驗數(shù)據(jù)高于此內(nèi)控限時,則需要增加不可接受微生物評估�����。
另外���,不可接受微生物評估還需要關(guān)注公認(rèn)的有害微生物,例如洋蔥伯克霍爾德菌群���、坂崎腸桿菌�����、皮斯羅爾斯頓菌等���。其中洋蔥伯克霍爾德菌群容易存活在水系統(tǒng)以及液體產(chǎn)品中���,且能在有強抑菌性的產(chǎn)品中生長繁殖[5,11],可能增加用藥人群感染和致病風(fēng)險�����,目前美國藥典將其列為吸入劑�、水溶性口服制劑等制劑中不可檢出的微生物,如果產(chǎn)品中檢出該微生物�����,可直接將其作為不可接受微生物�����。與此類似�,美國FDA建議藥品生產(chǎn)企業(yè)關(guān)注水基質(zhì)藥品中洋蔥伯克霍爾德菌群污染的問題[12-13]。坂崎腸桿菌對嬰幼兒有潛在的風(fēng)險���,如果檢出�����,根據(jù)臨床經(jīng)驗有可能增加感染風(fēng)險�����,則同樣需要將其作為不可接受微生物�。皮斯羅爾斯頓菌需要考慮用藥人群以及用藥途徑判定其是否作為不可接受微生物進行處理,如丙酸氯倍他索乳膏[14](皮膚外用非無菌產(chǎn)品)檢出的皮斯羅爾斯頓菌���,對于健康人群���、皮膚完整的人群,不太可能存在致病性�����,但是對于免疫低下�����、皮膚不完整(例如曬傷�����、皮癬或者皮膚擦傷)�����,有可能引起系統(tǒng)性的疾病�,進入血液后有可能引起敗血癥、肺炎等���。
實際中的情況可能更為復(fù)雜�����,企業(yè)在參考以上不可接受微生物檢驗策略時�,不僅需要考慮產(chǎn)品特性�、工藝過程,同時還需要對制劑的給藥途徑���、用藥人群�����、劑型特點等因素進行綜合考慮�,才能得出合理的評估結(jié)論�����。
3.2 原料藥和輔料不可接受微生物的控制決策樹
原料藥和輔料中不可接受微生物的控制,基于源頭和過程控制理念�����,對于從源頭上降低產(chǎn)品中不可接受微生物風(fēng)險有著重要的意義���。其控制策略的制定和終產(chǎn)品一樣�,同樣需要在滿足各國藥典對于原輔料微生物限度檢驗要求基礎(chǔ)上���,根據(jù)原輔料來源(特別需要關(guān)注天然來源原輔料中可能潛在的微生物)�����、原輔料及其制劑的特性�����、原輔料以及所用制劑的工藝過程是否有利于微生物繁殖、原輔料的用途�����、最終制劑的用藥人群���、原輔料以及所用制劑的歷史數(shù)據(jù)等因素綜合評估�����,給出不可接受微生物檢驗策略�����,確保最終制劑不可接受微生物風(fēng)險處于受控狀態(tài)���。
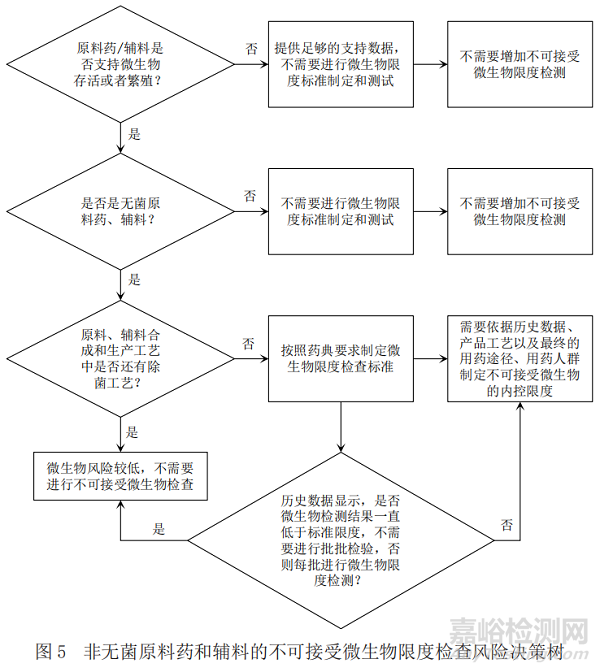
為了便于參考�,本文在考慮以上評估要素的基礎(chǔ)上���,同樣基于ICH Q6A[6](決策樹6:原料藥和輔料的微生物限度檢查)梳理出圖5非無菌原料藥和輔料的不可接受微生物的控制策略�。
四�����、結(jié)論
不可接受微生物為藥品中危害患者用藥安全和產(chǎn)品質(zhì)量的一類微生物�,企業(yè)應(yīng)當(dāng)根據(jù)產(chǎn)品屬性、工藝特性�����、患者人群、用藥途徑�����、生產(chǎn)過程控制中的風(fēng)險因素評估���,基于產(chǎn)品歷史數(shù)據(jù)���、可能的藥害事件,給出不同產(chǎn)品的不可接受微生物控制策略���,避免不可接受微生物對于產(chǎn)品質(zhì)量或者患者造成危害�。


作者:馬英英'���,王似錦2�,馬仕洪2�,繩金房’(1.西安楊森制藥有限公司,西安 710304; 2.中國食品藥品檢定研究院���,北京 100050: 3.陜西省藥品技術(shù)審評中心�,西安 710065 )