今日頭條
愛科諾RIPK1抑制劑獲批急排臨床�。愛科諾生物自主研發(fā)、擁有全球權(quán)益的創(chuàng)新口服小分子RIPK1抑制劑AC-003獲國家藥監(jiān)局批準(zhǔn)開展臨床研究�,評(píng)估用于治療急性移植物抗宿主病(aGVHD)患者的安全性、耐受性和初步療效�。臨床前研究數(shù)據(jù)顯示,AC-003能夠保持移植物抗白血病活性(GVL)�,不會(huì)引起免疫抑制,對(duì)造血細(xì)胞沒有負(fù)面影響�。這是AC-003繼特發(fā)性肺纖維化(IPF)后獲批臨床的第二個(gè)適應(yīng)癥。
國內(nèi)藥訊
1.江蘇恩華引進(jìn)FIC鎮(zhèn)痛藥獲批上市���。恩華藥業(yè)從Trevena公司引進(jìn)的新型小分子G蛋白偏向性μ-阿片受體(MOR)激動(dòng)劑奧賽利定富馬酸鹽注射液(Oliceridine注射液�,TRV130)獲國家藥監(jiān)局批準(zhǔn)上市,用于治療需要靜脈注射阿片類藥物的成人急性疼痛���。TRV130在優(yōu)先激活鎮(zhèn)痛療效信號(hào)通路的同時(shí)���,能夠減少引起不良反應(yīng)信號(hào)通路的激活。2020年���,該藥已在美國獲批上市�,用于治療需要靜脈注射阿片類藥物的成人患者的中重度急性疼痛���。
2.君實(shí)PD-1單抗或于今年Q3獲FDA批準(zhǔn)���。君實(shí)生物合作伙伴Coherus公司在2023年第一季度業(yè)績(jī)報(bào)告中透露,F(xiàn)DA將于今年5月來中國對(duì)PD-1特瑞普利單抗生產(chǎn)設(shè)施進(jìn)行現(xiàn)場(chǎng)核查�。這也是FDA對(duì)特瑞普利單抗用于治療鼻咽癌(NPC)生物制品許可申請(qǐng)(BLA)審查的一部分。目前�,特瑞普利單抗在美國申報(bào)的兩項(xiàng)關(guān)于鼻咽癌一線和二線治療的適應(yīng)癥均已在國內(nèi)獲批,Coherus預(yù)計(jì)特瑞普利單抗將于2023年第三季度獲得FDA批準(zhǔn)上市���。
3.榮昌IL-15通路靶向藥在澳獲批I期臨床����。榮昌生物開發(fā)的靶向白介素-15(IL -15)和白介素15受體 α(IL-15Rα)的Fc 融合蛋白RC198在澳洲獲批I 期臨床試驗(yàn)倫理許可���,即將在澳洲開展針對(duì)局部晚期不可切除或轉(zhuǎn)移性實(shí)體瘤患者的臨床研究���。這是RC198的首次人體試驗(yàn),擬評(píng)估RC198的安全性����、耐受性、及最大耐受劑量�。今年4月,榮昌生物已向CDE遞交了該產(chǎn)品的IND申請(qǐng)�。
4.旺山旺水新冠藥獲批RSV臨床。蘇州旺山旺水生物氫溴酸氘瑞米德韋干混懸劑(VV116)2.4類化藥獲國家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可����,擬用于治療呼吸道合胞病毒(RSV)感染。VV116是一款新型口服核苷類抗病毒藥物���,其片劑已于今年1月獲國家藥監(jiān)局附條件批準(zhǔn)上市����,商品為民得維,用于治療輕中度新型冠狀病毒感染(COVID-19)的成年患者���。
5.杭州暢溪引進(jìn)左旋多巴吸入干粉����。暢溪制藥與Acorda公司就后者左旋多巴吸入粉霧劑INBRIJA®達(dá)成合作許可協(xié)議����,獲得該新藥在大中華地區(qū)(中國大陸及港澳臺(tái)地區(qū))的開發(fā)和商業(yè)化授權(quán)。INBRIJA®是全球首個(gè)吸入性左旋多巴產(chǎn)品����,已在歐美獲批用于正在接受左旋多巴-多巴脫羧酶抑制劑治療的帕金森病患者關(guān)閉期(OFF)的間歇性治療。根據(jù)協(xié)議�,Acorda將獲得250萬美元的首期付款,以及多至1.41億美金的潛在里程碑付款���。
6.贊榮口服小分子HER2抑制劑授權(quán)羅氏���。贊榮醫(yī)藥宣布與羅氏就其臨床早期口服小分子HER2抑制劑ZN-A-1041的全球權(quán)益達(dá)成協(xié)議,羅氏將獲得ZN-A-1041在全球的進(jìn)一步開發(fā)�、生產(chǎn)和商業(yè)化權(quán)益。ZN-A-1041具有高度血腦屏障通透性,正在中美開展Ⅰ期臨床����,評(píng)估治療HER2陽性乳腺癌腦轉(zhuǎn)移以及預(yù)防患者腦轉(zhuǎn)移的潛力�。根據(jù)協(xié)議,贊榮醫(yī)藥將獲得7000萬美元首付款����,高達(dá)6.1億美元的開發(fā)和商業(yè)化里程碑后期付款,以及產(chǎn)品的銷售分成����。
7.基石終止與EQRx的海外授權(quán)協(xié)議。基石藥業(yè)宣布將終止與EQRx的合作許可協(xié)議���,并重獲PD-L1抗體舒格利單抗與PD-1抗體nofazinlimab在大中華區(qū)以外的開發(fā)與商業(yè)化權(quán)益�。目前���,舒格利單抗用于一線治療轉(zhuǎn)移性非小細(xì)胞肺癌的上市許可申請(qǐng)正在歐盟和英國接受監(jiān)管審查�;Nofazinlimab聯(lián)合侖伐替尼一線治療晚期肝細(xì)胞癌的國際III期注冊(cè)研究正在進(jìn)行中����,該研究結(jié)果將用于支持nofazinlimab的全球范圍內(nèi)的新藥上市申請(qǐng)。
國際藥訊
1.達(dá)格列凈獲FDA批準(zhǔn)拓展心衰適應(yīng)癥。阿斯利康SGLT2抑制劑Farxiga(dapagliflozin)獲FDA批準(zhǔn)拓展心衰適應(yīng)癥�,此前該藥已獲批用于射血分?jǐn)?shù)降低型心衰患者,此次獲批用于降低更廣泛患者的心血管死亡和心力衰竭住院風(fēng)險(xiǎn)����,意味著無論左心室射血分?jǐn)?shù)(LVEF)如何,心力衰竭患者都可以從該藥治療中受益����。兩項(xiàng)Ⅲ期臨床匯總結(jié)果顯示,無論患者LVEF值如何�,F(xiàn)arxiga在中位追蹤期為22個(gè)月時(shí),可降低患者14%的心血管死亡風(fēng)險(xiǎn)(p=0.01����,ARR 1.5%)。
2.羅氏VEGF-A/ANG-2雙抗新適應(yīng)癥報(bào)產(chǎn)����。羅氏VEGF-A/ANG-2雙抗法瑞西單抗(faricimab)新適應(yīng)癥的上市申請(qǐng)獲FDA受理,用于視網(wǎng)膜靜脈阻塞(RVO)的治療����。兩項(xiàng)國際III期研究(BALATON和COMINO)結(jié)果顯示,與aflibercept相比�,Vabysmo在改善患者因RVO引起的黃斑水腫與視力損害方面達(dá)到非劣效性標(biāo)準(zhǔn)���,患者視力平均改善的視力表字母分別為16.9個(gè)vs17.5個(gè),以及16.9個(gè)vs17.3���。此前���,faricimab已獲批用于治療糖尿病黃斑水腫(DME)和濕性年齡相關(guān)性黃斑變性(wAMD)���,商品名為Vabysmo�。
3.安進(jìn)「地舒單抗」真實(shí)世界研究數(shù)據(jù)積極����。安進(jìn)宣布將在WCO-IOF-ESCEO會(huì)議上公布地舒單抗(普羅力,Prolia)一項(xiàng)針對(duì)近50萬絕經(jīng)后骨質(zhì)疏松癥女性的真實(shí)世界研究的最新數(shù)據(jù)�。與阿侖膦酸鈉相比,Prolia降低了患者的骨折風(fēng)險(xiǎn)�。此外,普羅力治療持續(xù)時(shí)間越長(zhǎng)���,主要骨質(zhì)疏松性(MOP)骨折風(fēng)險(xiǎn)的降低更大�,具體為:第1年9%���;第2年12%����;第3年18%;第5年31%�;總體為39%。
4.首款口服糞菌療法Ⅲ期臨床最新結(jié)果積極���。Seres公司口服微生物組療法Vowst(SER-109)用于預(yù)防抗菌治療后艱難梭菌感染(CDI)復(fù)發(fā)的Ⅲ期開放標(biāo)簽ECOSPOR IV試驗(yàn)最新數(shù)據(jù)積極���。數(shù)據(jù)顯示,91.3%接受Vowst治療的患者在第8周達(dá)到臨床緩解���,其中94.6%患者在第24周仍保持緩解�。最常見的不良事件多為輕中度����。今年4月,Vowst已獲FDA批準(zhǔn)上市���,成為首款口服糞便微生物組療法�,用于在18歲以上成人中預(yù)防CDI復(fù)發(fā)����。
5.乳腺癌TONSL基因靶向療法臨床前研究積極����。印第安納大學(xué)Harikrishna Nakshatri研究團(tuán)隊(duì)將在2023年美國癌癥研究協(xié)會(huì)年會(huì)上展示新型乳腺癌療法的新型靶點(diǎn)(TONSL基因)的研究成果����。在TONSL基因被放大的乳腺癌模型中,乳腺癌對(duì)于能靶向作用FACT復(fù)合體的當(dāng)前藥物會(huì)高度易感���,顯示TONSL基因或許能作為上皮細(xì)胞永生化的關(guān)鍵調(diào)節(jié)子,從而促進(jìn)癌癥開啟并作為未來科學(xué)家們開發(fā)新型乳腺癌療法的潛在靶點(diǎn)���。
醫(yī)藥熱點(diǎn)
1.江蘇省人民醫(yī)院重慶醫(yī)院開工���。 5月9日上午,國家區(qū)域醫(yī)療中心——江蘇省人民醫(yī)院重慶醫(yī)院暨綦江區(qū)第二季度重大項(xiàng)目集中開工儀式在北部新城舉行���。該項(xiàng)目選址于北部新城���,總投資25億元,占地面積200畝���,總建筑面積21.9萬平方米���,規(guī)劃床位1000張���,預(yù)計(jì)2025年底建設(shè)完成。
2.全國首家“全流程無感就醫(yī)”落地四川���。5月8日�,四川大學(xué)華西第二醫(yī)院智慧醫(yī)院“全流程無感就醫(yī)”正式啟動(dòng)�,建檔、掛號(hào)�、預(yù)約、就診�、醫(yī)保繳費(fèi)、入院辦理���、出院結(jié)算���,全流程都可以通過人臉識(shí)別完成。這也標(biāo)志全國首個(gè)基于醫(yī)保電子憑證的全流程無感就醫(yī)新模式正式落地�。目前,醫(yī)院正在開發(fā)上線新功能����,將尚未辦理身份證的兒童���、新生兒或者嬰兒的信息與其父母信息綁定,可以使用父母的人臉識(shí)別信息進(jìn)行就醫(yī)�。
3.癢覺研究專家陳宙峰全職加入深圳灣實(shí)驗(yàn)室。5月7日���,深圳灣實(shí)驗(yàn)室發(fā)布消息����,前華盛頓大學(xué)醫(yī)學(xué)院�、華盛頓大學(xué)癢覺研究中心教授陳宙峰全職加入深圳灣實(shí)驗(yàn)室,任神經(jīng)疾病研究所資深研究員�。陳宙峰在癢這一領(lǐng)域做出了開創(chuàng)性貢獻(xiàn)���,他首次在中樞神經(jīng)系統(tǒng)發(fā)現(xiàn)癢基因——胃泌素釋放肽受體(GRPR)和傳遞癢覺的神經(jīng)回路���,這些發(fā)現(xiàn)將癢和疼痛區(qū)分開來,從而解決了該領(lǐng)域長(zhǎng)久以來一直爭(zhēng)論的難題����。
評(píng)審動(dòng)態(tài)
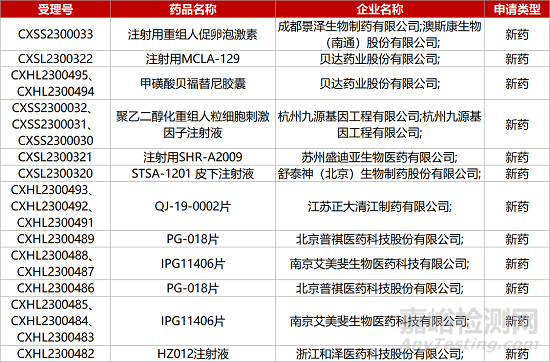
1. CDE新藥受理情況(05月09日)
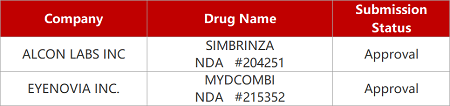
2. FDA新藥獲批情況(北美05月08日)