隨著真實(shí)世界研究(Real World Study,RWS)的關(guān)注度日益增加及其重要性愈發(fā)突出�����,各國(guó)政府和監(jiān)管機(jī)構(gòu)紛紛出臺(tái)政策以規(guī)范和促進(jìn)真實(shí)世界研究的發(fā)展。如何利用真實(shí)世界證據(jù)(Real World Evidence�����,RWE)評(píng)價(jià)藥物的有效性和安全性���,已成為全球相關(guān)監(jiān)管機(jī)構(gòu)、制藥工業(yè)界和學(xué)術(shù)界共同關(guān)注且極具挑戰(zhàn)性的問(wèn)題��。本文將對(duì)我國(guó)近幾年發(fā)布的真實(shí)世界研究相關(guān)政策及指導(dǎo)原則進(jìn)行梳理。
真實(shí)世界研究是針對(duì)臨床研究問(wèn)題���,在真實(shí)世界環(huán)境下收集與研究對(duì)象健康狀況和/或診療及保健有關(guān)的數(shù)據(jù)或基于這些數(shù)據(jù)衍生的匯總數(shù)據(jù),通過(guò)分析���,獲得藥物的使用價(jià)值及潛在獲益-風(fēng)險(xiǎn)的臨床證據(jù)的研究過(guò)程�����。簡(jiǎn)單來(lái)說(shuō),真實(shí)世界研究就是從真實(shí)世界數(shù)據(jù)(RWD)到真實(shí)世界證據(jù)(RWE)的一個(gè)過(guò)程�����。
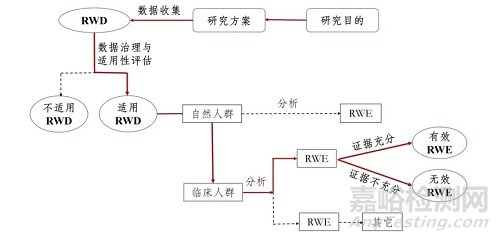
圖為支持藥物監(jiān)管決策的真實(shí)世界研究路徑(實(shí)線所示)
來(lái)源:《真實(shí)世界證據(jù)支持藥物研發(fā)與審評(píng)的指導(dǎo)原則(試行)》
我國(guó)真實(shí)世界研究相關(guān)政策及指導(dǎo)原則梳理
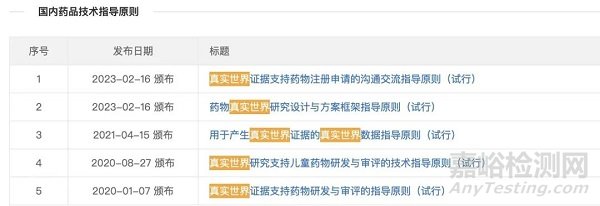
截至目前,國(guó)家藥監(jiān)局已發(fā)布5個(gè)真實(shí)世界研究相關(guān)指導(dǎo)原則��。
以下為國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心網(wǎng)站查詢數(shù)據(jù):
1�����、2020年1月《真實(shí)世界證據(jù)支持藥物研發(fā)與審評(píng)的指導(dǎo)原則(試行)》
2019 年 5 月���,國(guó)家藥品監(jiān)督管理局發(fā)布了《關(guān)于公開征求〈真實(shí)世界證據(jù)支持藥物研發(fā)的基本考慮〉意見的通知》,提出 RWE 可作為評(píng)價(jià)藥物安全性和有效性的一種策略和路徑��。2020年1月,國(guó)家藥品監(jiān)督管理局(NMPA)發(fā)布“一號(hào)文”——《真實(shí)世界證據(jù)支持藥物研發(fā)與審評(píng)的指導(dǎo)原則(試行)》�����,引發(fā)國(guó)內(nèi)乃至全球醫(yī)藥學(xué)術(shù)�����、工業(yè)界的廣泛關(guān)注。
本指導(dǎo)原則旨在厘清藥物研發(fā)和監(jiān)管決策中真實(shí)世界證據(jù)的相關(guān)定義���,指導(dǎo)真實(shí)世界數(shù)據(jù)收集以及適用性評(píng)估���,明確真實(shí)世界證據(jù)在藥物監(jiān)管決策中的地位和適用范圍�����,探究真實(shí)世界證據(jù)的評(píng)價(jià)原則��,為工業(yè)界和監(jiān)管部門利用真實(shí)世界證據(jù)支持藥物監(jiān)管決策提供參考意見���。
2、2020年8月《真實(shí)世界研究支持兒童藥物研發(fā)與審評(píng)的技術(shù)指導(dǎo)原則(試行)》
2020年8月27日���,國(guó)家藥監(jiān)局藥審中心進(jìn)一步發(fā)布關(guān)于《真實(shí)世界研究支持兒童藥物研發(fā)與審評(píng)的技術(shù)指導(dǎo)原則(試行)》的通告(2020年第22號(hào))���。該指導(dǎo)原則指出�����,真實(shí)世界作為新研究方法中的一種�����,已逐步用于支持兒童藥物的研發(fā)與審評(píng),為新藥注冊(cè)���、擴(kuò)展兒童適應(yīng)癥���、完善兒童劑量方案等提供支持。
3��、2021年4月《用于產(chǎn)生真實(shí)世界證據(jù)的真實(shí)世界數(shù)據(jù)指導(dǎo)原則(試行)》
由于“一號(hào)文”中對(duì)于RWD的相關(guān)概念���、來(lái)源、治理���、評(píng)估方法等闡述并不詳致,一定程度上影響了“一號(hào)文”在推動(dòng)我國(guó)RWS發(fā)展所發(fā)揮的作用���。2021年4月15日,國(guó)家藥監(jiān)局頒布了《用于產(chǎn)生真實(shí)世界證據(jù)的真實(shí)世界數(shù)據(jù)指導(dǎo)原則(試行)》�����,是我國(guó)真實(shí)世界數(shù)據(jù)(RWD)領(lǐng)域又一重要文件��。
該指導(dǎo)原則是《真實(shí)世界證據(jù)支持藥物研發(fā)與審評(píng)的指導(dǎo)原則(試行)》的配套和補(bǔ)充���,將從真實(shí)世界數(shù)據(jù)的定義、來(lái)源��、評(píng)價(jià)��、治理���、標(biāo)準(zhǔn)���、安全合規(guī)、質(zhì)量保障���、適用性等方面���,對(duì)真實(shí)世界數(shù)據(jù)給出具體要求和指導(dǎo)性建議,以幫助申辦者更好地進(jìn)行數(shù)據(jù)治理��,評(píng)估真實(shí)世界數(shù)據(jù)的適用性��,為產(chǎn)生有效的真實(shí)世界證據(jù)做好充分準(zhǔn)備��。
4��、2023年2月《藥物真實(shí)世界研究設(shè)計(jì)與方案框架指導(dǎo)原則(試行)》
為了指導(dǎo)申辦者科學(xué)合理地設(shè)計(jì)真實(shí)世界研究,明確真實(shí)世界研究方案撰寫的技術(shù)要求��,藥審中心組織制定了《藥物真實(shí)世界研究設(shè)計(jì)與方案框架指導(dǎo)原則(試行)》��,于2023年2月16日發(fā)布���,自發(fā)布之日起施行�����。
該指導(dǎo)原則曾于2022年7月7日發(fā)布《藥物真實(shí)世界研究設(shè)計(jì)與方案框架指導(dǎo)原則(征求意見稿)》���,該指導(dǎo)原則適用于通過(guò)真實(shí)世界研究獲得藥物評(píng)價(jià)的臨床證據(jù)��,也可供以非注冊(cè)研究為目的的真實(shí)世界研究參考���。重點(diǎn)闡述藥物研發(fā)及評(píng)價(jià)中真實(shí)世界研究設(shè)計(jì)以及研究方案制訂的基本考慮��,為藥物研發(fā)中開展真實(shí)世界研究提供指導(dǎo)意見�����。
5、2023年2月《真實(shí)世界證據(jù)支持藥物注冊(cè)申請(qǐng)的溝通交流指導(dǎo)原則(試行》
為促進(jìn)真實(shí)世界證據(jù)在藥品注冊(cè)申請(qǐng)中的應(yīng)用實(shí)踐,提高研發(fā)效率��,針對(duì)申請(qǐng)人與審評(píng)機(jī)構(gòu)開展真實(shí)世界證據(jù)支持注冊(cè)申請(qǐng)的溝通交流給出具體要求和指導(dǎo)性建議���,藥審中心組織制定了《真實(shí)世界證據(jù)支持藥物注冊(cè)申請(qǐng)的溝通交流指導(dǎo)原則(試行)》���,于2023年2月16日發(fā)布,自發(fā)布之日起施行�����。
本指導(dǎo)原則在《藥品注冊(cè)管理辦法》《藥物研發(fā)與技術(shù)審評(píng)溝通交流管理辦法》基礎(chǔ)上��,明確了使用真實(shí)世界證據(jù)支持注冊(cè)申請(qǐng)時(shí),溝通交流要討論的核心問(wèn)題�����、會(huì)議資料要求等,為申辦者在關(guān)鍵時(shí)間節(jié)點(diǎn)開展溝通交流提供建議�����,以提升藥物臨床研發(fā)效率�����。適用于將真實(shí)世界證據(jù)作為有效性和/或安全性評(píng)價(jià)的關(guān)鍵證據(jù)來(lái)支持藥物注冊(cè)申請(qǐng)時(shí)的溝通交流��,具體流程按照《藥物研發(fā)與技術(shù)審評(píng)溝通交流管理辦法》進(jìn)行管理實(shí)施�����。
其他相關(guān)政策
1�����、2021年10月《中成藥真實(shí)世界研究技術(shù)指導(dǎo)原則》
2021年10月25日��,全國(guó)團(tuán)體信息平臺(tái)發(fā)布了由中國(guó)中藥協(xié)會(huì)等組織起草的《中成藥真實(shí)世界研究技術(shù)指導(dǎo)原則》(T/CATCM 011—2021)團(tuán)體標(biāo)準(zhǔn)�����。該指導(dǎo)原則主要章節(jié)內(nèi)容針對(duì)各種常見的真實(shí)世界研究方法,從研究立題��、方法選擇�����、數(shù)據(jù)收集��、數(shù)據(jù)處理�����、統(tǒng)計(jì)分析���、經(jīng)濟(jì)學(xué)評(píng)價(jià)等方面�����,結(jié)合中成藥自身特點(diǎn)��,進(jìn)行了細(xì)致的闡述和科學(xué)指導(dǎo)�����,適用于我國(guó)基于真實(shí)世界數(shù)據(jù)的中成藥有效性�����、安全性及經(jīng)濟(jì)性評(píng)價(jià)參考�����。
2�����、2022年4月《海南博鰲樂(lè)城國(guó)際醫(yī)療旅游先行區(qū)醫(yī)療器械臨床真實(shí)世界數(shù)據(jù)應(yīng)用試點(diǎn)品種溝通交流程序(試行)》
為有序推進(jìn)海南博鰲樂(lè)城國(guó)際醫(yī)療旅游先行區(qū)醫(yī)療器械臨床真實(shí)世界數(shù)據(jù)應(yīng)用試點(diǎn)工作�����,促進(jìn)海南博鰲樂(lè)城國(guó)際醫(yī)療旅游先行區(qū)更快更好發(fā)展���,加強(qiáng)對(duì)醫(yī)療器械試點(diǎn)品種的早期介入和全程指導(dǎo),進(jìn)一步提高醫(yī)療器械試點(diǎn)品種溝通交流的質(zhì)量和效率��,國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心會(huì)同海南省藥品監(jiān)督管理局聯(lián)合制定《海南博鰲樂(lè)城國(guó)際醫(yī)療旅游先行區(qū)醫(yī)療器械臨床真實(shí)世界數(shù)據(jù)應(yīng)用試點(diǎn)品種溝通交流程序(試行)》�����,于2022年4月18日頒布�����。
3、2022年11月《國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心 海南省藥品監(jiān)督管理局 海南博鰲樂(lè)城國(guó)際醫(yī)療旅游先行區(qū)管理局開展藥品真實(shí)世界研究工作實(shí)施辦法》
為進(jìn)一步鞏固總結(jié)應(yīng)用試點(diǎn)工作經(jīng)驗(yàn),優(yōu)化完善工作機(jī)制�����,強(qiáng)化溝通交流程序��,國(guó)家藥監(jiān)局藥審中心會(huì)同海南省藥監(jiān)局、樂(lè)城管理局聯(lián)合修訂了《國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心 海南省藥品監(jiān)督管理局 海南博鰲樂(lè)城國(guó)際醫(yī)療旅游先行區(qū)管理局開展藥品真實(shí)世界研究工作實(shí)施辦法》���,于2022年11月16日頒布��,自發(fā)布之日起施行。
資料來(lái)源:
1.國(guó)家藥品監(jiān)督管理局.真實(shí)世界證據(jù)支持藥物研發(fā)與審評(píng)的指導(dǎo)原則(試行).2020.
2.國(guó)家藥品監(jiān)督管理局��、國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心、海南省藥監(jiān)局等網(wǎng)站.