今日頭條
舒泰神TSLP靶向單抗報哮喘IND���。舒泰神1類生物制品“STSA-1201皮下注射液”的臨床試驗申請獲CDE受理�。STSA-1201是一款靶向胸腺基質(zhì)淋巴細胞生成素(TSLP)的單抗藥物�����,旨在通過特異性結(jié)合并阻斷TSLP與其受體的結(jié)合�����,從而阻斷其生物學(xué)功能(如樹突細胞的激活���、Th2細胞因子和趨化因子的釋放�����、嗜酸性粒細胞浸潤和IgE的產(chǎn)生���,以及氣道高反應(yīng)等)���。該新藥擬開發(fā)用于哮喘的治療。
國內(nèi)藥訊
1.安進鈣敏感受體激動劑獲批中國上市�。安進鹽酸依特卡肽(Etelcalcetide,AMG 416)注射液獲國家藥監(jiān)局批準(zhǔn)上市���,為國內(nèi)首個且唯一上市的靜脈注射型擬鈣劑�。Etelcalcetide是一款鈣敏感受體(CaSR)激動劑�����,已于2017年在美國獲批用于治療繼發(fā)性甲狀旁腺功能亢進癥�����,針對那些接受血液透析治療的成人慢性腎臟疾病患者���。復(fù)星醫(yī)藥擁有Etelcalcetide在中國境內(nèi)的商業(yè)化授權(quán)�����。
2.信達PD-1單抗第7項適應(yīng)癥獲批上市�。信達生物PD-1抑制劑信迪利單抗注射液(商品名:達伯舒)獲國家藥監(jiān)局批準(zhǔn)第7項適應(yīng)癥,聯(lián)合達攸同(貝伐珠單抗生物類似藥)以及化療用于治療EGFR-TKI治療失敗的EGFR突變非鱗狀非小細胞肺癌(NSCLC)�。信達最近已在《柳葉刀》子刊上發(fā)表關(guān)鍵III期ORIENT-31研究積極結(jié)果。此前���,信迪利單抗已在中國獲批6項適應(yīng)癥均已被納入國家醫(yī)保目錄���。
3.海思科引進漸凍癥口溶膜報產(chǎn)。海思科從Aquestive Therapeutics引進的利魯唑口溶膜(Exservan)的上市申請獲國家藥監(jiān)局受理�����,用于治療肌萎縮側(cè)索硬化癥(ALS�,俗稱漸凍癥)���。Exservan是利魯唑的一種口腔膜劑�����,利魯唑是FDA批準(zhǔn)的首款治療ALS的藥物�,用于推遲ALS患者對呼吸機的依賴、延長生命���。該產(chǎn)品只需放在患者的舌頭上�����,無需液體或食物即可迅速溶解���,為吞咽困難或者無法吞咽的患者提供新的治療選擇。
4.康寧杰瑞HER2雙抗獲批Ⅲ期臨床�����。康寧杰瑞與石藥集團旗下津曼特生物聯(lián)合開發(fā)的重組人源化抗HER2雙特異性抗體注射液KN026獲國家藥監(jiān)局批準(zhǔn)開展一項Ⅲ期臨床�����,評估與注射用多西他賽(白蛋白結(jié)合型)聯(lián)用一線治療HER2陽性復(fù)發(fā)轉(zhuǎn)移性乳腺癌的有效性與安全性���。在II期臨床中�����,KN026聯(lián)合多西他賽達到76.4%的客觀緩解率(ORR)�����,中位緩解持續(xù)時間(mDoR)為24.0個月�����,疾病控制率(DCR)為100%�����。
5.華海雙通路融合蛋白獲批實體瘤臨床�。華海藥業(yè)旗下華奧泰生物自主研發(fā)的融合蛋白HB0025注射液獲FDA批準(zhǔn)開展一項Ⅰb/Ⅱ期臨床,擬聯(lián)合TIGIT單抗HB0030用于治療晚期實體瘤患者�����。HB0025是全球首個獲批進入臨床�����、能同時阻斷PD-1/PD-L1和VEGF/VEGFR這兩條信號通路的雙特異性融合蛋白�����,目前已分別在中國和美國獲批臨床�。華海藥業(yè)計劃在中美兩國同步開發(fā)HB0025以及HB0025的組合療法用于治療實體瘤。
國際藥訊
1.Eyenoiva擴瞳產(chǎn)品獲FDA批準(zhǔn)上市�。Eyenovia公司開發(fā)的托吡卡胺和鹽酸苯腎上腺素眼用噴霧劑Mydcombi獲FDA批準(zhǔn)上市,用于在診斷過程和需要短期瞳孔擴張的情況下誘導(dǎo)散瞳�。該產(chǎn)品采用了基于Eyenovia專有的微矩陣藥膜(MAP)技術(shù)而開發(fā)的微量給藥系統(tǒng)Optejet,可以將兩種散瞳藥以微液滴形式給藥至眼表���。極目生物擁有MydCombi在大中華區(qū)及韓國的開發(fā)和商業(yè)化權(quán)益�。
2.臺新藥改良型眼科藥物在美報NDA�。臺新藥股份有限公司開發(fā)的針對眼科術(shù)后抗炎鎮(zhèn)痛的改良型新藥激素納米混懸滴眼液(APP13007)已在美國遞交了新藥上市申請。GPN00833為一種強效皮質(zhì)類固醇丙酸氯倍他索(0.05%)的新型水性納米混懸滴眼液���。遠大醫(yī)藥擁有APP13007在中國大陸�、香港和澳門地區(qū)的獨家開發(fā)和商業(yè)化授權(quán)���。今年4月�����,該新藥已獲國家藥監(jiān)局批準(zhǔn)開展III期臨床研究�。
3.楊森IL-23抑制劑UC Ⅲ期臨床積極�����。強生旗下楊森IL-23抑制劑Tremfya(guselkumab)治療中重度潰瘍性結(jié)腸炎(UC)的Ⅲ期臨床QUASAR達到主要研究終點。與安慰劑組相比�����,Tremfya治療組患者12周時達到臨床緩解的比例更高(22.6%vs7.9%���,p<0.001)���;兩組臨床應(yīng)答、內(nèi)鏡改善和組織內(nèi)鏡粘膜改善的患者比例分別為61.5%vs27.9%(p<0.001)�、26.8%比11.1%(p<0.001)和23.5%比7.5%(p<0.001)。藥物相關(guān)不良事件發(fā)生率與安慰劑相似�。
4.禮來IL-23p19單抗UC Ⅲ期臨床積極。禮來IL-23p19單抗mirikizumab治療中重度活動性潰瘍性結(jié)腸炎(UC)的兩項Ⅲ期試驗(LUCENT-1和LUCENT-2)最新結(jié)果積極�����。在12周和52周時�����,mirikizumab治療組患者由于急需排便的緩解導(dǎo)致炎癥性腸病問卷(IBDQ)總分分別提高44.8%和32.5%�����;其中分別有22.7%和39.1%的改善是由于直腸出血得到緩解���,而32.5%和28.4%的改善則是源自排便頻率的緩解���。另外,mirikizumab治療UC兒科患者的Ⅱ期臨床中期數(shù)據(jù)與LUCENT-1試驗結(jié)果一致�。
5.記憶樣通用NK細胞療法獲批實體瘤臨床。INmuneBio公司NK細胞免疫療法INKmune™獲FDA批準(zhǔn)開展I/II期臨床�,評估用于腫瘤治療的安全性與有效性。INKmune™是一種無復(fù)制能力的人類腫瘤細胞系���,它與靜息NK細胞結(jié)合并提供多種基本的啟動信號���。臨床前研究顯示,INKmune將患者的rNK細胞轉(zhuǎn)化為記憶樣NK細胞���,該種細胞能夠克服免疫微環(huán)境的免疫抑制和缺氧難題�,直接靶向?qū)嶓w瘤并發(fā)揮殺傷作用���。
6.蘇庇醫(yī)藥約17億美元收購CTI公司�����。蘇庇醫(yī)藥(Swedish Orphan Biovitrum)宣布將以約17億美元收購CTI BioPharma�����,并獲其主導(dǎo)產(chǎn)品骨髓纖維化新藥Vonjo(pacritinib)�。pacritinib是一款能特異性抑制JAK2、IRAK1和CSF1R的口服激酶抑制劑�,已于去年3月獲FDA加速批準(zhǔn)上市,用于治療伴有嚴(yán)重血小板減少癥的骨髓纖維化患者�����。交易完成后�,CTI BioPharma將成為蘇庇醫(yī)藥的全資子公司,并共同推進pacritinib在治療骨髓增生性疾病方面的潛力���。
醫(yī)藥熱點
1.上海市胸科醫(yī)院心胸疾病臨床醫(yī)學(xué)中心項目獲批���。據(jù)上海市發(fā)展改革委消息,上海市胸科醫(yī)院心胸疾病臨床醫(yī)學(xué)中心項目已獲得可行性研究批復(fù)�,選址位于浦東新區(qū)唐鎮(zhèn)�,建設(shè)用地25523平方米�����,新建總建筑面積119953平方米���,其中:地上80794平方米、地下39159平方米���。項目總投資金額142523萬元�����。該項目聚焦胸部腫瘤學(xué)和心血管病學(xué)�����,將打造集臨床診療�����、臨床研究�、轉(zhuǎn)化醫(yī)學(xué)�����、基礎(chǔ)研究為一體的產(chǎn)學(xué)研醫(yī)發(fā)展中心和人才培養(yǎng)高地。
2.胡華忠任復(fù)旦上醫(yī)黨委副書記�����、紀(jì)委書記�����。5月8日上午���,復(fù)旦大學(xué)上海醫(yī)學(xué)院領(lǐng)導(dǎo)班子調(diào)整宣布會議舉行�����。會議宣布了中共上海市委決定�����,胡華忠同志任復(fù)旦大學(xué)上海醫(yī)學(xué)院黨委副書記�����、紀(jì)委書記�����,免去復(fù)旦大學(xué)上海醫(yī)學(xué)院黨委副書記�����、紀(jì)委書記楊偉國同志的紀(jì)委書記職務(wù)�。
3.鄭州市階段性降低職工醫(yī)保繳費費率�。為進一步減輕參保單位和靈活就業(yè)人員負(fù)擔(dān),鄭州市本月起�,在不降低參保人員醫(yī)保待遇水平的前提下,將階段性降低職工基本醫(yī)療保險繳費費率�。新政規(guī)定,執(zhí)行期限內(nèi)�, 鄭州市職工基本醫(yī)療保險費率階段性降低1個百分點,其中�,職工醫(yī)保繳費費率由原來的10%調(diào)整為9%,不含生育保險���。具體來說�,就是原來單位職工醫(yī)保繳費費率率為8%���、個人為2%���,調(diào)整后�,單位繳費率下調(diào)為7%�、個人繳費率仍為2%。在此期間�,鄭州市靈活就業(yè)人員基本醫(yī)療保險費率階段性也降低1個百分點,由原來的10%調(diào)整為9%�����。
評審動態(tài)
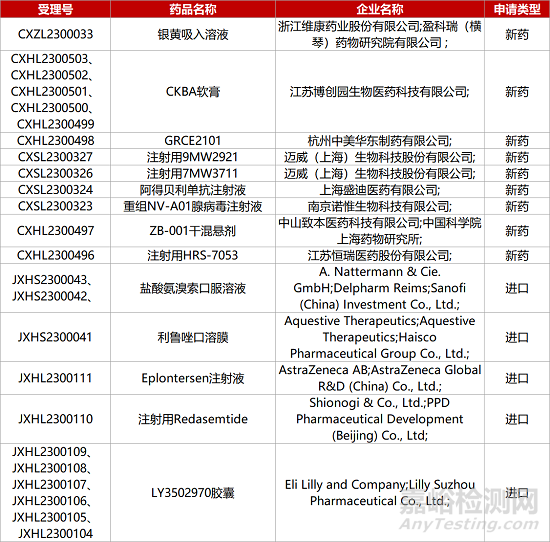
1. CDE新藥受理情況(05月10日)
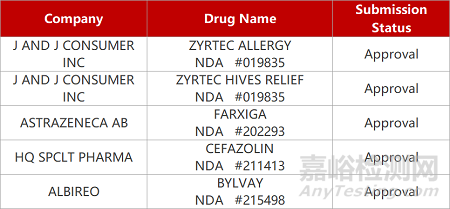
2. FDA新藥獲批情況(北美05月08日)