超說明書用藥(OLDU)���,又稱藥品未注冊用法��,是指藥品使用的適應(yīng)癥��、給藥劑量��、適用人群或給藥途徑等不在藥品監(jiān)督管理部門批準(zhǔn)的說明書之內(nèi)的用法����。2022年3月開始實施的《中華人民共和國醫(yī)師法》(以下簡稱《醫(yī)師法》)首次在法律層面明確了醫(yī)生可以進行合理的超說明書用藥��,并規(guī)定僅在尚無有效或者更好治療手段等特殊情況下�,醫(yī)師取得患者明確知情同意后,可以采用藥品說明書中未明確但具有循證醫(yī)學(xué)證據(jù)的藥品用法實施治療��,同時��,醫(yī)院應(yīng)當(dāng)建立相應(yīng)的管理制度�。盡管超說明書用藥已經(jīng)被法律允許,但我國仍未出臺超說明書的實施細則��,包括循證醫(yī)學(xué)證據(jù)具體要求����、患者權(quán)益保護、醫(yī)院管理制度要求及醫(yī)保支付等�����。歐盟目前已經(jīng)有法國、德國�����、英國等10個國家制定了法律來規(guī)范超說明書使用����。法國建立了完善具體的法律監(jiān)管框架�,即同情處方框架(CPC)�,也是歐盟目前唯一需要監(jiān)管部門審查許可的國家。
本文通過研究CPC框架下超說明書用藥的審批���、公布���、監(jiān)測和醫(yī)保報銷機制,結(jié)合我國超說明書用藥監(jiān)管存在的問題��,提出相應(yīng)的完善建議��,為我國超說明書用藥監(jiān)管建設(shè)提供參考����。
一、我國超說明書用藥的監(jiān)管現(xiàn)狀
我國在2021年由全國人大常委會通過并實施的《醫(yī)師法》中首次明確了超說明書用藥的合法性�����。在此之前���,超說明書用藥未被法律明確規(guī)定���。2007年原衛(wèi)生部頒布實施的《處方管理辦法》第十四條第一款規(guī)定“醫(yī)師應(yīng)當(dāng)根據(jù)醫(yī)療、預(yù)防����、保健需要,按照診療規(guī)范�、藥品說明書中的藥品適應(yīng)癥、藥理作用�、用法、用量禁忌���、不良反應(yīng)和注意事項等開具處方����。”但診療規(guī)范沒有明確的規(guī)定,在一些診療指南中也存在著超說明書用法的推薦�。因此,我國此前臨床超說明書用藥的現(xiàn)象普遍而混亂��,實踐中醫(yī)師常常根據(jù)臨床經(jīng)驗����、專家共識而進行超說明書用藥,缺乏對超說明書用藥條件�、證據(jù)質(zhì)量的判斷。
為了滿足臨床診療的需求��,我國的一些行業(yè)協(xié)會和醫(yī)療機構(gòu)制定了一系列超說明書用藥的指導(dǎo)性文件����,以規(guī)范藥品超說明書用藥活動,以此降低法律風(fēng)險和醫(yī)療損害事件的發(fā)生��。目前�,我國臨床診療過程中的超說明書用藥的實施規(guī)范依據(jù),主要為行業(yè)協(xié)會和學(xué)術(shù)機構(gòu)發(fā)布的指導(dǎo)性原則�。
二、法國超適應(yīng)癥用藥的監(jiān)管框架
2012年第742 號法令公布實施的超說明書用藥監(jiān)管框架�����,即臨時推薦用藥(RTU)����,要求超說明書用藥提交審查,審查通過才可以合法使用��,并同步修改了《民法典》《公共衛(wèi)生法》《社會保障法》中的要求�,該框架由法國國家醫(yī)藥衛(wèi)生產(chǎn)品安全局(ANSM)負責(zé)實施。RTU框架包括了超說明用藥的申請�、審查、授權(quán)��、更新�����、患者監(jiān)測保護���、持續(xù)風(fēng)險評估�、暫停�、撤銷及終止全流程的要求。2021年����,ANSM更改了RTU框架,改名為同情處方框架(CPC),該框架增加了新的申請條件�,即申請的超說明書用法必須未開展商業(yè)化研究(包括歐盟以外的商業(yè)研究)。
法國實行審批制度��,由需要超說明書用藥的機構(gòu)藥房的藥劑師向ANSM提交申請����,ANSM在收到申請后通知擬使用藥品的上市許可持有人(MAH)提供支持審查的研究資料和治療使用及患者監(jiān)測方案,最后由ANSM組織專家進行風(fēng)險收益的評估���。具體流程如圖1所示�。
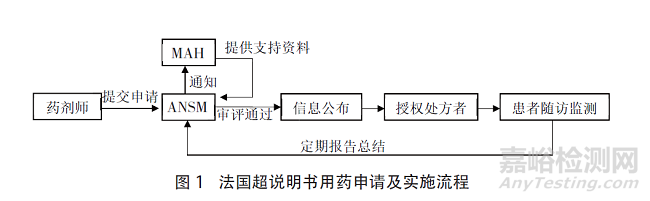
在法國CPC框架之下��,超說明書用藥的評估涉及了3個責(zé)任主體的參與��,分別是處方申請藥劑師����、藥品提供者MAH、監(jiān)管者ANSM����。治療使用和患者監(jiān)測方案是法國申請超說明書用藥的重要前提條件,法國要求MAH在申請后提供治療使用和患者監(jiān)測的方案���,并進行審批����。在處方者開具處方前��,應(yīng)當(dāng)取得患者的知情同意��,處方者和藥劑師負責(zé)用藥后的信息收集工作并且應(yīng)當(dāng)簽訂ANSM的治療使用和數(shù)據(jù)收集協(xié)議����。
ANSM要求獲得超說明書用藥許可的MAH提交定期總結(jié)報告,報告內(nèi)容應(yīng)當(dāng)包括在實施方案的背景下收集的所有信息的摘要�,這些信息涉及醫(yī)藥產(chǎn)品的使用條件、有效性和安全性�,以及任何可能導(dǎo)致改變對醫(yī)藥產(chǎn)品的效益/風(fēng)險比評價的信息,以及對醫(yī)藥產(chǎn)品的風(fēng)險-效益平衡的分析����。
ANSM建立了一個超說明書用藥數(shù)據(jù)庫,在納入CPC程序之后�����,該藥品的超說明書使用信息將收入到該數(shù)據(jù)庫�。公示信息包括該藥品納入CPC的標(biāo)準(zhǔn)和使用說明���,患者治療使用、隨訪協(xié)議和定期總結(jié)報告的摘要����。信息公開將有利于處方醫(yī)生的合理用藥,通過檢索該數(shù)據(jù)庫確定超說明書用藥的處方是否獲得審批��,另外這也有利于公眾監(jiān)督和后續(xù)的風(fēng)險收益評估�����。
三�、相關(guān)建議
1.完善法律體系,加強患者保護
超說明書用藥具有合理性和必然性����,雖然《醫(yī)師法》明確了超說明書用藥的條件,但目前仍沒有國家政府層面的統(tǒng)一實施細則文件���。我國的行業(yè)協(xié)會和學(xué)術(shù)機構(gòu)已經(jīng)發(fā)布了一些專家共識�,并且被部分醫(yī)院使用����。我國的衛(wèi)生管理��、藥品管理等相關(guān)部門應(yīng)在此基礎(chǔ)上結(jié)合醫(yī)療機構(gòu)的執(zhí)行情況�,盡快確定和發(fā)布超說明書用藥的實施細則��,主要包括循證醫(yī)學(xué)證據(jù)要求���、診療實施規(guī)范���、患者保護要求��,規(guī)范診療過程�,保護醫(yī)生和患者的合法權(quán)益?�;颊弑Wo是實施過程中的核心要求���,也是此前發(fā)生法律案件判決時的關(guān)鍵影響因素之一�,但在此前的臨床實踐過程中患者保護意識薄弱�,缺乏患者保護措施。建議我國盡快出臺超說明書患者保護的具體要求���,與患者簽訂知情同意書并告知用藥的目的和條件����、藥品配備和使用方法、監(jiān)測隨訪程序���、可能的風(fēng)險和收益以及風(fēng)險防治方案����。
2.制定動態(tài)目錄�,提供使用依據(jù)
廣東省藥學(xué)會自2015年開始制定并最終發(fā)布《超藥品說明書用藥目錄》,但該目錄僅作為推薦參考����,缺乏強制執(zhí)行力。我國可借鑒法國的數(shù)據(jù)庫建設(shè)做法����,制定我國的超說明書用藥的動態(tài)目錄。首先�,監(jiān)管部門應(yīng)當(dāng)確定超說明書用藥的納入要求,再將符合要求的超說明書用藥信息公開����,為醫(yī)生的超說明書用藥提供依據(jù),降低法律風(fēng)險��。另外,該公開目錄可結(jié)合處方前置審方制度和處方點評制度���,加強用藥前后的審批�����,減少不合理用藥的發(fā)生��。
3.加強后續(xù)監(jiān)測�,持續(xù)評估安全性與有效性
后續(xù)的監(jiān)測隨訪既可以起到保護患者安全的作用�,同時也可以收集治療數(shù)據(jù),更新超說明書用藥的安全性與有效性數(shù)據(jù)�,提供新的論證證據(jù)�����。法國監(jiān)管框架提供了一個新的思路�,建議多主體參與監(jiān)測評估過程,由醫(yī)生和藥劑師負責(zé)隨訪監(jiān)測和收集數(shù)據(jù)�����,藥品生產(chǎn)企業(yè)整合���、分析數(shù)據(jù)��,評估藥品的安全性和有效性����,并向監(jiān)管部門定期提供總結(jié)報告。監(jiān)管部門根據(jù)數(shù)據(jù)���,持續(xù)評估風(fēng)險收益平衡�,及時阻止可能存在風(fēng)險的情況發(fā)生����,保護患者安全。對于安全性與有效性持續(xù)良好的超說明書用法�����,藥品生產(chǎn)企業(yè)和監(jiān)管部門可以加強溝通����,探索該用法申報注冊和加速審評的可能性,盡早完成藥品說明書更新���,降低使用風(fēng)險����。


