召回是藥企對風(fēng)險產(chǎn)品進行的一種糾正��,改進的一種方式����。于FDA而言��,則是維護患者生命健康安全的一道防線��。召回既有自愿召回�����,也有強制召回����。一般而言�����,企業(yè)更偏向于自愿召回��,以防FDA采取更強硬的法律手段����。
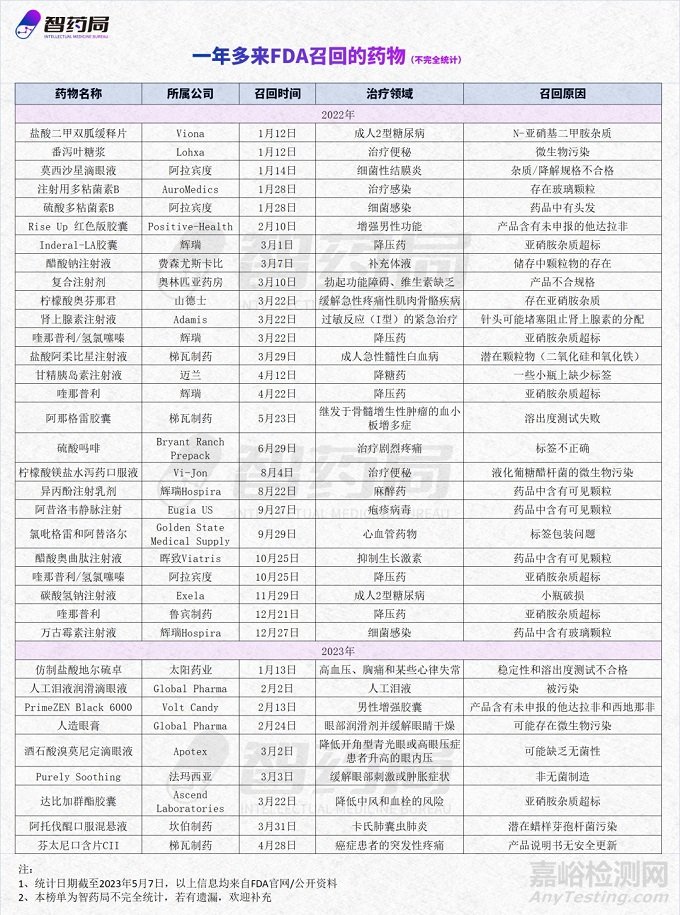
本文統(tǒng)計了近一年多來被FDA召回的35種藥物(不完全統(tǒng)計)����,以此來分析召回的原因和近幾年的趨勢,希望對業(yè)內(nèi)人士有所幫助����。值得注意的是,被稱為“仿制藥神話”的印度��,還是頻頻曝出質(zhì)量門事件��,引人深思����。
1、整體概況
在智藥局統(tǒng)計的35種召回藥品中,2022年有26種�����,2023年至今有9種�����。
從治療領(lǐng)域來看����,召回藥品種類多樣����,有治療糖尿病、高血壓����、白血病等慢性病藥品,也有治療便秘����、結(jié)膜炎、止痛藥等常規(guī)藥品�����。
其中,降壓藥和降糖藥比重最高��,各有6種和3種��,召回主要原因都是因為致癌物亞硝胺雜質(zhì)超標����。
從所屬公司來看,涉及多個國家�����,例如:美國的暉致和邁蘭��、以色列的梯瓦����、瑞士的山德士、印度的太陽藥業(yè)��、阿拉賓度和魯賓藥業(yè)��。
而這些公司�����,大多都處于全球仿制藥巨頭第一梯隊。其中�����,以阿拉賓度為代表����,近一年多來�����,至少有3起藥品召回事件����。
2、原因有五
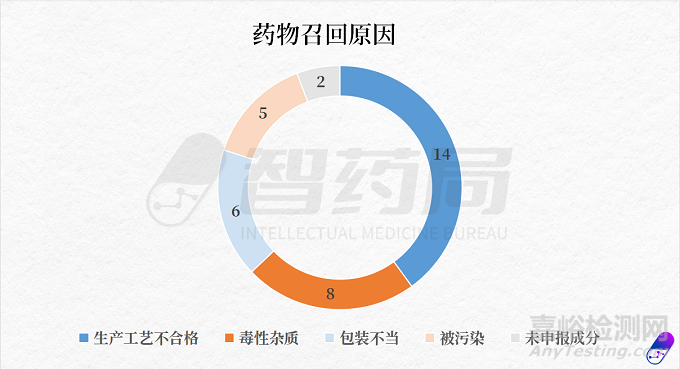
據(jù)智藥局統(tǒng)計��,近一年多來FDA召回藥品(以上述表格為基礎(chǔ))�����,原因多樣��,主要有五個:生產(chǎn)工藝不合格、含有毒性雜質(zhì)��、包裝不當����、被污染、未申報成分����。
其中,因生產(chǎn)工藝不合格被召回事件次數(shù)最多�����,共有14起��;其次是含有毒性雜質(zhì)��,共8起��;包裝不當排在第三位��,共6起����。
2.1 生產(chǎn)工藝不合格
生產(chǎn)工藝不合格包括在非無菌的環(huán)境下生產(chǎn)��、藥品中含有顆粒物��、溶出度測試和穩(wěn)定性測試不合格等情況����。
例如����,2022年3月29日,F(xiàn)DA發(fā)布公告�����,梯瓦制藥自愿召回鹽酸阿柔比星注射液USP 5 mg/5 mL �����,原因是因為其內(nèi)部檢查發(fā)現(xiàn)在一小瓶產(chǎn)品中有顆粒物質(zhì)����,后被確定為二氧化硅和氧化鐵��。
含有顆粒物質(zhì)的注射產(chǎn)品的給藥可能會導(dǎo)致局部刺激或腫脹以響應(yīng)異物����,更嚴重的是可能會阻塞心臟��、肺部或大腦中的血管����,從而導(dǎo)致中風(fēng)甚至死亡��。
梯瓦制藥表示����,迄今為止尚未收到與該產(chǎn)品召回相關(guān)的不良事件的任何報告。
2.2 毒性雜質(zhì)(以亞硝胺雜質(zhì)為主)
自從2018年發(fā)生沙坦類藥物因亞硝胺雜質(zhì)污染而大面積召回的事件以來��,亞硝胺雜質(zhì)就成為了FDA近幾年重點關(guān)注的內(nèi)容��。
基于此��,2022年12月21日�����,魯賓制藥自愿召回了四批降血壓藥物喹那普利片劑��,原因是因為亞硝胺雜質(zhì)超標�����。
無獨有偶,去年4月�����,輝瑞也自愿召回了五批Accupril品牌的喹那普利片劑��。3 月召回了Accuretic品牌喹那普利/氫氯噻嗪和鹽酸喹那普利/氫氯噻嗪的授權(quán)仿制藥�����。
亞硝胺在水和食物中很常見�����,包括腌制和烤肉�����、乳制品和蔬菜�����。但如果人們長時間接觸超過可接受的水平����,則會增加患癌癥的風(fēng)險。
2.3包裝不當
由于不當?shù)慕o藥指導(dǎo)��,亦或隨藥品提供的給藥工具出現(xiàn)問題��,某種藥品也會被召回��。
最近的是今年4月28日��,梯瓦制藥自愿召回了芬太尼口含片 CII 的特定批次����,因為這些產(chǎn)品的說明書中省略了安全更新。
不遵循或不知道藥物指南中遺漏的安全更新����,可能導(dǎo)致危及生命的不良事件。迄今為止�����,梯瓦尚未收到任何與產(chǎn)品標簽相關(guān)的投訴�����。
去年,邁蘭�����、Bryant Ranch Prepack和Exela也因為標簽等包裝問題����,召回了降糖藥和止痛藥等藥物。
2.4污染
微生物污染召回涉及多種藥品����,包括口服混懸液、軟膏和滴眼液����,涉及微生物種類的例子包括蠟樣芽孢桿菌、劍蘭伯克霍爾德菌和地衣芽孢桿菌等����。這一趨勢強調(diào)了在藥物制造和儲存中保持適當無菌和質(zhì)量控制的重要性����。
例如,因為存在微生物污染�����,Global Pharma,于今年2月2日和24日分別自愿召回了人工潤滑劑滴眼液和人工眼膏�����。
圖:人工潤滑劑滴眼液
據(jù)FDA消息��,就該人工潤滑劑滴眼液��,迄今為止�����,已有55起不良事件報告����,包括眼部感染、永久性視力喪失和血流感染死亡��。
2.5 未申報成分
近年來��,藥品中未申報成分一直是一個持續(xù)存在的問題����,即未獲得 FDA 事先批準以證明療效和安全性的上市藥物
例如��,2023年2月13日�����,Volt Candy自愿召回一批 PrimeZen Black 6000����,2000 毫克膠囊�����,因為它們含有未申報的他達拉非和西地那非�����。
含有西地那非和他達拉非的藥物可能與某些處方藥(如硝酸甘油)中的硝酸鹽相互作用����,并可能導(dǎo)致血壓顯著下降,從而危及生命�����,特別是使用硝酸鹽治療心臟病的成年男性�����。
去年2月�����,由于未申報的他達拉非��,Positive-Health自愿召回了Rise Up 紅色版膠囊�����。
3����、再曝質(zhì)量門事件
眾所周知,印度被稱為“仿制藥神話”��,據(jù)統(tǒng)計�����,其藥品銷往200多個國家����,仿制藥占全球仿制藥總量的四成�����,出口總量占全球的兩成����。
但很早以前�����,因為質(zhì)量門事件����,印度多個仿制藥巨頭頻上熱搜,被多個歐美國家“紅牌警告”�����。
如今看來��,也未能幸免�����。
其中,就有印度仿制藥巨頭太陽藥業(yè)�����,2018年5月�����,國家藥監(jiān)局發(fā)布公告����,由于存在質(zhì)量風(fēng)險����,自即日起在中國境內(nèi)暫停銷售印度太陽藥業(yè)生產(chǎn)的注射用亞胺培南西司他丁鈉。
而今年1月13日����,太陽藥業(yè)又陷入了一件召回事件中,其降血壓藥物仿制鹽酸地爾硫卓�����,未通過FDA實驗室的穩(wěn)定性和溶出度測試����,自愿召回����,說白了還是質(zhì)量問題�����。
無獨有偶��,印度仿制藥另一巨頭阿拉賓度��,在2019年��,就被FDA要求召回80多批批次的降壓藥物續(xù)沙坦�����,檢測到的雜質(zhì)N-亞硝基二乙胺超標�����。
在去年1月和10月��,阿拉賓度又有三起藥品召回事件��,主要原因還是致癌物超標、降解規(guī)格不合格等質(zhì)量問題�����。
上文我們還說到����,因為亞硝胺雜質(zhì)超標��,印度魯賓制藥在去年12月自愿召回了4個批次的喹那普利/氫氯噻嗪片劑�����。
這并不是第一次����,2021年10月FDA表示,魯賓制藥宣布召回其厄貝沙坦片和厄貝沙坦氫氯噻嗪片����,原因也是因為致癌物n -亞硝基貝沙坦含量超標。
基于上����,經(jīng)常會有人說:仿制藥行不通了......
對偷工減料和質(zhì)量控制不佳的擔(dān)憂����,是過去幾十年來印度制藥工業(yè)低價崛起的長期負面印象��。
未來能否扭轉(zhuǎn)質(zhì)量控制不力的名聲��,如今看來��,路還很長�����。