抗體藥物偶聯(lián)(Antibody Drug Conjugate, ADC)是一種克服化療局限性�、選擇性靶向腫瘤細(xì)胞的新興技術(shù)�。ADC的有效性取決于幾個(gè)物理化學(xué)因素��,如偶聯(lián)位點(diǎn)��、分子量�、連接體長(zhǎng)度、位阻�、半衰期、偶聯(lián)方式�、結(jié)合能等。盡管有超過(guò)100種ADC處于臨床試驗(yàn)階段��,但FDA批準(zhǔn)臨床使用的ADC只有14種�。因此,設(shè)計(jì)一個(gè)理想的ADC仍然具有挑戰(zhàn)性�。在本文中,我們討論了影響ADC有效性的關(guān)緊因素。此外�,我們還介紹了偶聯(lián)方法的最新進(jìn)展。此外��,我們還重點(diǎn)介紹了ADC的作用模式��、最近的挑戰(zhàn)以及ADC的未來(lái)前景����。
前言
抗體藥物偶聯(lián)物(Antibody Drug Conjugate, ADC)是一類新興的強(qiáng)效生物藥物,它通過(guò)合適的連接物(Linker)將強(qiáng)效細(xì)胞毒性有效載荷(Payload)與工程化單克隆抗體結(jié)合起來(lái)����,單克隆抗體通過(guò)靶向癌細(xì)胞表面表達(dá)的特定抗原,幫助將結(jié)合的有效載荷傳遞到特定的疾病部位��,因此減少旁路效應(yīng)引起的副作用�,提高了治療效率。盡管有100多種ADC處于臨床試驗(yàn)階段��,但FDA批準(zhǔn)臨床使用的ADC只有14種����。14種獲批藥物中,有7種用于臨床治療血液系統(tǒng)惡性腫瘤����,7種用于治療實(shí)體腫瘤(表1)��。
一般來(lái)說(shuō)ADC的偶聯(lián)方式�、分子量�、連接體長(zhǎng)度、位阻����、半衰期、異質(zhì)性以及一些物理化學(xué)因素是決定ADC藥物有效性的關(guān)鍵����,在本文中��,我們將重點(diǎn)討論影響ADC有效性的不同因素��。
表1 FDA批準(zhǔn)的ADC藥物
ADC的組成構(gòu)建
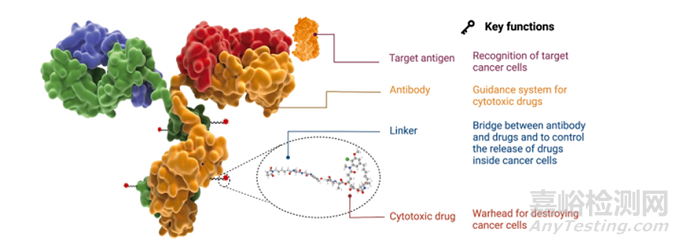
如圖1所示����,ADC由抗體、連接體和細(xì)胞毒性有效載荷組成(圖1)�。ADC的每一個(gè)組成部分都起著至關(guān)重要的作用,使ADC穩(wěn)定和潛在�,副作用最小。理想的ADC應(yīng)能有效地到達(dá)靶點(diǎn)而不釋放任何脫靶載荷。為了開發(fā)一種有效的ADC����,必須考慮抗原、抗體��、高毒載荷和連接子的選擇等因素�。
圖1 ADC結(jié)構(gòu)示意圖
A、抗原(靶點(diǎn)的選擇)
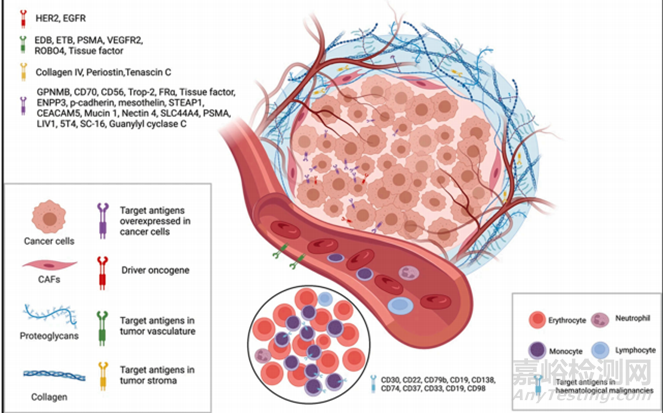
靶抗原有助于區(qū)分癌細(xì)胞和正常細(xì)胞��,從而降低脫靶毒性�。因此,選擇合適的靶抗原是開發(fā)理想ADC的第一步�。理想的抗原必須具有某些特征,首先與健康細(xì)胞相比��,它應(yīng)該在癌細(xì)胞表面過(guò)度表達(dá)����。例如,HER2 (三陽(yáng)性乳腺癌的靶抗原)在癌細(xì)胞中的拷貝數(shù)是正常細(xì)胞的100倍�,其次,靶抗原的結(jié)合位點(diǎn)應(yīng)面向癌細(xì)胞的外表面����,而不是面向癌細(xì)胞的內(nèi)部�。使從血管擴(kuò)散的ADC能夠在內(nèi)吞之前與靶抗原結(jié)合�,此外,靶抗原不應(yīng)進(jìn)入體循環(huán)以避免ADC在腫瘤外的不必要結(jié)合并且靶抗原應(yīng)具有內(nèi)化結(jié)合ADC的效力�。在已批準(zhǔn)和臨床期ADC中,最常用的血液學(xué)和實(shí)體腫瘤靶點(diǎn)分別是CD33��、CD30�、CD22、BCMA����、CD19、CD79B和HER2�、Nectin-4、Trop-2��、EGFR��、TF(圖2)��。此外����,細(xì)胞外基質(zhì)成分����、促進(jìn)血管生成的因子和腫瘤微環(huán)境成分已被報(bào)道為可能靶點(diǎn)�,并在臨床前和臨床階段顯示出其效力�。
B、抗體的選擇
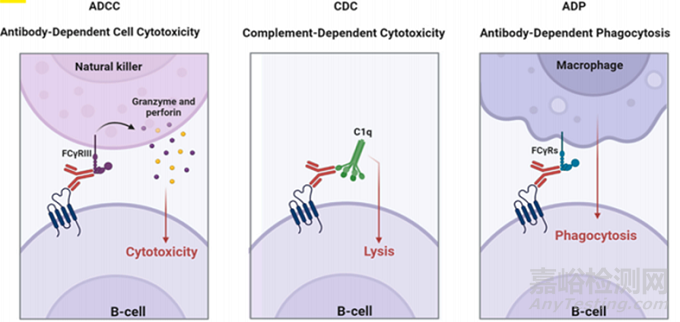
縱觀ADC藥物組成�,其中單抗體是與靶抗原特異性結(jié)合的重要載體??贵w必須對(duì)靶抗原具有高結(jié)合力和較低的免疫原性。此外��,抗體應(yīng)具有維持較長(zhǎng)的血漿半衰期和快速內(nèi)吞的能力����。此外,在治療過(guò)程中抗體除了可以將有效載荷運(yùn)送到目標(biāo)位置外�,如圖3所示,抗體Fc端還可以引發(fā)多種生物學(xué)活性�,如抗體依賴性細(xì)胞介導(dǎo)的細(xì)胞毒性(ADCC)、補(bǔ)體依賴性細(xì)胞毒性(CDC)和抗體依賴性細(xì)胞吞噬(ADP)�。在過(guò)去的幾十年里,在ADC藥物發(fā)展之初鼠源抗體被用于開發(fā)��,但鼠源抗體具有高免疫原性使得其應(yīng)用有一定局限性����。經(jīng)過(guò)重組技術(shù)的發(fā)展�,目前較多用于ADC的抗體為人源化抗體甚至全人源抗體�,大大降低了抗體的免疫原性。人血清中共存在5種抗體��。其中免疫球蛋白G (IgG)類是最豐富的血清抗體�,約占總抗體的70-85%,半衰期約為21天����。因此IgG是ADC發(fā)展中最常用的抗體。此外��,IgG類抗體有IgG1��、 IgG2��、IgG3和IgG4 4類亞類�。在這四個(gè)亞類中,IgG1對(duì)FcYRs具有很高的結(jié)合親和力��,因此與其他亞類相比�,IgG1誘導(dǎo)ADCC和CDC更有效��。IgG2在體內(nèi)通過(guò)非共價(jià)結(jié)合和高溫形成二聚體�。此外����,由于位阻作用�,ADC的效價(jià)降低,從而降低ADC的血藥濃度��。IgG3的半衰期很短��,約為7天�,因此降低了ADC的治療效果,并且在半衰期增加的同時(shí)不能改善Fc介導(dǎo)的效應(yīng)物功能��。IgG4具有誘導(dǎo)ADCC的能力��,但它含有Fab臂交換����,導(dǎo)致有效性降低。因此��,IgG1是ADC開發(fā)過(guò)程中最常用的抗體亞型�。
圖2 腫瘤細(xì)胞最常用的靶抗原和腫瘤微環(huán)境示意
圖3 抗體Fc端生物學(xué)活性示意
C、連接子(Linker)
連接子是抗體和有效載荷之間的橋梁��,對(duì)ADC的穩(wěn)定性和有效性起著重要作用��。此外,有效載荷的釋放也主要取決于連接子的類型和性質(zhì)��。較好的連接子應(yīng)具有高度的水溶性��,從從而防止ADC聚集的形成以及有效載荷在體循環(huán)中的過(guò)早釋放��。影響連接體穩(wěn)定性和載荷釋放的三個(gè)主要因素是共軛位點(diǎn)����、位阻和連接子長(zhǎng)度。通過(guò)選擇特定的偶聯(lián)位點(diǎn)和修飾的連接體�,可以得到穩(wěn)定的ADC。
D�、有效載荷(Payload)
有效載荷是ADC的彈頭�,通常是一種高細(xì)胞毒性藥物。理想的ADC應(yīng)具有強(qiáng)效性��,對(duì)全身循環(huán)中多種代謝或分解代謝過(guò)程中的任何化學(xué)反應(yīng)都具有穩(wěn)定性,溶解度高�。此外,它還應(yīng)具有共軛和膜透性的官能團(tuán)����。由于溶酶體屏障和腫瘤微環(huán)境的復(fù)雜性,很少有細(xì)胞毒性藥物能到達(dá)靶點(diǎn),因此通過(guò)抗體靶向性遞送可以有效到達(dá)相應(yīng)靶點(diǎn)����。在穩(wěn)定性方面�,有效載荷應(yīng)該在系統(tǒng)循環(huán)和制造過(guò)程中對(duì)任何化學(xué)反應(yīng)都是穩(wěn)定的。不穩(wěn)定的有效載荷可能會(huì)在血液循環(huán)中轉(zhuǎn)化為活性構(gòu)型��,導(dǎo)致不良副作用����。如果有效載荷在溶酶體狀態(tài)下不穩(wěn)定,則應(yīng)在細(xì)胞表面或進(jìn)入細(xì)胞之前將有效載荷分離�。在溶解度和膜滲透性方面,一般來(lái)說(shuō)��,由于抗體的蛋白質(zhì)性質(zhì)����,偶聯(lián)過(guò)程通常是在水環(huán)境中進(jìn)行的,然而�,具有疏水性的有效載荷需要大量的有機(jī)溶劑進(jìn)行共軛。過(guò)度使用有機(jī)溶劑會(huì)使抗體變性����。此外,疏水載荷可以改變藥代動(dòng)力學(xué)性質(zhì)并形成聚集。因此�,推薦選擇水溶性有效載荷來(lái)避免上述問(wèn)題。此外根據(jù)目的不同����,如果ADC本質(zhì)上是可切割的,那么它應(yīng)該是親水的����,以支持ADC獲得水溶性。如果為了通過(guò)細(xì)胞膜進(jìn)入��,所選擇的有效載荷本質(zhì)上應(yīng)該是親脂性的��,并且可以通過(guò)溶酶體膜到達(dá)目標(biāo)��。
ADC的偶聯(lián)方式
工程化半胱氨酸偶聯(lián):工程化半胱氨偶聯(lián)可以使得細(xì)胞毒性載荷均勻分布在整個(gè)ADC��。IgG類抗體含有8個(gè)半胱氨酸鍵��,可以通過(guò)特異性工程獲得DAR值為2-4的ADC類藥物�。輝瑞等多家公司都使用該技術(shù)作為ADC藥物偶聯(lián)方式。與傳統(tǒng)ADC相比�,這些ADC在臨床前階段顯示出巨大的潛力和耐受性。
糖基化位點(diǎn)修飾偶聯(lián):一般來(lái)說(shuō)�,抗體在Fc區(qū)有一個(gè)糖基化鏈����。N297殘基具有N-糖基化位點(diǎn)����,也是進(jìn)行修飾所關(guān)注的位點(diǎn)��?�;瘜W(xué)氧化�、化學(xué)酶或酶修飾等幾種方法已經(jīng)被用于糖基化位點(diǎn)修飾,從而使得有效載荷高效偶聯(lián)到抗體上�。
酶定向修飾偶聯(lián):酶定向修飾,酶分子通過(guò)作用到特定氨基酸殘疾上����,選擇性地將有效載荷附加到特定位點(diǎn)。例如Redwood開發(fā)了一種SMARTag��,利用甲?�;拾彼嵘擅?formyl glycine- generated enzyme, FGE)將Cys-X-Pro-X-Arg序列插入到抗體中�,導(dǎo)致半胱氨酸被甲酰基甘氨酸取代��。然后,修飾后的單克隆抗體通過(guò)連接特異性結(jié)合到含醛的負(fù)載物上��。
半胱氨酸橋接:半胱氨酸再橋接是一種很有前途的技術(shù)��,可以在不需要對(duì)抗體進(jìn)行任何特異性工程的情況下開發(fā)出均勻穩(wěn)定的ADC�。這些ADC在體外和體內(nèi)模型中均表現(xiàn)出較高的療效,具有較高的結(jié)合能力和血漿穩(wěn)定性����。
ADC當(dāng)前所面臨的挑戰(zhàn)
藥物代謝動(dòng)力學(xué):ADC的藥代動(dòng)力學(xué)特征取決于抗體類型、抗體性質(zhì)(鼠源性�、嵌合性和人源性)和結(jié)合位點(diǎn)。此外����,藥代動(dòng)力學(xué)(PK)特性取決于結(jié)合能、單克隆抗體和細(xì)胞毒載荷����,但主要受單克隆抗體的影響。將ADC應(yīng)用于體循環(huán)之前��,血清中可能存在完整的ADC�、裸抗體、游離形式的細(xì)胞毒載荷����。影響ADC清除率的兩個(gè)主要因素是抗體中細(xì)胞毒性載荷的解偶聯(lián)和通過(guò)FcRn介導(dǎo)的內(nèi)吞清除ADC以進(jìn)行循環(huán)過(guò)程��。此外����,由于再循環(huán)過(guò)程��,裸ADC和完整ADC的半衰期都比游離細(xì)胞毒性載荷長(zhǎng)��。因此�,制作一個(gè)臨床使用的藥代動(dòng)力學(xué)-藥效學(xué)模型(PK/PD)模型仍然具有挑戰(zhàn)性�。
有效載荷的定向釋放:實(shí)體瘤的治療ADC也存在十分高的挑戰(zhàn)。由于ADC的高分子量��,ADC很難滲透到腫瘤部位��。并且高效的細(xì)胞毒性載荷可引起旁觀者效應(yīng)��,并可損害周圍的正常細(xì)胞�。
不良反應(yīng):ADC的抗體可能對(duì)機(jī)體產(chǎn)生免疫原性反應(yīng)。血小板減少����、貧血��、中性粒細(xì)胞減少��、白細(xì)胞減少����、肝毒性是臨床觀察中最常見的毒性����。此外,對(duì)于靶向HER-2特異性ADC的可能存在肺毒性�,如間質(zhì)性肺疾病(ILD)。此外��,在含有大量甘露糖的ADC治療期間����,發(fā)現(xiàn)了會(huì)導(dǎo)致肝毒性。因此����,應(yīng)優(yōu)先選用低甘露糖的ADC,因此�,下一代ADC應(yīng)仔細(xì)優(yōu)化,以開發(fā)出副作用最小的ADC��。
總結(jié)
ADC是一種新興的癌癥治療技術(shù),有潛力克服傳統(tǒng)治療的局限性����。目前市場(chǎng)上可用的ADC是非常有用的治療方法。然而�,ADC的藥理學(xué)非常復(fù)雜,基于抗體的治療也可能有新的毒性��。因此��,設(shè)計(jì)和合成理想的ADC仍然存在一些挑戰(zhàn)��。因此��,深入了解影響抗體藥物偶聯(lián)物(ADC)有效性的因素可以極大地造福該領(lǐng)域的科學(xué)家����。這些知識(shí)可以指導(dǎo)開發(fā)用于醫(yī)療的更好和更有效的ADC��。通過(guò)考慮諸如選擇合適的抗體和藥物成分����、偶聯(lián)方式、穩(wěn)定性以及靶表達(dá)和疾病環(huán)境的影響等因素����,科學(xué)家可以創(chuàng)建最佳設(shè)計(jì)的ADC��,以獲得最大功效��,并為患者提供更多的治療選擇��。
參考文獻(xiàn)
[1]Anupama Samantasinghar, Naina Pullarkat Sunildutt, et al. A comprehensive review of key factors affecting the efficacy of antibody drug conjugate[J] Biomedicine & Pharmacotherapy(2023)
[2]A.Q. Dean, S. Luo, J.D. Twomey, B. Zhang, Targeting cancer with antibody-drug conjugates: promises and challenges, MAbs 13 (1) (2021), https://doi.org/ 10.1080/19420862.2021.1951427.
[3]A. Kopp, G.M. Thurber, Severing ties: quantifying the payload release from antibody drug conjugates, Cell Chem. Biol. 26 (12) (2019) 1631–1633, https:// doi.org/10.1016/j.chembiol.2019.12.001.