抗體藥物偶聯(lián)物(antibody-drug conjugates,ADC)是一類由單克隆抗體和小分子細胞毒性藥物通過連接子偶聯(lián)而成的新型生物治療藥物 �����。與傳統(tǒng)的細胞毒藥物相比��,ADC具有靶向性強�����,毒副作用小等優(yōu)勢����,在臨床上展現較好的治療潛力����。其中,抗體部分通過與腫瘤細胞表面的靶向抗原結合��,精準地將小分子細胞毒性藥物遞送至腫瘤部位��,從而實現腫瘤特異性殺傷效果����。ADC藥物結合了高特異性靶向能力和強效殺傷作用的優(yōu)勢�����,實現了對癌細胞的精準高效殺滅��,已成為抗癌藥物研發(fā)的熱點之一��。
ADC
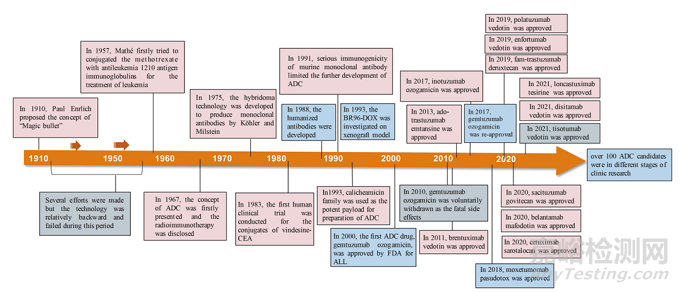
早在 20 世紀初,Paul Ehrlich 就首先提出了“魔法子彈”的概念�����,并假設某些化合物可以直接進入細胞中某些所需的靶點����,從而治愈疾病。從理論上講����,這些化合物應該能有效殺死癌細胞,但對正常細胞無害��。2000年��,美國食品藥品監(jiān)督管理局(FDA)首次批準ADC藥物Mylotarg® (gemtuzumab ozogamicin)用于成人急性髓系白血?���。ˋML)��,標志著ADC靶向治療癌癥時代的開始����。圖1描繪了過去百年ADC藥物從嬰兒階段到成熟發(fā)展階段的標志性事件。隨著靶點和適應癥的不斷擴大��,ADC正在引領癌癥靶向治療的新時代����,未來有望替代傳統(tǒng)化療藥物。
圖1 一個世紀ADC藥物開發(fā)和批準的重要事件的時間表
1��、 ADC藥物的構成
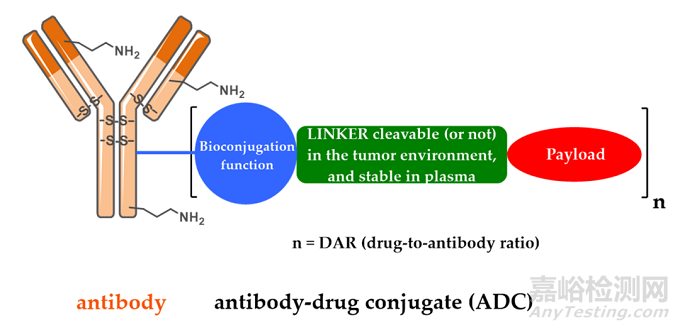
ADC由抗體�����、有效載荷和化學接頭組成��。理想的 ADC 藥物在血液循環(huán)中保持穩(wěn)定�����,精準到達治療目標,并最終在目標附近(例如癌細胞)釋放細胞毒性有效載荷����。每個要素都會影響 ADC 的最終療效和安全性�����,總體而言�����,ADC 開發(fā)需要考慮所有這些關鍵組成部分��,包括靶點����、抗體��、細胞毒有效載荷����、接頭以及偶聯(lián)方法的選擇。
圖2 ADC藥物的結構和特性
2����、ADC的作用機制
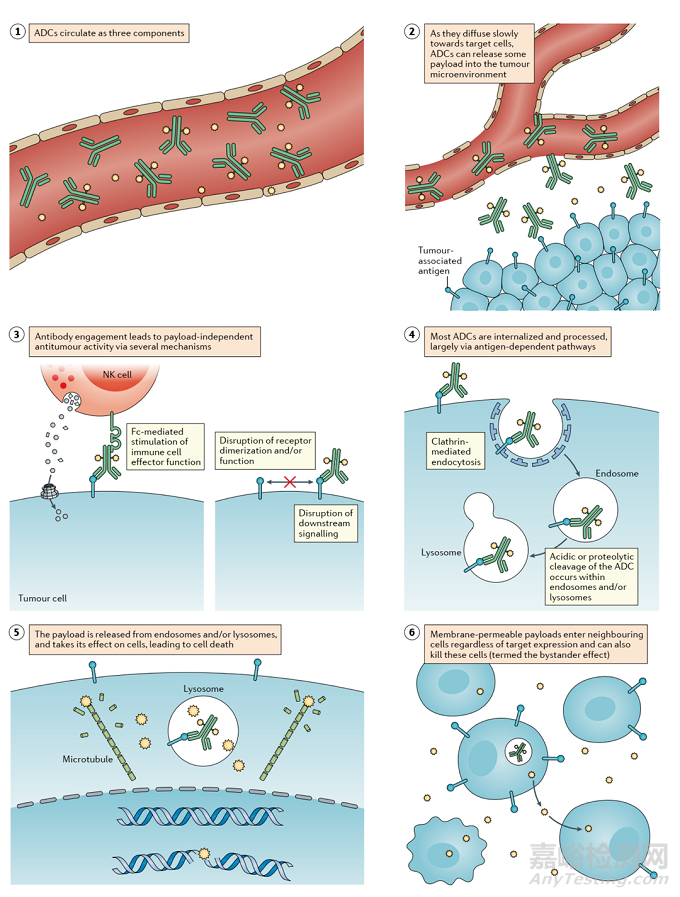
ADC通過組合發(fā)揮“特異性”靶向作用和“高效”殺傷癌細胞的作用����。這類藥物就像精準制導的“生物導彈”��,能夠精準摧毀癌細胞�����,提高治療窗口,減少脫靶副作用�����。
圖 3 ADC殺死癌細胞的作用機制
ADC的抗癌活性還涉及ADCC����、ADCP和CDC的作用��。一些 ADC 的抗體 Fab 片段可以結合病毒感染細胞或腫瘤細胞的抗原表位�����,而 FC 片段結合殺傷細胞(NK 細胞�����、巨噬細胞等)表面的 FCR����,從而介導直接殺傷效果。此外,ADC的抗體成分可以特異性結合癌細胞的表位抗原��,抑制抗原受體的下游信號轉導�����。
3����、ADC的研究進展
從藥物組成和技術特點來看�����,ADC藥物可細分為三代��。早期ADC主要由常規(guī)化療藥物通過不可切割的接頭與小鼠來源的抗體偶聯(lián)而成��。這些 ADC 的效力并不優(yōu)于游離的細胞毒性藥物�����,并且具有很強的免疫原性。后來�����,更有效的細胞毒劑與人源化 mAb 的組合使用極大地提高了療效和安全性,因此第一代 ADCs 獲得了市場批準(包括 gemtuzumabozogamicin 和 inotuzumab ozogamicin)��。
以Brentuximabvedotin 和 Ado-trastuzumab emtansine為代表的第二代 ADC 在優(yōu)化 mAb 同種型�����、有效載荷以及l(fā)inker后獲批�����。這兩種 ADC 使用IgG1 同種型 mAb����,更適合具有小分子有效載荷和高癌細胞靶向能力的生物偶聯(lián)�����。毒性更高的有效載荷�����,提高了水溶性和偶聯(lián)效率。可以將更多有效負載分子加載到每個 mAb 上�����,而不會誘導抗體聚集����。Linker的改進實現了更好的血漿穩(wěn)定性和均勻的 DAR 分布��?����?傮w而言����,這三個要素的改進提高了第二代 ADC 的臨床療效和安全性����。
第三代 ADC 以 polatuzumabvedotin��、enfortumab vedotin����、fam-trastuzumab deruxtecan為代表��。他們具有1)均一 的DAR(2 或 4),顯示出更少的脫靶毒性和更好的藥代動力學效率��;2)完全人源化抗體而不是嵌合抗體來降低免疫原性�����。此外�����,正在開發(fā)抗原結合片段 (Fab) 以替代許多候選 ADC 中的完整 mAb��,因為 Fab 在體循環(huán)中更穩(wěn)定�����,并且可能更容易被癌細胞內化��。此外,已經開發(fā)出更有效的有效載荷:如 PBD��、微管溶素和具有新機制的免疫調節(jié)劑?���?偟膩碚f��,第三代 ADC 具有更低的毒性和更高的抗癌活性以及更高的穩(wěn)定性����,使患者能夠接受更好的抗癌治療�����。
4�����、當前的挑戰(zhàn)及下一代ADC
從已批準藥物和開發(fā)中的候選藥物可以看出�����,新一代 ADC 的特異性和細胞毒性比前幾代產品越來越好����。然而��,在開發(fā)ADC 的過程中仍然存在許多挑戰(zhàn)��, 如復雜的藥代動力學特征��,不可避免的副作用����,腫瘤靶向和有效載荷釋放及耐藥性����。
下一代ADC
1、雙表位或雙靶點ADC
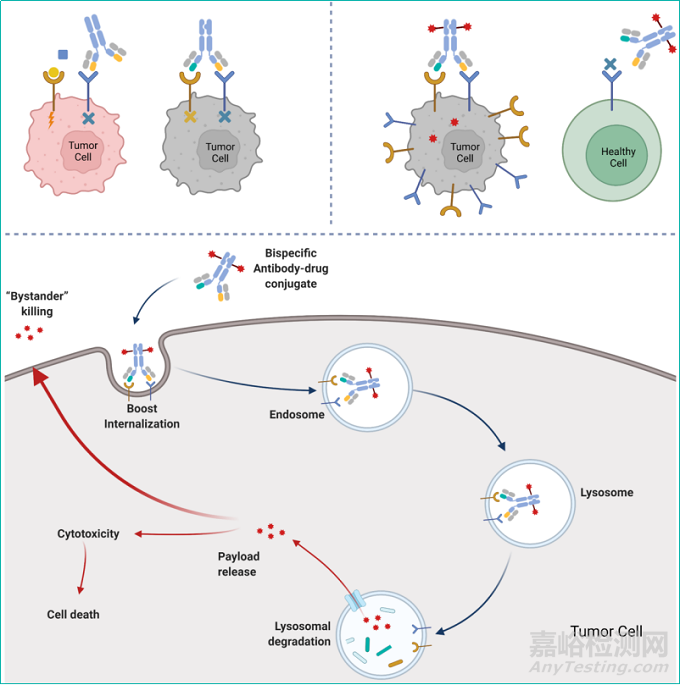
雙特異性抗體技術的進步為ADC創(chuàng)新帶來了更多可能�����。與單抗藥物不同����,雙特異性抗體(雙抗)可以同時識別一個靶點的兩個表位或是兩個不同的靶點����,進而通過多種不同的分子機制產生更好的療效。雙特異性抗體的臨床治療效果優(yōu)于單克隆抗體(monoclonal antibody, MoAbs)�����,廣泛應用于腫瘤免疫治療和其他疾病的治療�����。結合了雙抗和ADC優(yōu)勢的雙抗ADC藥物�����,或將成為一種新的解決ADC藥物現有的內吞、毒性和耐藥問題的有效方案�����。
雙抗ADC藥物�����,是在單抗ADC優(yōu)勢之上再升級的一種嶄新形式:一方面通過雙抗更加特異性地靶向腫瘤細胞�����,增加藥物的安全性����;另一方面通過交聯(lián)作用促進兩個靶點的協(xié)同內吞,在提高毒素進入腫瘤細胞效率的同時��,進一步通過減少受體蛋白在細胞膜上的表達量來抑制腫瘤細胞生長信號��,達到更好的治療效果�����。
圖4.靶向雙TAA靶點的雙抗ADC作用機制
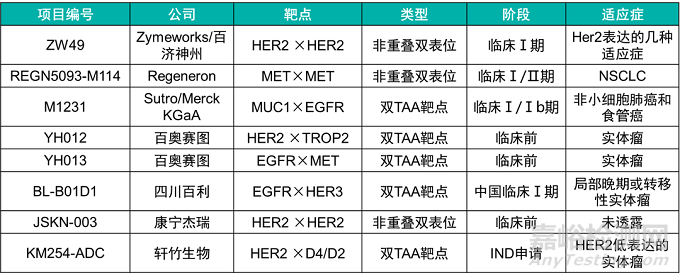
下表整理了目前已知的一些雙抗ADC項目:
其中,ZW-49是由Zymeworks開發(fā)的雙特異性抗體ADC藥物����,可同時特異性結合HER2受體的兩個非重疊表位(ECD4/trastuzumab和ECD2/pertuzumab),該雙特異抗體ADC是在ZW25的基礎上通過蛋白酶切割鏈接子偶聯(lián)Auristatin毒素A��。在臨床前的NHP動物模型中��,該雙抗ADC的最高耐受劑量到達18mg/kg�����。因為該藥物是在雙特異抗體ZW25上的改造�����,因此具有ZW25的多種優(yōu)點�����,如有效地在細胞表面聚集HER2受體并增強HER2內化和下調等��。在臨床前動物模型中,ZW-49可以有效的殺傷HER2中表達和高表達的腫瘤�����,與陽性對照藥物相比����,其更能顯著的延長動物的生存時間及生存幾率��。
圖5. ZW49雙表位ADC結構
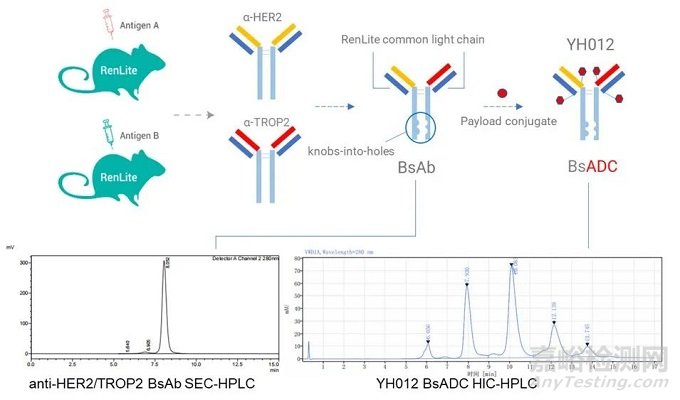
YH012是百奧賽圖利用其RenLite®雙特異抗體平臺上構建的雙靶點ADC(HER2×TROP2)�����,RenLite®利用共同輕鏈的方法防止雙特異抗體輕鏈的錯配�����,同時采用Knob-In-Hole防止抗體重鏈錯配����,可以實現高純度雙特異抗體的生產。在此基礎上����,其利用鏈間半胱氨酸進行偶聯(lián)����,linker為可裂解的二肽VC(valine-citrulline),毒素為MMAE�����。在NCI-N87腫瘤細胞中��,靶向Her2/TROP2的雙抗ADC YH012可以被腫瘤細胞快速內化��,并且其內化效率優(yōu)于單靶點的對照ADC藥物����。在體內模型中,雙抗ADC YH012可以有效的抑制腫瘤細胞的生長����,在療效上優(yōu)于偶聯(lián)相同毒素的單克隆抗體�����,而且優(yōu)于更高劑量的雙抗裸抗��。
圖6. YH012雙靶點ADC結構
雙抗ADC作為一個新的概念�����,目前還處在早期臨床驗證階段,仍需要進一步驗證療效與安全性��,但從藥物研發(fā)的原理以及臨床前的數據來看����,這一類藥物未來的前景仍然值得期待�����。
2、使用兩種不同的有效載荷組合
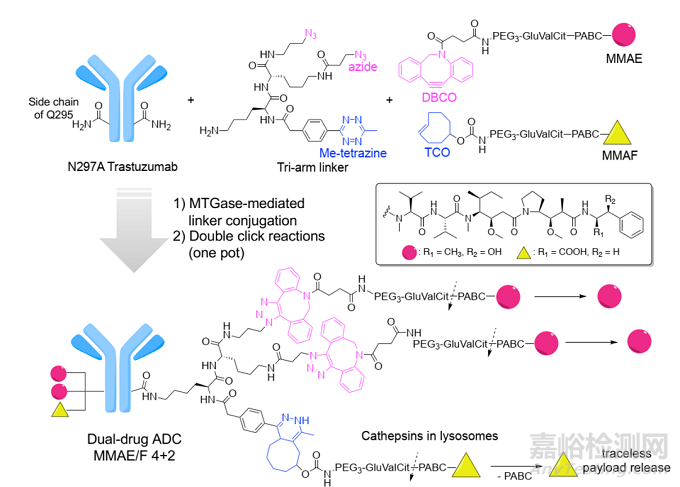
使用兩種不同的細胞毒劑作為有效載荷的雙有效載荷 ADC 以降低耐藥性����。通過準確控制兩種藥物的比例,將兩種協(xié)同有效載荷遞送到癌細胞中��,可以實現更有效的療效�����。并且隨著兩種不同機制的有效載荷的應用�����,耐藥性的發(fā)生率將顯著降低�����。例如��,設計了一種同時包含 MMAE 和 MMAF 的均一的抗 HER2 ADC����,并在異種移植小鼠模型中發(fā)揮了比共同只用相應的單有效載荷 ADC 更顯著的抗腫瘤活性�����。
圖7. 雙藥adc的分子設計和偶聯(lián)策略
3����、多肽偶聯(lián)物(PDC)
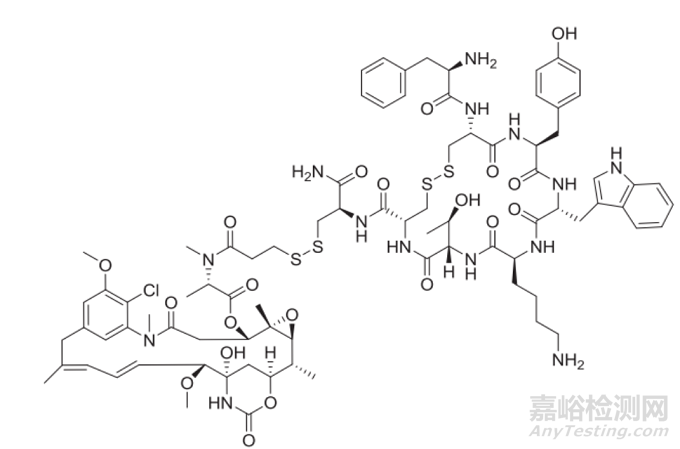
另一種ADC發(fā)展策略是摒棄mAb的傳統(tǒng)結構����,選擇將payload與分子量較小的多肽片段偶聯(lián)。這些策略的主要目的是降低 ADC 的分子量��,從而提高穿透效率和有效載荷向腫瘤組織的傳遞�����。例如,PEN-221是一種 ADC��,由 DM-1 與靶向生長抑素受體 2 的多肽鏈結合而成����。其分子量僅為 2 kDa,遠低于傳統(tǒng) ADC 中 150 kDa 的 IgG 分子��。目前此類 ADC 面臨的技術挑戰(zhàn)是它們可能會在血漿中快速清除�����。然而��,如果我們能夠克服這一障礙��,它在治療難以接近的腫瘤方面具有潛力�����,包括血管神經支配不良的腫瘤和中樞神經系統(tǒng)腫瘤����。
圖8. PEN-221微型藥物結合物
4����、開發(fā)非內化
ADC 傳統(tǒng)上��,為了將有效載荷輸送到癌細胞中,ADC 需要高內化能力的 mAb�����。然而��,由于抗原屏障����,mAb 通常難以擴散到實體瘤塊中�����。因此��,可以為 ADC 開發(fā)非內化抗體�����。它是基于有效載荷在腫瘤微環(huán)境中在還原條件下直接釋放到細胞外�����,然后擴散到癌細胞內部導致細胞死亡的原理��。最后����,在有效載荷選擇方面仍有很多創(chuàng)新機會�����。
總結
目前已成功開發(fā)出多種 ADC 療法����,使數以萬計的癌癥患者受益��。14 種上市的ADC藥物以及多種 ADC優(yōu)異的臨床表現也引起了人們對該領域的更多關注�����,這對于這個相對年輕但高度復雜的領域來說非常重要����。隨著這些領域研究人員的不斷努力��,不難想象未來的ADC將在癌癥靶向治療中展現出更多的驚喜。
參考資料:
[1] [1] Fu Z , Li S , Han S , et al. Antibody drug conjugate:the"biological missile"for targeted cancer therapy[J]. 信號轉導與靶向治療(英文), 2022, 7(4):25.
[2] Drago J Z , Modi S , Chandarlapaty S . Unlocking the potential of antibody-drug conjugates for cancer therapy[J]. Nature reviews. Clinical oncology.
[3] Hamilton G S. Antibody-drug conjugates for cancer therapy: The technological and regulatory challenges of developing drug-biologic hybrids[J]. Biologicals, 2015, 43(5):318-332.
[4] You G, Won J, Lee Y, et al. Bispecific Antibodies: A Smart Arsenal for Cancer Immunotherapies.[J]. Multidisciplinary Digital Publishing Institute, 2021(7).
[5] Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of antibody-drug conjugates. [J]. Nature Reviews Drug Discovery, 2017, 16(5):315-337.
[6] Tarantino P, Pestana R C, Corti C , et al. Antibody-drug conjugates: Smart chemotherapy delivery across tumor histologies[J]. CA: a cancer journal for clinicians.