眾所周知制藥企業(yè)的驗(yàn)證管理體系很重要,驗(yàn)證管理工作是實(shí)施藥品GMP的重要基礎(chǔ)���,也是制藥企業(yè)貫徹采用質(zhì)量管理體系的重要組成部分��,企業(yè)要建立一個(gè)優(yōu)秀的驗(yàn)證管理體系不是一件容易的事�����,可能需要企業(yè)各個(gè)部門付出長(zhǎng)期的努力來(lái)完成�����。作為驗(yàn)證管理工作者了解驗(yàn)證概念的來(lái)龍去脈�����,對(duì)于理解驗(yàn)證的真正內(nèi)涵并切實(shí)做好藥品生產(chǎn)驗(yàn)證工作十分有益���。
1976年6月1日���,F(xiàn)DA發(fā)布了《大容量注射劑GMP規(guī)程(草案)》,該政策中��,在制藥界首次提出驗(yàn)證的概念和要求���,明確以“通過(guò)驗(yàn)證確立控制生產(chǎn)過(guò)程的運(yùn)行標(biāo)淮���,通過(guò)對(duì)已驗(yàn)證狀態(tài)的監(jiān)控��,控制整個(gè)工藝過(guò)程�����,確保質(zhì)量”為指導(dǎo)思想�����,強(qiáng)化生產(chǎn)的全過(guò)程控制��,進(jìn)一步規(guī)范企業(yè)的生產(chǎn)及質(zhì)量管理實(shí)踐�����。
2��、驗(yàn)證概念在我國(guó)制藥界的提出
雖然驗(yàn)證在藥品生產(chǎn)管理中地位重要�����,但是由于我國(guó)規(guī)范化工作起步較晚�����,發(fā)展時(shí)間相對(duì)較短�����。我國(guó)《藥品生產(chǎn)質(zhì)量管理規(guī)范》(1998年修訂)于1999年3月18日經(jīng)國(guó)家藥品監(jiān)督管理局局務(wù)會(huì)審議通過(guò)�����,現(xiàn)予發(fā)布���。本規(guī)范自1999年8月1日起施行,以第七章整篇的篇幅闡述了驗(yàn)證的要求�����,其內(nèi)容與WHO GMP指南一致�����,但增加了驗(yàn)證不同階段的工作內(nèi)容��、驗(yàn)證的組織及實(shí)施��、文檔管理等方面的條款。在第十四章第八十五條將驗(yàn)證界定為“證明任何程序��、生產(chǎn)過(guò)程���、設(shè)備�����、物料�����、活動(dòng)或系統(tǒng)確實(shí)能導(dǎo)致預(yù)期結(jié)果的有文件證明的一系列活動(dòng)”���。可見(jiàn)���,驗(yàn)證是藥品生產(chǎn)及質(zhì)量管理中一個(gè)全方位的質(zhì)量活動(dòng)���,它是實(shí)施GMP的基礎(chǔ)。
3��、我國(guó)首部驗(yàn)證指南
2003年07月,國(guó)家食品藥品監(jiān)督管理局藥品安全監(jiān)管司��,國(guó)家食品藥品監(jiān)督管理局藥品認(rèn)證管理中心組織有關(guān)部門通過(guò)化學(xué)工業(yè)出版社出版了《藥品生產(chǎn)驗(yàn)證指南》���,很經(jīng)典的一本驗(yàn)證工具書,值得從事驗(yàn)證管理人員參考�����,但已經(jīng)出版了20年了�����,2003版有些驗(yàn)證理念已經(jīng)過(guò)時(shí)���,結(jié)合新的規(guī)范使用���。
4、將確認(rèn)和驗(yàn)證貫穿產(chǎn)品生命周期全過(guò)程——2010年修訂版GMP
《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)》(衛(wèi)生部令第79號(hào))由衛(wèi)生部發(fā)布��,自2011年3月1日起施行���。將確認(rèn)和驗(yàn)證貫穿產(chǎn)品生命周期全過(guò)程���,在2010年版的藥品生產(chǎn)質(zhì)量管理規(guī)范中��,用了一章十二條對(duì)確認(rèn)和驗(yàn)證進(jìn)行了規(guī)定��。目前在藥品生產(chǎn)質(zhì)量管理規(guī)范中�����,對(duì)工藝�����、無(wú)菌等驗(yàn)證均進(jìn)行了系統(tǒng)規(guī)定���,并對(duì)需要進(jìn)行驗(yàn)證的條件進(jìn)行了釋義,如:處方工藝發(fā)生變更��、無(wú)菌過(guò)濾等��,并規(guī)定了企業(yè)驗(yàn)證時(shí)應(yīng)當(dāng)制定驗(yàn)證計(jì)劃�����,并根據(jù)實(shí)際情況采取前驗(yàn)證��、同步驗(yàn)證、回顧性驗(yàn)證和再驗(yàn)證等驗(yàn)證方式�����。
5��、我國(guó)首部GMP附錄《確認(rèn)與驗(yàn)證》
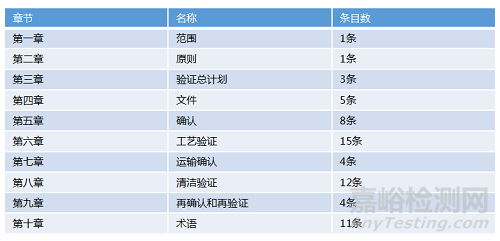
2015年5月26日���,國(guó)家食品藥品監(jiān)督管理總局根據(jù)《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)》第三百一十條規(guī)定,發(fā)布《確認(rèn)與驗(yàn)證》附錄���,作為《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)》配套文件�����,自2015年12月1日起施行�����。顯示了中國(guó)正在通過(guò)法規(guī)拉近中國(guó)制藥企業(yè)同歐美等發(fā)達(dá)地區(qū)的差距���,給予驗(yàn)證管理工作組織實(shí)施驗(yàn)證提供了很好的指導(dǎo),值得認(rèn)真研究和組織執(zhí)行��。明確適用范圍是“藥品生產(chǎn)質(zhì)量管理過(guò)程中”的所有確認(rèn)與驗(yàn)證活動(dòng),也就是說(shuō)包含了2010版新版GMP第七章《確認(rèn)與驗(yàn)證》中提及的“廠房��、設(shè)施�����、設(shè)備��、檢驗(yàn)儀器���、生產(chǎn)工藝�����、操作規(guī)程和檢驗(yàn)方法”等確認(rèn)與驗(yàn)證活動(dòng)��。并提到“確認(rèn)和驗(yàn)證的范圍和程度應(yīng)根據(jù)風(fēng)險(xiǎn)評(píng)估的結(jié)果確認(rèn)”�����,藥企應(yīng)重點(diǎn)關(guān)注 “確認(rèn)與驗(yàn)證應(yīng)當(dāng)貫穿于產(chǎn)品生命周期的全過(guò)程”的要求��。企業(yè)在執(zhí)行時(shí)��,可分別考慮各系統(tǒng)生命周期中的確認(rèn)和驗(yàn)證活動(dòng)�����,如設(shè)備確認(rèn)���、公用工程驗(yàn)證�����、工藝驗(yàn)證�����、清潔驗(yàn)證等。GMP附錄《確認(rèn)與驗(yàn)證》章節(jié)及條款如下表所示:
6�����、我國(guó)藥品流通領(lǐng)域首次引入驗(yàn)證管理——GSP附錄《驗(yàn)證管理》
GSP是Good Supply Practice的英文縮寫�����,意即良好供應(yīng)規(guī)范�����。2013年10月23日,國(guó)家食品藥品監(jiān)督管理總局根據(jù)《藥品經(jīng)營(yíng)質(zhì)量管理規(guī)范》第一百八十三條規(guī)定���,現(xiàn)發(fā)布冷藏�����、冷凍藥品的儲(chǔ)存與運(yùn)輸管理���,藥品經(jīng)營(yíng)企業(yè)計(jì)算機(jī)系統(tǒng),溫濕度自動(dòng)監(jiān)測(cè)�����,藥品收貨與驗(yàn)收和驗(yàn)證管理等5個(gè)附錄���,作為《藥品經(jīng)營(yíng)質(zhì)量管理規(guī)范》配套文件���。藥品儲(chǔ)運(yùn)冷鏈驗(yàn)證已經(jīng)是國(guó)際上通行并成熟應(yīng)用的強(qiáng)制管理標(biāo)準(zhǔn),也是冷鏈藥品儲(chǔ)運(yùn)質(zhì)量管理的前提條件和基本保障�����,但在我國(guó)藥品流通領(lǐng)域卻是第一次引入�����。附錄《驗(yàn)證管理》共12條,對(duì)于驗(yàn)證的范圍���、參數(shù)標(biāo)準(zhǔn)���、設(shè)備條件、實(shí)施項(xiàng)目���、具體操作��、數(shù)據(jù)分析�����、偏差處理及風(fēng)險(xiǎn)控制、質(zhì)量控制文件編制��、驗(yàn)證結(jié)果應(yīng)用等都進(jìn)行了具體規(guī)定�����。對(duì)于我國(guó)的藥品經(jīng)營(yíng)企業(yè)來(lái)說(shuō)�����,驗(yàn)證是一項(xiàng)全新的工作。該附錄詳細(xì)地提出了驗(yàn)證方案的制定�����,驗(yàn)證項(xiàng)目的確定�����,驗(yàn)證方案的實(shí)施等內(nèi)容�����,并具體明確了冷庫(kù)�����、冷藏車��、冷藏箱(保溫箱)和溫濕度自動(dòng)監(jiān)測(cè)系統(tǒng)的驗(yàn)證項(xiàng)目���。
參考文獻(xiàn)
[1] www.nmpa.gov.cn及其直屬單位等官網(wǎng)