今日頭條
南京圣和口服丙肝新藥獲批上市���。圣和藥業(yè)1類新藥奧磷布韋片獲國家藥監(jiān)局批準上市����,用于與鹽酸達拉他韋聯(lián)用�����,治療初治或干擾素經(jīng)治的基因1�、2����、3����、6型成人慢性丙型肝炎病毒(HCV)感染��,可合并或不合并代償性肝硬化�。奧磷布韋是一款HCV NS5B聚合酶抑制劑。在一項Ⅲ期臨床研究中���,該藥聯(lián)合鹽酸達拉他韋片治療慢性丙肝成人患者的病毒學(xué)治愈率達98.5%�。
國內(nèi)藥訊
1.博銳CD20單抗獲批上市�。博銳生物新型抗CD20單抗澤貝妥單抗注射液(HS006)獲國家藥監(jiān)局批準上市,與標準CHOP化療(環(huán)磷酰胺���、阿霉素����、長春新堿�����、潑尼松)聯(lián)合治療�,用于CD20陽性彌漫大B細胞淋巴瘤��,非特指性(DLBCL����,NOS)成人患者���。在III期臨床中��,HS006聯(lián)合CHOP方案治療DLBCL初治患者在ORR上非劣效于R-CHOP�;1年P(guān)FS和OS呈現(xiàn)出顯著優(yōu)于美羅華組的趨勢����。
2.先聲/凌科JAK1抑制劑II期研究積極。先聲藥業(yè)與凌科藥業(yè)聯(lián)合開發(fā)的JAK1抑制劑LNK01001治療類風(fēng)濕關(guān)節(jié)炎的II期臨床達到主要終點及關(guān)鍵次要終點��。與安慰劑相比��,LNK01001兩個劑量治療組患者12周后病情顯著改善���,兩個劑量組有超過90%的患者產(chǎn)生ACR20應(yīng)答,并維持長達24周��。藥物整體耐受性良好��,絕大部分治療期出現(xiàn)的不良事件嚴重程度較輕,試驗藥物組均未發(fā)生嚴重不良事件�����。
3.恒瑞兩款1類新藥獲批臨床��。恒瑞醫(yī)藥宣布旗下1類化藥SHR0302口服溶液以及1類生物藥SHR-2017注射液已分別獲得國家藥監(jiān)局臨床默示許可��。SHR0302是一種高選擇性的JAK1抑制劑��,可通過抑制JAK1信號傳導(dǎo)發(fā)揮抗炎和抑制免疫的生物學(xué)效應(yīng)��,擬開發(fā)用于移植物抗宿主病的治療��。SHR-2017是一款雙特異性抗體藥物,擬用于治療實體腫瘤骨轉(zhuǎn)移患者和多發(fā)性骨髓瘤患者中骨相關(guān)事件的預(yù)防�����。
4.中生康元DC腫瘤疫苗獲批臨床���。中生康元1類治療用生物制品“個性化樹突狀細胞注射液”獲國家藥監(jiān)局臨床試驗?zāi)驹S可��,擬開發(fā)用于治療惡性實體腫瘤����。在臨床前研究中,這款DC治療性腫瘤疫苗已顯示出良好的安全性和初步的有效性���;與其他癌癥治療方法聯(lián)用��,也能有效克服腫瘤微環(huán)境下的免疫抑制��、強化抗原遞呈��,增長綜合療效��。
5.博奧明賽吸入式納米雙抗獲新冠臨床�。博奧明賽生物開發(fā)的廣譜����、吸入式納米雙抗BM219 (UDAB-M)獲國家藥監(jiān)局臨床默示許可,擬開發(fā)用于新冠病毒感染的治療及暴露后預(yù)防���。BM219同時靶向病毒刺突蛋白上兩個不同的保守表位�����,能夠高效中和包括奧米克戎最新變異株在內(nèi)的現(xiàn)有所有流行變異株。雙抗兩端的n3113v和n3130v可同時結(jié)合于同一個RBD(受體結(jié)合域)上并具有顯著協(xié)同作用���。
6.拓領(lǐng)博泰小分子自免新藥獲批臨床�����。北京拓領(lǐng)博泰宣布其開發(fā)的1.1類小分子新藥TollB-001片已在美國獲得FDA臨床默示許可����,擬用于類風(fēng)濕性關(guān)節(jié)炎等自身免疫疾病的治療��。TollB-001具有全新作用機理����,已在臨床前研究中顯示出優(yōu)于臨床一線用藥的藥效和安全性,并具有針對性地解決或改善類風(fēng)濕性關(guān)節(jié)炎現(xiàn)有治療藥物局限性的潛力�。今年4月,CDE已受理該新藥的臨床試驗申請�����。
7.阿斯利康CD3/CLDN 18.2雙抗中國報IND�����。阿斯利康以3.5億美元從和鉑醫(yī)藥引進的CD3/CLDN 18.2雙抗AZD5863(HBM7022)的臨床試驗申請獲CDE受理。HBM7022是一款全人源雙特異性抗體��,其采用二價高親和力抗CLDN 18.2和單價低親和力抗CD3的結(jié)構(gòu),在保證高殺傷活性的同時,降低了產(chǎn)生細胞因子風(fēng)暴的風(fēng)險��。臨床前研究顯示�����,AZD5863不但對CLDN 18.2陽性的胃癌有顯著效用�����,還對胰腺癌和CLDN 18.2突變的胃癌有很好的效用���。
國際藥訊
1.脊柱側(cè)彎矯正醫(yī)療器械獲FDA批準上市。Globus Medical公司REFLECT脊柱側(cè)凸矯正系統(tǒng)獲FDA批準上市����,旨在矯正年輕患者的進行性脊柱側(cè)凸��,同時可使患者保持運動自由��。與用于脊柱融合手術(shù)的剛性金屬棒不同��,REFLECT使用一種靈活���、耐用的繩索來利用患者先天生長的力量進行矯正����。柔軟的繩索在凸側(cè)拉緊以控制曲線,同時允許凹側(cè)生長���。此外,該植入物可以通過肋骨之間的幾個小切口采用微創(chuàng)方法插入����。
2.首款罕見皮膚病HSV基因療法將獲批上市����。Krystal Biotech公司擬用于治療營養(yǎng)不良性大皰性表皮松解癥的基因療法B-VEC(beremagene geperpavec)生物制品許可申請將于5月19日迎來FDA的最終監(jiān)管審查結(jié)果����。B-VEC利用基因工程改造的HSV-1病毒載體,將兩個具備正常功能的COL7A1基因拷貝直接遞送至患者的皮膚細胞中��。在關(guān)鍵GEM-3臨床中,B-VEC治療組6個月時患者傷口完全愈合的比例高于安慰劑組(67%vs22%��,p<0.005)����。
3.Oramed公司將繼續(xù)開發(fā)口服胰島素。Oramed公司口服胰島素膠囊ORMD-0801(8mg)在治療2型糖尿病(T2DM)的III期ORA-D-013-1研究未能顯著改善患者的血糖控制��。但是針對特定參數(shù)(如BMI��、基線HbA1c水平�、年齡��、性別和體重)分組的亞組患者的糖化血紅蛋白(HbA1c)水平較安慰劑降幅超過1%,其中54歲以上且BMI<31kg/m2的患者HbA1c降幅最大(P<0.002)����;在產(chǎn)生應(yīng)答的患者中,基線BMI對ORMD-0801的效果有顯著影響�����,與中國III期研究的積極數(shù)據(jù)一致����。該公司表示將進一步推進ORMD-0801臨床證據(jù)的挖掘和探索。
4.TRβ激動劑NASH IIb期臨床積極����。Viking公司肝靶向性甲狀腺激素受體β(THR-β)激動劑VK2809治療非酒精性脂肪肝炎(NASH)的IIb期Voyage研究達到主要終點��。與安慰劑組相比�,VK2809兩個劑量組患者的中位肝臟脂肪含量均顯著降低(-37.5%~-55.1%vs-5.4%;-36.8%~-51.7%vs-3.7%)��;VK2809組肝臟脂肪含量至少降低30%的患者比例最高達84.9%�。藥物治療相關(guān)不良事件(TRAE)的嚴重程度大多(94%)為輕中度�。
5.BI引進抗纖維化FIC抗體上Ⅰ期臨床�。勃林格殷格翰從Enleofen公司引進的同類首創(chuàng)白介素-11(IL-11)抑制劑BI 765423日前啟動一項Ⅰ期臨床(NCT05658107)���,擬評估用于健康受試者的安全性、耐受性和藥代動力學(xué)�����。IL-11通路在多個器官的纖維化中起著關(guān)鍵性作用�,臨床前研究表明,抗IL-11治療有可能在不同的纖維化疾病中阻斷甚至逆轉(zhuǎn)纖維化����。
6.FTC起訴安進收購Horizon。美國聯(lián)邦貿(mào)易委員會(FTC)對安進提起訴訟�,認為該公司收購Horizon的交易存在壟斷市場的嫌疑且未來可能會進行捆綁銷售(提供多產(chǎn)品折扣)。去年年底����,安進宣布旗下公司Pillartree Limited已與Horizon Therapeutics公司達成協(xié)議��,將斥資約280億美元收購Horizon公司�。Horizon的核心產(chǎn)品主要包括用于治療甲狀腺眼病的IGF-1R單抗Tepezza和治療慢性痛風(fēng)的Krystexxa,治療視神經(jīng)和脊髓炎癥的Uplizna����,以及治療罕見遺傳疾病尿素循環(huán)紊亂的Ravicti�����。
醫(yī)藥熱點
1.北京20家醫(yī)療機構(gòu)向護理轉(zhuǎn)型����。近日��,《北京市衛(wèi)生健康委員會關(guān)于做好安寧療護中心和老年護理中心轉(zhuǎn)型建設(shè)工作的通知》發(fā)布����。《通知》明確����,轉(zhuǎn)型建設(shè)工作已納入2023年北京市政府民生實事項目,20家醫(yī)療機構(gòu)將轉(zhuǎn)型為安寧療護中心和老年護理中心�����。各轉(zhuǎn)型機構(gòu)將于2023年10月底之前完成轉(zhuǎn)型建設(shè)工作并接收患者。
2.AI呼氣測定儀可實時“嗅出”新冠��。美國科羅拉多州立大學(xué)博爾德分校和美國國家標準與技術(shù)研究院研究人員聯(lián)合開發(fā)出一種由人工智能(AI)驅(qū)動的新型激光呼氣測定儀����,能以極高的精度實時檢測出新冠病毒感染。研究結(jié)果發(fā)表在近期《呼吸研究學(xué)報》上���。研究結(jié)果表明��,呼氣分析有望成為新冠感染的一種替代���、快速、非侵入性的檢測方法��。目前����,研究人員正在努力將新開發(fā)的系統(tǒng)微型化到芯片規(guī)模,從而實現(xiàn)實時�����、自主的健康監(jiān)測���。
3.全國87.7%縣醫(yī)院達到二級醫(yī)院標準����。國家衛(wèi)健委近日公布2021至2022年度縣醫(yī)院醫(yī)療服務(wù)能力評估情況����,我國縣醫(yī)院診療能力進一步增強,截至2022年87.71%的縣醫(yī)院達到二級醫(yī)院標準����,超過97.49%的縣醫(yī)院能夠?qū)嵤┬呐K驟停、心源性休克�、急性心功能不全、高血壓危象等急危重癥的急診規(guī)范處置����,超過95.79%的縣醫(yī)院能夠?qū)嵤┬乃ァ⒛I衰和呼吸衰竭的診斷與急救�。
評審動態(tài)
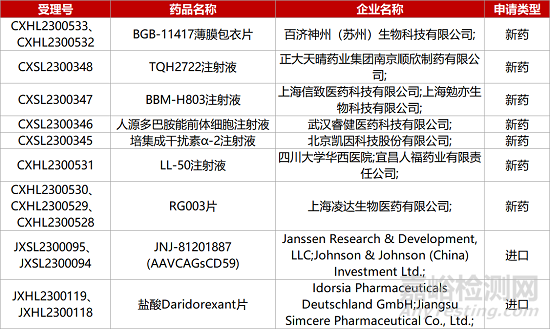
1. CDE新藥受理情況(05月17日)
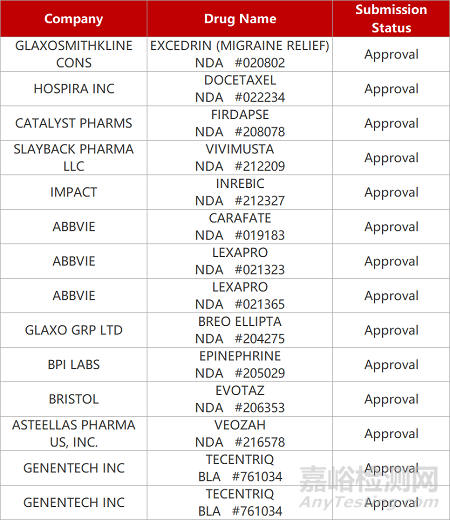
2. FDA新藥獲批情況(北美05月15日)