原料藥雜質(zhì)在USP中定義為任何不同于原料藥結構的物質(zhì),在中國藥典中為任何影響藥品純度的物質(zhì)�����。ICH Q3A將原料藥中雜質(zhì)分為有機雜質(zhì)��,無機雜質(zhì)雜和殘留溶劑�����。原料藥中有機雜質(zhì)來源于合成工藝相關的雜質(zhì)及儲存過程中產(chǎn)生的雜質(zhì)�����。有機雜質(zhì)的控制對于藥物的安全性和有效性有著重要的意義�����。
一��、關于法規(guī)
雜質(zhì)研究與控制是藥物研究中的一項系統(tǒng)工程,CTD申報資料中與雜質(zhì)相關的章節(jié)體現(xiàn)了雜質(zhì)控制和終點控制相結合的策略����,符合藥品質(zhì)量研究中全面系統(tǒng)的質(zhì)量控制理念。
原料藥申報資料中涉及到雜質(zhì)研究與控制的內(nèi)容有八個模塊小節(jié):3.2.S.2.3生產(chǎn)信息中的物料控制�����,3.2.S.2.4關鍵步驟和中間體的控制����,3.2.S.3.2特性鑒中的雜質(zhì)譜分析,3.2.S.4.1原料藥質(zhì)量控制中的質(zhì)量標準����,3.2.S.4.2分析方法,3.2.S.4.3分析方法驗證�����,3.2.S.4.4批檢驗報告和3.2.S.4.5質(zhì)量標準制定依據(jù)等章節(jié)����。
申報資料的撰寫應高度關注雜質(zhì)分析與控制的系統(tǒng)性和法規(guī)對于雜質(zhì)控制的要求��。
ICHQ3A指南針對的是新原料藥中雜質(zhì)的研究與控制,雜質(zhì)的研究范圍是與工藝相關及原料藥降解的有機雜質(zhì)�����。對于無機雜質(zhì)����、殘留溶劑和元素雜質(zhì)的研究與控制在ICH中其它的相關指南有詳細敘述。
ICHQ3A指南中的雜質(zhì)不包含原料藥中外來污染物質(zhì)�����、多晶形物質(zhì)及立體異構體����。對于原料藥中基因毒性雜質(zhì)的控制ICH Q3A不再適用,由ICH M7指南補充指導��。
USP通則<1086, 原料藥和制劑雜質(zhì)>的內(nèi)容是原料藥和制劑中雜質(zhì)的研究與控制指南����。原料藥中雜質(zhì)指的是與工藝相關及原料藥降解的有機雜質(zhì)。
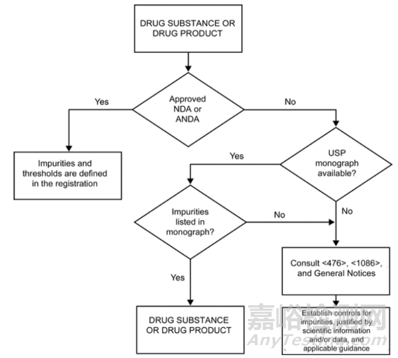
USP在2017年新建立了一個通則<476, 原料藥與制劑的雜質(zhì)控制>����,主要內(nèi)容是藥典各論中已有的原料藥與制劑中雜質(zhì)分析測試與控制��,提出了有機雜質(zhì)控制決策樹����,如下圖�����,具體內(nèi)容可參考PF43(6)��。
圖1:原料藥和制劑中有機雜質(zhì)控制決策樹
二����、關于原料藥不同階段的雜質(zhì)控制
從藥品研發(fā)至產(chǎn)品上市通常需要經(jīng)歷較長的時間,不同研發(fā)階段的關注點不同�����。各階段開展雜質(zhì)研究的首要任務是患者的安全��,根據(jù)擬定的治療適應癥����、劑型、給藥途徑�����、給藥持續(xù)時間和患者人群�����,雜質(zhì)研究根據(jù)具體情況����,具體分析。
成本是階段性雜質(zhì)研究的主要考慮因素之一����。早期臨床研發(fā)階段需重點研究原料藥中最有可能存在和已經(jīng)存在于的有機雜質(zhì)。
原料藥合成過程中使用的起始物料��、中間體����、試劑、催化劑和溶劑均是明顯的潛在雜質(zhì)��。合成工藝中距離終產(chǎn)品原料藥的反應步驟是與潛在雜質(zhì)被清除的可能性相關����。最后一步反應的中間體����、試劑和溶劑等��,以及可預測的副產(chǎn)物和主要降解產(chǎn)物是這個階段雜質(zhì)研究的重點�����。
在臨床III期及后面的階段����,待商業(yè)化合成路線確定后,需要深入研究各步驟中潛在的雜質(zhì)��,開展雜質(zhì)清除和衍生化研究�����,以確定合成工藝控制的關鍵點��。隨著藥物臨床的進展��,收集更多的批次雜質(zhì)數(shù)據(jù)和穩(wěn)定性數(shù)據(jù)�����,未知雜質(zhì)的結構需要鑒定,必要時開發(fā)補充分析方以確認潛在雜質(zhì)的存在與否��。
對于遺傳毒性雜質(zhì)����,ICH M7提供了具體的指導��。由于起始物料中的雜質(zhì)可能影響到最終產(chǎn)品中的雜質(zhì)控制����,越接近最后產(chǎn)品合成步驟的起始物料,引入雜質(zhì)的風險越高����,因此對雜質(zhì)研究和控制的要求也越高。起始物料中雜質(zhì)控制策略在FDA與制藥企業(yè)在II 期會議中常討論的話題����。ICH Q11指南闡述了起始物料控制,包括雜質(zhì)控制及物料選擇的合理性����。
工藝雜質(zhì)的研究方式有“正推”和“逆推”兩種��。“正推”就是從原料開始追蹤每一步反應����,把每一步反應研究清楚����,說明雜質(zhì)的來源。“逆推”顧名思義是從產(chǎn)品開始向起始物料找到雜質(zhì)的來源����。“正推”方法能更清楚每一步反應的主副反應機理,對于雜質(zhì)的來源會更加明確�����,從而優(yōu)化工藝參數(shù)��,確定關鍵工藝參數(shù)�����。
原料藥中的降解雜質(zhì)是原料藥在儲存或穩(wěn)定性研究過程中產(chǎn)生的雜質(zhì)��。降解雜質(zhì)可以通過強制降解和影響因素實驗研究獲得����。強制降解和影響因素條件與正常存放的情況有較大的不同��,影響因素一般考察溫度�����、濕度�����、光度、空氣暴露等對產(chǎn)品質(zhì)量的影響����。
三、關于雜質(zhì)研究中的分析方法技術
通常說的雜質(zhì)譜包括藥物中雜質(zhì)的種類����、含量、來源及結構等信息����。通過雜質(zhì)譜分析能較為全面的掌握產(chǎn)品中雜質(zhì)的概況。原料藥中雜質(zhì)譜的研究需要有針對性地選擇合適的分析方法��,確保雜質(zhì)的有效檢出、定量和確認��。
在新藥研究早期��,會選擇與MS兼容的分析方法����,有利于收集雜質(zhì)的MS信息。后期根據(jù)需要調(diào)整適用于雜質(zhì)屬性的方法�����。
對于藥典各論中雜質(zhì)控制����,通常通過標準品進行定量與定性;如果沒有標準品����,則用RRT和RRF來進行定性和定量。藥典收載的一些雜質(zhì)分析方法比較落后�����,專屬性較差����。在進行仿制藥研究時需要更新這類分析方法��,開發(fā)那些具有專屬性的色譜或光譜方法進行雜質(zhì)控制研究�����。
面對雜質(zhì)的微量和復雜性�����,檢測方法的專屬性����、靈敏度和準確度十分關鍵����。當原料藥中不同雜質(zhì)不能同時被一種方法檢測時�����,應考慮開發(fā)不同分析方法��,分別進行檢測��。雜質(zhì)分析方法的對象是各個潛在的雜質(zhì),因此分析方法的驗證需要根據(jù)不同雜質(zhì)的特點綜合設計驗證方案����,進行有針對性的規(guī)范驗證。
采用HPLC-UV/GM-FID方法可以滿足大部分雜質(zhì)分析與控制的要求�����。對于微量和極微量的毒性雜質(zhì)和基因毒性雜質(zhì)��,采用靈敏度更高的LC-MS/MS方法顯得尤為重要�����。采用MS技術可以對原料藥中的工藝雜質(zhì)和降解雜質(zhì)等成分進行結構特征的分析����,有助于藥品中降解途徑規(guī)律的探討。
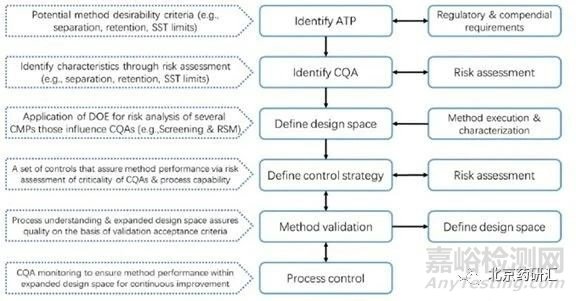
在整個藥品生命周期的雜質(zhì)譜控制過程中����,保證分析方法有良好的專屬性和敏感性顯得尤為重要?���;赒bD理念開發(fā)分析方法����,設計方案篩選關鍵影響因子����,建立定量關系模型確定分析方法的操作空間,如下圖所示�����。
圖2:基于QbD理念的分析色譜方法開發(fā)
四����、關于雜質(zhì)限度制定
雜質(zhì)的定量分析與分析方法的檢測限與定量限相關,因此雜質(zhì)的分析方法需要經(jīng)過驗證��,包括檢測限與定量限的確定��。
創(chuàng)新藥雜質(zhì)限度的確定需要綜合藥物��、藥理毒理和臨床研究結果綜合判定��。在制訂質(zhì)量標準中雜質(zhì)限度時����,安全性是首要考慮因素,其實是大生產(chǎn)和中試批次數(shù)據(jù)����、穩(wěn)定性數(shù)和工藝數(shù)據(jù)。如果雜質(zhì)是藥物在人體中的主要代謝產(chǎn)物����,則不考慮其安全性。創(chuàng)新藥研發(fā)早期��,原料藥中設定的雜質(zhì)限度不能高于毒理數(shù)據(jù)支持的限度水平�����,同時兼顧考慮生產(chǎn)的可行性和分析方法的波動性��。
隨著臨床的研究進展��,收集藥品的臨床前和臨床安全性數(shù)據(jù)以支持雜質(zhì)限度的進一步優(yōu)化�����。對于沒有毒理數(shù)據(jù)支持的原料藥雜質(zhì)限度制定可以參考ICH Q3A指南��,如表1。
表1:新原料藥中雜質(zhì)的限度
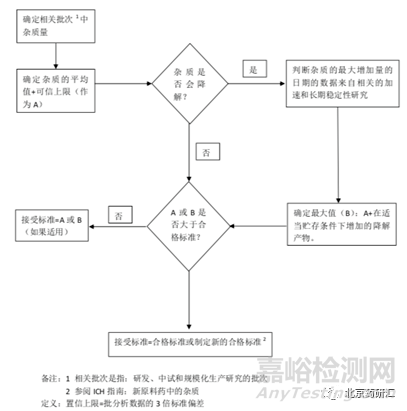
臨床研究后期��,應將商業(yè)化合成路線得到的放大生產(chǎn)樣品與臨床研究樣品中的雜質(zhì)進行詳細比較����,或已有雜質(zhì)的含量超出原有的限度時,可參考ICH Q6A指南�����,按下圖3進行決策分析��?���;蚨拘噪s質(zhì)的限度制定不在此文討論。
圖3:原料藥雜質(zhì)限度制定決策樹
五�����、關于變更后雜質(zhì)研究
對于工藝發(fā)生變更時��,應重新進行雜質(zhì)研究��,評估現(xiàn)有分析方法是否適用����。在藥物開發(fā)的早期,隨著藥物合成路線或工藝參數(shù)的變化��,均可能出現(xiàn)新的雜質(zhì)����。若起始原料或中間體發(fā)生變更,需重新研究以確認它們和它們衍生的雜質(zhì)�����,以及它們或它們衍生的雜質(zhì)是否會殘留至原料藥中����。溶劑和試劑發(fā)生變更也需將其作為新雜質(zhì)進行研究。在進行工藝變更對雜質(zhì)影響的風險評估過程中��,需要檢測可能生成的新工藝雜質(zhì)����。這涉及到對潛在的新工藝雜質(zhì)的預測能力、其被清除或轉(zhuǎn)移的可能性��,以及現(xiàn)有的雜質(zhì)檢測方法能否有效檢測它們��。
藥物批準后的任何工藝方面的變更都應評估對雜質(zhì)譜的潛在影響。除了工藝路線或所用材料的變更之外��,還應包括一系列其他可能的變更����。例如,生產(chǎn)場地����、工藝控制點、生產(chǎn)規(guī)模和原料供應商等變更�����。
六����、關于降解研究
大多數(shù)藥物的有效期并非受限于其有效性(即主藥含量),而是受限于其安全性(即生成的降解產(chǎn)物達到了關注閾值)�����,因此藥物的降解研究在藥物研發(fā)階段非常重要��。
監(jiān)管機構鼓勵制藥公司在I/II期臨床研究階段報告強制降解實驗結果�����,期望通過原料藥的強制降解研究�����,保證藥物在前期臨床試驗期間的穩(wěn)定性����。根據(jù)獲得的降解雜質(zhì)信息,初步了解藥物的降解途徑��,期望在早期階段開發(fā)的方法具有穩(wěn)定性指示性��。
在III期臨床研究階段��,原料藥強制降解需要開展深入研究工作����,以及對于藥物的降解途徑和降解方式進行深入的探討,獲得藥物在后期研發(fā)階段的潛在的穩(wěn)定性問題��,以確保產(chǎn)品貨架期質(zhì)量可控����。
降解實驗是預測����、了解原料藥穩(wěn)定性的重要工具����。降解雜質(zhì)可以通過強制降解和影響因素實驗研究獲得。強制降解實驗的目標是研究可能產(chǎn)生的和實際產(chǎn)生的降解產(chǎn)物�����,及用于開發(fā)和驗證具有穩(wěn)定性指示性的分析方法��。通過現(xiàn)代分析技術����,收集降解雜質(zhì)信息,對于研究原料藥降解途徑非常重要����。
在過去十年的藥物降解研究中,Zeneth®軟件已成為計算機預測藥物理論降解途徑的有力工具��。該軟件來自于Lhasa公司�����,它也是 METEOR® and DEREK®軟件的開發(fā)者。該軟件可以利用自身的藥物數(shù)據(jù)庫����,減少預測的偏差,通過模型幫助藥物工作者預測分析和理解藥物的降解途徑����。
另一個研究藥物降解研究的工具是Pharma D3數(shù)據(jù)庫��。它由兩位化學家和ChemDraw 軟件的開發(fā)公司Cambridge 在2005年共同建立����,數(shù)據(jù)庫收載了發(fā)表在文獻及公開研討會議中的藥物降解數(shù)據(jù)。研究者可通過藥物名稱����、結構或者降解物的結構進行搜索,還可以分子量的變化進行搜索��,以揭示特定官能團和藥物的降解模式��。
結束語
本文討論了原料藥雜質(zhì)研究中的一些思路和趨勢�����。仿制藥與創(chuàng)新藥雜質(zhì)研究的思路不同,但殊途同歸����,都需要關注各國法規(guī)和ICH指南的要求。創(chuàng)新藥研究在不同研究階段設定不同的目標����,緊跟新技術的發(fā)展,利用工具快速有效的將研究工作推進����。
藥物質(zhì)量要考慮安全性、有效性和可控性����。藥物的安全性常由藥物中雜質(zhì)的含量決定,藥物的貨架期也常受加速和長期穩(wěn)定性實驗中的雜質(zhì)含量影響����。降解研究是實現(xiàn)藥物雜質(zhì)研究的有效的途徑之一,利用一些軟件工具可幫助分析工作者了解藥物的降解途徑和模式����,幫助預測藥物的貨架期,提高藥物研發(fā)的效率,縮短研發(fā)周期����,從面降低研發(fā)成本。